多组份一锅法合成新型2-取代噻唑-4-甲酸衍生物*
2014-08-30邓兰青
邓兰青
(1.岳阳职业技术学院 岳阳市中草药综合利用重点实验室,湖南 岳阳 414000;2.中南大学 化学化工学院,湖南 长沙 410083)
·快递论文·
多组份一锅法合成新型2-取代噻唑-4-甲酸衍生物*
邓兰青1,2
(1.岳阳职业技术学院 岳阳市中草药综合利用重点实验室,湖南 岳阳 414000;2.中南大学 化学化工学院,湖南 长沙 410083)
以甲醇为溶剂,以醛、胺、硫代乙酸和3-(二甲氨基)-2-异氰基丙烯酸甲酯为原料,经四组份一锅法反应合成了9个新型的2-取代噻唑-4-甲酸衍生物,产率25%~54%,纯度90.3%~100%,其结构经1H NMR,13C NMR和LC-MS表征。
醛;胺;异腈;硫代乙酸;2-取代噻唑-4-甲酸;合成;一锅法
噻唑类杂环衍生物具有广泛的生物活性,常用于新药和农药的开发研究。研究表明,噻唑化合物可用于治疗过敏[1]、高血压[2]、骨年疏松[3]、哮喘[4]、癌症等疾病和抗HIV病毒[5],加之其广泛存在于天然产物中,对人类的毒性较低,从而引起了化学和药学研究者的极大兴趣[6-8]。
噻唑-4-羧酸类化合物及其衍生物已被广泛地研究[9],用于合成多种先导药物,在立体结构分析、分子结构修饰和生物活性方面也表现出显著的性质。Henke B等[10]采用固相多组份方法,将硫代乙酸(3)、异丙醛、3-(二甲氨基)-2-异氰基丙烯酸甲酯与带有伯胺的树脂一锅法反应制得噻唑-4-甲酸类化合物,但是从树脂上洗脱下来的产物纯度不高(30%~80%);Domling A等[11]选用路易氏酸作催化剂,采用醛,3和3-(二甲氨基)-2-异氰基丙烯酸甲酯三组分一锅法合成噻唑-4-甲酸,但产率较低(35%)。
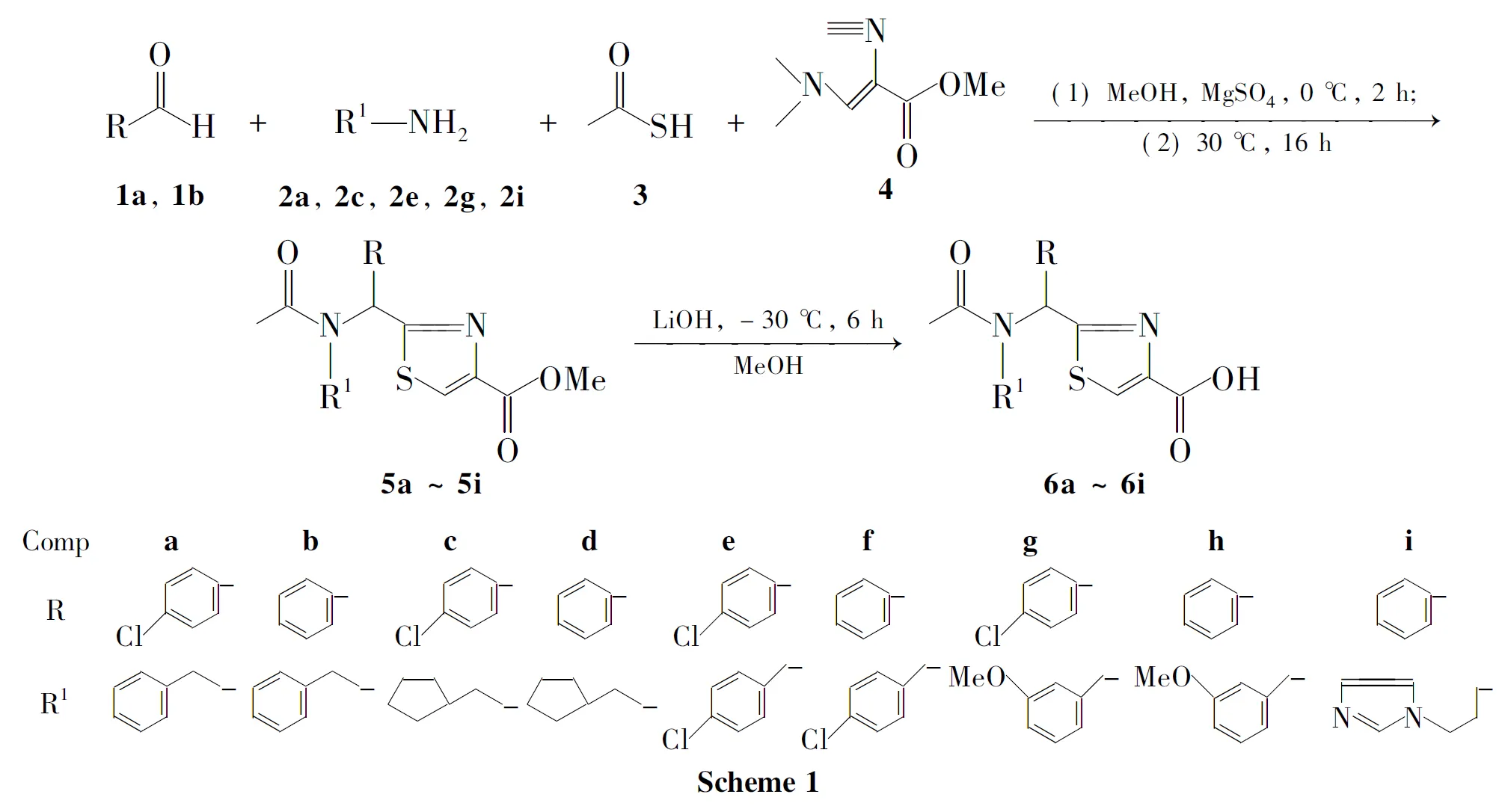
本文对多组分一锅法进行研究,以期合成纯度和产率均较好的噻唑-4-甲酸类化合物。分别以4-氯苯甲醛(1a)和苯甲醛(1b)为原料,与胺(2a,2c,2e,2g和2i),3和3-(二甲氨基)-2-异氰基丙烯酸甲酯(4)经四组份一锅法反应合成了9个新型的2-取代噻唑-4-甲酸衍生物(6a~6i,Scheme 1),产率25%~54%,纯度90.3%~100%,其结构经1H NMR,13C NMR和LC-MS表征。
该方法反应条件温和、纯度高、反应操作简便、无需催化剂,可将多种官能团组装到分子内。
1 实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪(温度未校正);WFH-203型三用紫外分析仪;Bruker-AV400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Aglilent 6000型液质联用仪。
所用试剂均为分析纯。
1.2 合成
(1)噻唑-4-甲酸甲酯衍生物(5a~5i)的合成(以5a为例)
在反应瓶中依次加入1a1.40g(10.0mmol)和无水甲醇10.0mL,搅拌下加入苯乙胺(2a)1.21g(10.0mmol)和无水硫酸镁1.2g(10.0mmol),冰水浴冷却,于0℃反应2h。冰盐浴冷却至-10℃,加入30.76g(10.0mmol)和41.54g(10.0mmol),于30℃反应16h。真空旋干溶剂得5a,直接进行下步反应。
用类似方法合成5c,5e和5g,直接进行下步反应。
用1b代替1a,用类似方法合成5b,5d,5f,5h和5i。
(2)6a~6i的合成(以6a为例)
在反应瓶中依次加入5a,1.0mol·L-1氢氧化锂溶液30mL和甲醇60mL,搅拌下于30℃反应6h。真空旋除溶剂,用0.1mol·L-1盐酸调至pH3~5,用二氯甲烷(2×50mL)萃取,合并萃取液,浓缩后经硅胶柱层析[洗脱剂:V(二氯甲烷)∶V(甲醇)=15∶1]纯化得6a1.86g。
用类似方法合成6b~6i。
2-[(N-苯乙基乙酰胺)-4-氯苯基甲基]噻唑-4-甲酸(6a): 白色片状晶体,产率45%,纯度99.3%(LC-MS,下同),m.p.569℃~571℃;1H NMRδ: 2.30(s,3H,CH3),2.85(t,J=8.0Hz,2H,CH2),3.51(t,J=12.0Hz,2H,CH2),6.14(s,1H,CH),7.17~7.40(m,9H,CH),9.10(s,1H,CH),10.85(s,1H,OH);13C NMRδ: 21.2,34.6,47.1,67.5,125.7,127.7,128.7,129.4,132.5,134.9,139.2,146.5,168.9,169.3,170.3;ESI-MSm/z(%): 415.1{[M+H]+,100},417.1{[M+3]+,42.2}。
2-[(N-苯乙基乙酰胺)-苯甲基]噻唑-4-甲酸(6b): 白色固体,产率47%,纯度100%,m.p.426℃~429℃;1H NMRδ: 2.31(s,3H,CH3),2.82(t,J=10.0Hz,2H,CH2),3.52(t,J=8.0Hz,2H,CH2),6.16(s,1H,CH),7.25~7.41(m,10H,CH),9.13(s,1H,CH),10.97(s,1H,OH);13C NMRδ: 21.5,34.4,47.5,67.6,125.8,127.0,127.7,127.9,128.5,128.7,136.8,139.2,146.5,168.1,169.3,170.8;ESI-MSm/z(%): 381.2{[M+H]+,100},382.1{[M+2]+,25.8}。
2-[(N-环戊乙基乙酰胺)-4-氯苯甲基]噻唑-4-甲酸(6c): 淡黄色固体,产率41%,纯度100%,m.p.532℃~535℃;1H NMRδ: 1.33~1.60(m,11H,CH2,CH),2.33(s,3H,CH3),3.22(t,J=6.0Hz,2H,CH2),6.15(s,1H,CH),7.18(d,J=10.0Hz,2H,CH),7.38(d,J=8.0Hz,2H,CH),9.12(s,1H,CH),10.97(s,1H,OH);13C NMRδ: 21.4,25.1,32.6,32.9,35.5,44.0,67.3,127.3,128.5,129.4,132.4,134.8,146.5,168.5,169.4,170.9;ESI-MSm/z(%): 407.0{[M+H]+,100},409.1{[M+3]+,34.8}。
2-[(N-环戊乙基乙酰胺)苯甲基]噻唑-4-甲酸(6d): 白色固体,产率53%,纯度100%,m.p.491℃~493℃;1H NMRδ: 1.32~1.63(m,11H,CH2,CH),2.30(s,3H,CH3),3.23(t,J=8.0Hz,2H,CH2),6.17(s,1H,CH),7.23~7.40(m,5H,CH),9.15(s,1H,CH),11.00(s,1H,OH);13C NMRδ: 21.3,25.2,32.5,32.8,35.4,44.1,67.5,127.1,127.5,128.0,128.6,130.1,146.5,168.4,169.6,170.9;ESI-MSm/z(%): 373.1{[M+H]+,100},374.2{[M+2]+,24.3}。
2-[(N-4-氯苯基乙酰胺)-4-氯苯甲基]噻唑-4-甲酸(6e): 淡黄色固体,产率38%,纯度100%,m.p.591℃~595℃;1H NMRδ: 2.31(s,3H,CH3),4.43(s,2H,CH2),6.17(s,1H,CH),7.16(d,J=12.0Hz,2H,CH),7.30~7.40(m,6H,CH),9.15(s,1H,CH),11.17(s,1H,OH);13C NMRδ: 21.2,48.7,67.5,127.3,128.5,129.1,130.3,132.9,134.2,135.1,146.9,168.5,169.3,170.4;ESI-MSm/z(%): 434.9[M+,100],436.1{[M+2]+,70.8}。
2-[(N-4-氯苯基乙酰胺)苯甲基]噻唑-4-甲酸(6f): 白色固体,产率54%,纯度99.3%,m.p.550℃~554℃;1H NMRδ: 2.33(s,3H,CH3),4.46(s,2H,CH2),6.15(s,1H,CH),7.24~7.39(m,9H,CH),9.13(s,1H,CH),11.03(s,1H,OH);13C NMRδ: 21.4,49.1,67.2,126.8,127.5,127.9,128.4,128.6,130.5,132.4,134.7,137.1,146.9,168.3,169.4,170.5;ESI-MSm/z(%): 401.1{[M+H]+,100},403.1{[M+3]+,38.5}。
2-{(4-氯苯基)[N-(3-甲氧基苯基)乙酰胺]甲基}噻唑-4-甲酸(6g): 白色固体,产率40%,纯度100%,m.p.595℃~598℃;1H NMRδ: 2.33(s,3H,CH3),3.85(s,3H,CH3),4.50(s,2H,CH2),6.16(s,1H,CH),6.80(d,J=12.0Hz,2H,CH),7.02(s,1H,CH),7.15~7.25(m,3H,CH),7.35(d,J=12.0Hz,2H,CH),9.14(s,1H,CH),10.87(s,1H,OH);13C NMRδ: 21.4,49.5,55.7,67.1,119.9,112.7,120.3,127.1,128.5,129.4,129.6,132.5,134.9,137.5,146.5,160.1,168.0,169.5,170.8;ESI-MSm/z(%): 431.0{[M+H]+,100},433.0{[M+3]+,38.5}。
2-{[N-(3-甲氧基苯基)乙酰胺]苯甲基}噻唑-4-甲酸(6h): 淡黄色固体,产率49%,纯度100%,m.p.557℃~559℃;1H NMRδ: 2.31(s,3H,CH3),3.83(s,3H,CH3),4.48(s,2H,CH2),6.15(s,1H,CH),6.79(d,J=8.0Hz,2H,CH),7.00(s,1H,CH),7.20~7.40(m,6H,CH),9.13(s,1H,CH),10.77(s,1H,OH);13C NMRδ: 21.3,49.3,55.9,67.3,112.0,112.6,120.1,127.0,127.5,127.9,128.6,129.5,136.8,137.4,146.8,160.5,168.2,169.6,170.6;ESI-MSm/z(%): 397.1{[M+H]+,100},398.1{[M+2]+,22.6}。
2-N-[3-(1H-咪唑-1-乙酰胺)苯甲基]噻唑-4-甲酸(6i): 黄色固体,产率25%,纯度90.3%,m.p.476℃~479℃;1H NMRδ: 1.97~2.05(m,2H,CH2),2.33(s,3H,CH3),3.23(t,J=10.0Hz,2H,CH2),4.05(t,J=12.0Hz,2H,CH2),6.17(s,1H,CH),6.78(d,J=8.0Hz,2H,CH),7.20~7.39(m,6H,CH),7.95(s,1H,CH),9.14(s,1H,CH),10.97(s,1H,OH);13C NMRδ: 21.4,29.6,43.9,47.5,67.8,120.5,127.0,127.5,127.9,128.1,128.6,136.7,137.9,147.0,168.5,169.5,170.7;ESI-MSm/z(%): 399.0{[M+15]+,100}。
2 结果与讨论
2.1 反应机理
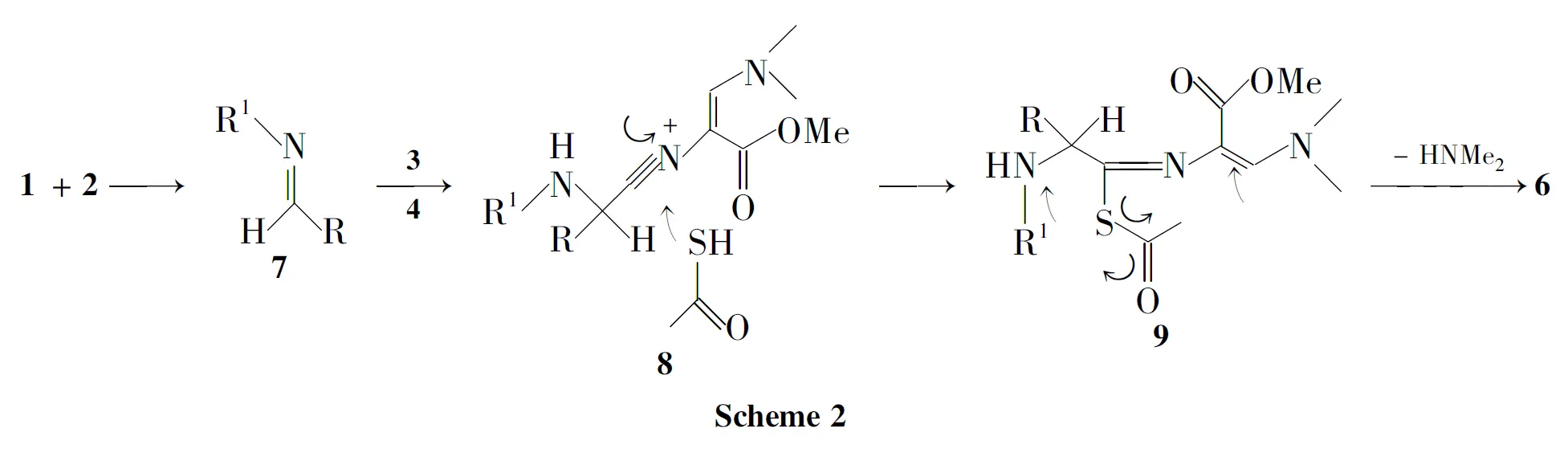
推测合成6的反应机理如Scheme 2所示。首先醛(1)与胺(2)缩合形成亚胺化合物(7);7被3质子化形成亲电试剂,硫代乙酸根同时也为亲核试剂,它们同时与异腈上的碳原子加成反应,异腈进攻7上的亚胺键,形成化合物8。3上的硫原子进攻异腈上的碳,关环,脱去一分子二甲胺,同时进行分子内重排得6。
2.2 底物对多组分反应的影响
我们曾尝试将反应物底物中的醛(1)用1-茚酮或苯乙酮替换,在其余反应条件不变的情况下,并未获得目标产物。将反应温度升至50℃,也未获得目标产物。为进一步证实反应过程,我们将苯乙酮与2a进行反应,经液质联用检测得到了相应的亚胺,亚胺再与3和4反应,未生成目标产物。由此可知,由于酮与胺形成亚胺,亚胺上的甲基阻碍了异腈分子进攻亚胺,故导致未能获得目标产物。
采用1b为原料,将胺换成带有醚基的直链伯胺或是带有杂环的伯胺,其余反应条件不变,所得目标产物非常少,如2i与1b,3和4反应生成的5i,产率仅25%左右,而1b与苄胺、脂肪烃伯胺反应,产率均在50%以上。因此,带有醚基的直链伯胺或带有杂环的伯胺,由于醚基或杂环的存在,降低胺的活性,导致反应产率不高。
[1] Kashyap S J,Garg V K,Sharma P K,etal.Thiazoles:Having diverse biological activities[J].Med Chem Res,2012,21(8):2123-2132.
[2] Teoh D,Ayeni T A,Rubatt J M,etal.Dasatinib(BMS-35482)has synergistic activity with paclitaxel and carboplatin in ovarian cancer cells[J].Gynecol Oncol,2011,121(1):187-192.
[3] Fang B,Zhou C H,Rao X C.Synthesis and biological activities of novel amine-derived bis-azoles as potential antibacterial and antifungal agents[J].Eur J Med Chem,2010,45(9):4388-4398.
[4] Francesco M E D,Dessole G,Nizi E P,etal.Novel macrocyclic inhibitors of hepatitis C NS3/4A protease featuring a 2-amino-1,3-thiazole as a P4carbamate replacement[J].J Med Chem,2009,52(22):7014-7028.
[5] Rostom S A F,El-Ashmawy I M,Badr M H,etal.Design and synthesis of some thiazolyl and thiadiazolyl derivatives of antipyrine as potential non-acidic anti-inflammatory,analgesic and antimicrobial agents[J].Bioorg Med Chem,2009,17(2):882-895.
[6] 崔胜峰,王艳,吕敬松,等.噻唑类化合物应用研究新进展[J].中国科学:化学,2012,42(8):1105-1131.
[7] 王冬梅,孙军勇,商永嘉.氨基噻唑类化合的合成研究进展[J].有机化学,2011,31(7):1136-1143.
[8] 竺宁,张志伟,高敏,等.2-取代苯并噻唑类衍生物合成方法研究的新进展[J].有机化学,2013,33:1427-1436.
[9] 王超,郑学仿,张前.不同位置取代的噻唑烷-4-羧酸及其衍生物的研究进展[J].有机化学,2010,30(10):1441-1454.
[10] Henkel B,Sax M,Domling A.A new and efficient multicomponent solid-phase synthesis of 2-acylaminomethylthiazoles[J].Tetrahedron Letters,2003,44:3679-3682.
[11] Domling A,Henkel B,Beck B,etal.Convergent multicomponent assembly of 2-acyloxymethyl thiazoles[J].Tetrahedron Letters,2003,44:8947-8950.
SynthesisofNovel2-SubstitutedThiazole-4-carboxylicAcidDerivativesbyMulticomponentOne-potReaction
DENG Lan-qing1,2
(1.Key Laboratory of Yueyang Chinese Herbal Utilization,Yueyang Vocational Technical College,Yueyang 414000, China;2.School of Chemistry and Chemical Engineering,Central South University,Changsha 410083,China)
Nine novel 2-substituted thiazole-4-carboxylic acid derivatives in the yield of 25%~54% with purity of 90.3%~100% were synthesized by four component one-pot reaction of aldehyde,amine,thioacetic acid and 3-dimethylamino-2-isocyano-acrylic acid methyl ester in methanol.The structures were characterized by1H NMR,13C NMR and LC-MS.
aldehyde;amine;thioacetic acid;isonitrile;2-substituted thiazole-4-carboxylic acid;synthesis;one-pot
2014-02-18
湖南省科技厅项目(2010FJ4112)
邓兰青(1982-),女,汉族,湖南岳阳人,博士研究生,主要从事药剂绿色合成和资源综合回收利用的研究。E-mail: denglq1111@126.com
O626.25;O621.3
A
1005-1511(2014)05-0643-04
