新型多肽固相合成链接子{4-[叔丁氧羰基氨基-(2′,4′-二甲氧基苄基)]苯氧基乙酸}的合成*
2014-08-30黄晴菲袁伟成王启卫
张 盼,邹 胜,黄晴菲,朱 槿,袁伟成,王启卫
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.中国科学院大学,北京 100039)
·快递论文·
新型多肽固相合成链接子{4-[叔丁氧羰基氨基-(2′,4′-二甲氧基苄基)]苯氧基乙酸}的合成*
张 盼1,2,邹 胜1,黄晴菲1,朱 槿1,袁伟成1,王启卫1
(1.中国科学院 成都有机化学研究所,四川 成都 610041;2.中国科学院大学,北京 100039)
以4-羟基苯甲酸和间苯二甲醚为原料,经傅-克酰基化反应、苄基保护、还原氨化、Boc保护氨基、脱苄基、亲核取代反应、酯水解等7步反应合成了一个新型的多肽固相合成的链接子4-[叔丁氧羰基氨基-(2′,4′-二甲氧基苯基)]苯氧基乙酸,总收率47.2%,纯度>98%,其结构经1H NMR,13C NMR和HR-MS确证。
多肽;固相合成;链接子;合成;工艺改进
多肽是一种重要的生物活性物质,已广泛用于多肽药物、多肽药物载体及肽类食品和化妆品等领域[1]。目前,多肽的化学合成技术包括液相合成和固相合成两种。其中固相法合成多肽省时、省力、省料、便于自动化等优势,已成为多肽合成的常规方法,并已扩展到核苷酸合成等其他有机物领域[2]。
固相合成的关键步骤是将目标分子连接到固相载体上,可通过能切割的连接基团实现。连接基团可看作一种双功能保护基,它一方面通过一种容易切割的不稳定的键(如酯键、酰胺键等)与目标分子相连,另一方面又通过一种相对稳定的键(如碳-碳键、醚键等)把目标分子固定在固相载体上。因此选择理想的连接基团直接关系到固相合成策略的成功[3]。
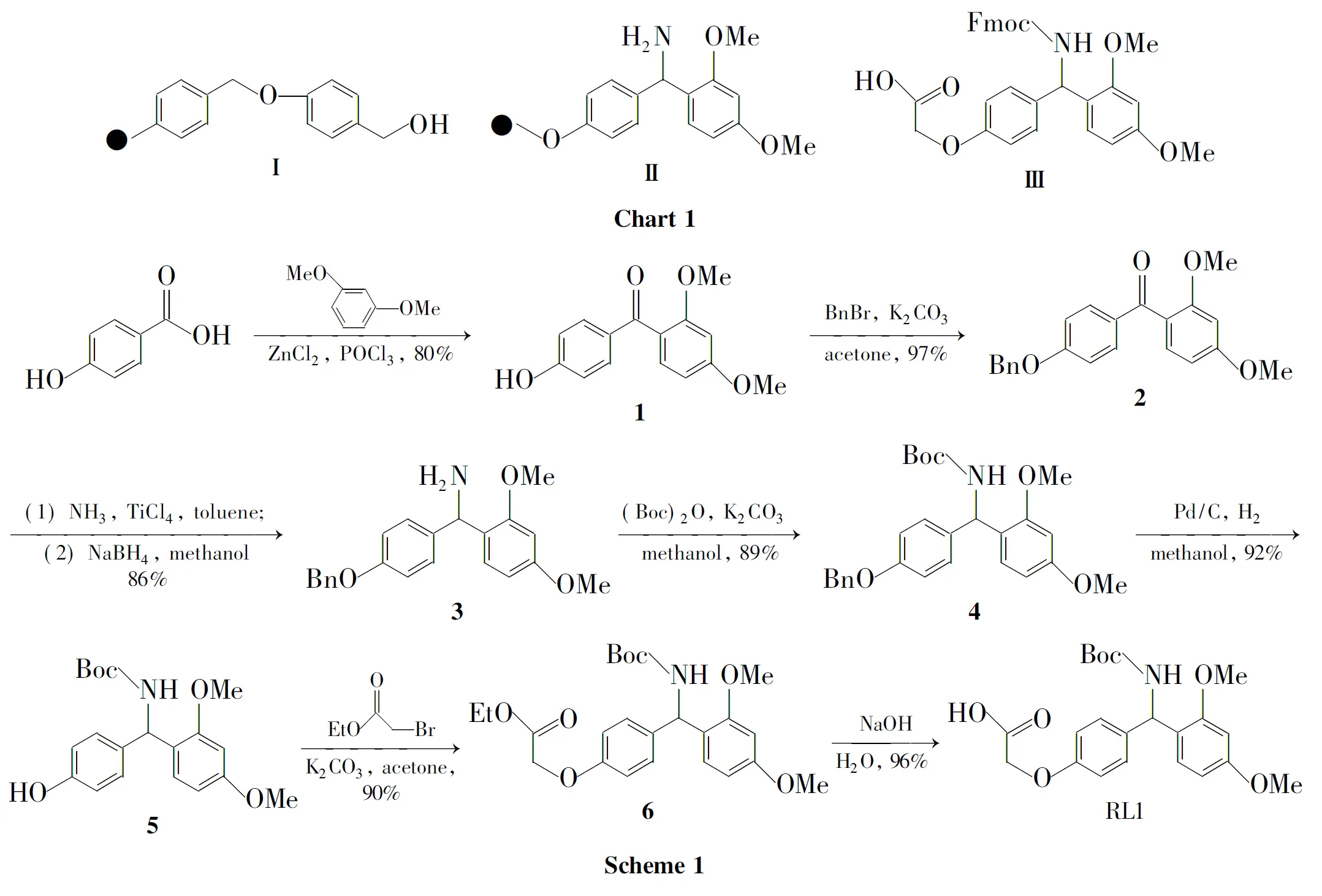
目前,在多肽固相合成中,使用最广泛的连接基团有两种:Wang连接基团(Ⅰ,Chart 1)[4]和Rink连接基团(Ⅱ,Chart 1)[2-5],其中Ⅱ因其可在温和的条件下定量地使产物分子脱离下来,使其应用更为广泛。
Rink linker(Ⅲ,Chart 1)作为链接子已得到广泛使用,主要用来合成肽链末端带酰胺基的多肽,而酰胺基通常是多肽活性所必需的基团。因此对Ⅲ的研究不仅具有一定的理论意义,还具有较大的实用价值。Takahashi等[6]报道了以4-羟基苯甲酸和间苯二甲醚为原料,经傅-克酰基化反应、亲核取代、酯水解、还原氨化、Fmoc-OSu保护等5步反应合成Ⅲ。该方法收率低(总收率35.8%)、反应时间长、催化剂昂贵(PtO2催化剂)、溶剂用量大等,不利于工业化生产。
针对以上问题,本文在文献[6]方法的基础上对原工艺进行了部分改进,并设计了一条合成新型Rink类链接子RL1的新工艺路线。以4-羟基苯甲酸和间苯二甲醚为原料,经傅-克酰基化反应、苄基保护、还原氨化、Boc保护氨基、脱苄基、亲核取代反应、酯水解等7步反应合成了用于多肽固相合成的链接子RL1——4-[叔丁氧羰基氨基-(2′,4′-二甲氧基苯基)]苯氧基乙酸(Scheme 1),总收率47.2%,纯度>98%,其结构经1H NMR,13C NMR和HR-MS确证。
Ⅲ与RL1仅在NH上的保护基不同,我们期待RL1作为多肽固相合成链接子能广泛应用于多肽的固相合成中。
1 实验部分
1.1 仪器与试剂
Bruker-300型核磁共振仪(CDCl3为溶剂,TMS为内标);TOF 6244型飞行时间质谱仪;SPD-10A型高效液相色谱仪(色谱柱C18)。
所用试剂均为工业品。
1.2 合成
(1)4-(1-氧代-2′,4′-二甲氧基苄基)苯酚(1)的合成[6]
在三口瓶中依次加入4-羟基苯甲酸5g(36.22mol),间二甲氧基苯5.25g(38.02mmol),氯化锌5.48g(40.21mmol)和三氯氧磷16.6mL(0.18mol),氮气保护,搅拌下于60℃反应4h(TLC监测)。冷却至室温,缓慢倒入乙醇/水(V/V=1/1,20mL)中,搅拌,析出沉淀。过滤,滤饼干燥得淡红色固体17.48g,收率80%;1H NMRδ: 7.74~7.71(d,J=8.65Hz,2H),7.35~7.33(d,J=8.21Hz,1H),6.87~6.85(d,J=8.63Hz,2H),6.55~6.51(m,2H),6.00~4.50(br,1H),3.86(s,3H),3.71(s,3H)。
(2)4-(1-氧代-2′,4′-二甲氧基苄基)-O-苄基苯酚(2)的合成[7]
在单口瓶中加入12.58g(10.00mmol)和丙酮20mL,搅拌使其溶解;加入碳酸钾1.56g(11.20mmol)和苄溴2.05g(12.00mmol),回流反应3h(TLC监测)。冷却至室温,减压蒸除溶剂,加入乙醇/水(V/V=1/2)50mL,搅拌片刻,有沉淀析出。过滤,滤饼干燥得黄色固体23.38g,收率97%;1H NMRδ: 7.80~7.77(d,J=8.67Hz,2H),7.45~7.33(m,6H),6.99~6.96(d,J=8.71Hz,2H),6.56~6.52(d,J=6.17Hz,2H),3.87(s,3H),3.72(s,3H)。
(3)4-(1-氨基-2′,4′-二甲氧基苄基)-O-苄基苯酚(3)的合成[8-9]
在三口瓶中加入21.75g(5.03mmol)和甲苯25mL,搅拌使其溶解;冰浴冷却,氨气氛围下加入TiCl41.5mL(6.03mmol)(反应液呈红色),通氨气20min(溶液颜色变为黄色),反应过夜(TLC监测)。加入饱和碳酸钾溶液20mL,搅拌1h。过滤,滤液分液,水相用甲苯(3×10mL)萃取,合并有机相,用无水NaSO4干燥,浓缩后用甲醇(30mL)溶解,冰浴冷却下,分批(2次)加入NaBH40.23g(6.03mmol),反应2h。加水10mL淬灭反应,旋蒸除去甲醇,水相用CH2Cl2(3×10mL)萃取,合并萃取液,用无水NaSO4干燥,浓缩得淡黄色固体31.51g,收率86%;1H NMRδ: 7.46~7.30(m,7H),7.15~7.12(d,J=9.00Hz,1H),6.94~6.91(d,J=8.59Hz,2H),6.46~6.43(m,2H),5.40(s,1H),5.05(s,2H),3.79~3.78(d,6H),1.95(br,2H)。
(4)4-[1-叔丁氧羰基氨基-(2′,4′-二甲氧基苄基)]-O-苄基苯酚(4)的合成
在单口瓶中加入33.49g(10.00mmol)和甲醇30mL,搅拌使其溶解;冰浴冷却,加入K2CO30.69g(5.00mmol),缓慢滴加(Boc)2O 2.5mL(10.87mmol)的甲醇(10mL)溶液,滴毕,反应4h(析出固体,TLC检测)。过滤,滤饼干燥得白色固体44.00g,收率89%;1H NMRδ: 7.14~7.12(m,3H),6.82~6.79(d,J=8.71Hz,2H),6.47~6.44(m,2H),5.97~5.95(d,J=7.83Hz,1H),5.54(br,1H),3.79(s,3H),3.70(s,3H),1.44(s,9H)。
(5)4-[1-叔丁氧羰基氨基-(2′,4′-二甲氧基苄基)]苯酚(5)的合成[10]
在单口瓶中加入43.03g(6.75mmol)和甲醇50mL,搅拌使其溶解;加入10%Pd/C 0.3g,反应5h(TLC检测)。过滤,滤液浓缩得黄色固体52.23g,收率92%;1H NMRδ: 7.10~7.07(d,J=4.46Hz,1H),7.00~6.98(d,J=8.24Hz,2H),6.67~6.65(d,J=8.51Hz,2H),6.45~6.43(m,2H),5.95~5.93(d,J=7.28Hz,1H),5.62~5.60(br,1H),5.50~4.00(br,1H),3.78(s,3H),3.70(s,3H),1.45(s,9H)。
(6)4-[1-叔丁氧羰基氨基-(2′,4′-二甲氧基苄基)]苯氧基乙酸乙酯(6)的合成[6]
在反应瓶中依次加入5360mg(1.01mmol),溴乙酸乙酯2.02g(1.21mmol),K2CO3170mg(1.21mmol)和丙酮20mL,搅拌下于回流(60℃)反应4h。冷却至室温,减压蒸馏除溶剂,残余物加水15mL,搅拌,过滤,滤饼干燥得黄色固体60.40g,收率90%;1H NMRδ: 7.14(m,3H),6.81~6.79(d,J=8.61Hz,2H),6.46~6.44(m,2H),5.97~5.95(d,J=7.41Hz,1H),5.55(s,1H),4.57(s,2H),4.29~4.22(q,2H),3.79(s,3H),3.70(s,3H),1.44(s,9H),1.31~1.26(t,3H)。
(7)RL1的合成[6]
在反应瓶中依次加入NaOH 50mg(1.18mmol)的水(20mL)溶液和6440mg(0.99mol),搅拌下于室温反应过夜(TLC监测)。用1mol·L-1盐酸调至pH≈3,用乙酸乙酯(3×10mL)萃取,合并萃取液,用无水NaSO4干燥,浓缩得淡黄色固体RL10.40g,收率96%;1H NMRδ: 9.71(br,1H),7.15~7.12(m,3H),6.82~6.79(d,J=8.70,2H),6.50~6.43(m,2H),4.59(s,2H),3.81(s,3H),3.72(s,3H),1.45(s,9H);13C NMRδ: 172.8,160.2,157.9,156.3,155.5,135.9,129.3,127.7,122.6,114.2,103.9,99.2,81.1,79.7,64.9,55.3,54.2,28.4;HR-MSm/z: Calcd for C17H27O5{[M-BocNH]+} 301.12,found 301.11。
2 结果与讨论
在合成1时,直接以POCl3为溶剂,避免了使用高沸点溶剂硝基苯,且收率提高至80%(64%[6]),反应时间大大缩短。大量生产时多余的POCl3可以回收套用。
在还原氨化反应中,以NH3作为原料,TiCl4为脱水剂,生成亚胺,再用NaBH4为还原剂,避免使用昂贵的金属催化剂,降低了生产成本。
在合成6时,本文以溴乙酸乙酯为原料,与氯乙酸乙酯相比,前者反应效率更高,缩短了反应时间并大大降低了反应溶剂用量。
与文献[6]方法相比,该合成方法反应过程中避免使用昂贵的催化剂、反应效率高、后处理简单、生产成本更低,有利于工业化制备。
[1] 许亚平,曹华.多肽药物的研究及应用进展[J].广东药学学报,2010,26:653-657.
[2] Bruce Merrifield.Solide phase synthesis[C].Rockefeller University,New York,1984.Great Britain,1985:353-376.
[3] 秦斯民,余磊.固相多肽合成综述[J].科技信息,2010,12:180.
[4] Ian W James.Linkers for solid phase organic synthesis[J].Tetrahedron,1999,55:4855-4946.
[5] Michael S Bernatowicz,Scott B Daniels,Hubert Koster.A comparison of acid labile linkage agents for the synthesis of peptide C-terminal amides[J].Tetrahedron Letters,1989,30(35):4645-4648.
[6] Seiji Sawada,Kumiko Yasui,Sho Takahashi.Improved synthesis of 4-[(R,S)-1-[1-(9H-Fluoren-9yl)-methoxycarbonylamino]-(2′,4′-dimethoxybenzyl)phenoxyacetic acid as a peptide-resin linker in the solid-phase synthesis of peptide-amides[J].Biosci Biotech Biochem,1992,56:1506-1507.
[7] Raymond C F Jones,Sze Chak Yau,James N lley.Synthesis of the pyoverdin chromophore by a biomimetic oxidative cyclization[J].Organic Letters,2009,11(7):15119-1522.
[8] Bruhaspathy Miriyala,Sukanta Bhattacharyya,John S Williamson.Chemoselective reductive alkylation of ammonia with carbonyl compounds:Synthesis of primary and symmetrical secondary amines[J].Tetrahedron,2004,6:1463-1471.
[9] Daniel G Brenner,Kathleen Mensler Cavolowsky,Kenneth L Shepard.A facile synthesis of sulfenimines derived from diaryl ketones[J].J Heterocyclic,1985,22:805-808.
[10] Jan Schraml,Magdalena Kvicalova,Vaclav Chvalovsky.29Si and13C NMR spectra of 4-substituted 2-methoxytrimethylsiloxybenzenes,factors determining the chemical shifts in models of lignin constituents[J].Magnetic Resonance in Chemistry,1990,28(11):973-978.
SynthesisofaNovelLinker4-[t-Butyloxycarbonylamino)-(2′,4′-dimethoxybenzyl)]phenoxyaceticAcidfortheSolid-phaseSynthesisofPeptide
ZHANG Pan,ZOU Sheng,HUANG Qing-fei, ZHU Jin, YUAN Wei-cheng, WANG Qi-wei
(1.Chengdu Institute of Organic Chemistry,Chinese Academy of Sciences,Chengdu 610041,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
A novel linker RL1{4-[t-Butyloxy carbonylamino)-(2′,4′-dimethoxybenzyl)]phenoxyacetic acid} in total yield of 47.2% with purity of over 98%,a linkage for the solid-phase synthesis of peptide,was synthesized by a seven-step reaction including F-C reaction,group protection,reductive amination,deprotection reactions,etc,using 4-hydroxybenzoic acid and 1,3-dimethoxybenzene as the starting materials.The structure was confirmed by1H NMR,13C NMR and HR-MS.
peptide;solid-phase synthesis;linker;synthesis;process improvement
2014-02-28
中国科学院“西部之光”人才培养计划项目
张盼(1988-),女,汉族,湖北仙桃人,硕士研究生,主要从事有机化学的研究。
王启卫,副研究员,E-mail: wqw@cioc.ac.cn
O625.3;O621.3
A
1005-1511(2014)05-0634-04
