房颤患者小分子RNA组学研究结果与分析
2014-08-30岳语喃杨水祥
岳语喃 杨水祥
房颤患者小分子RNA组学研究结果与分析
岳语喃 杨水祥
目的 探讨非瓣膜病心房颤动(房颤)患者血清小分子RNA(miRNA)全基因组表达差异及其可能的调控作用和早期预警价值。方法 15例房颤患者,分为阵发性、持续性和永久性房颤组,每组5例,对照组5例健康人。射频消融术前和术中分别取外周血和冠状窦血,提取血浆总RNA,使用microRNA芯片(microRNA v 18.0)进行全基因组miRNA表达谱微阵列分析,Volcano Plot法获得差异表达miRNAs,并用tMEV软件进行聚类分析,以及通过mirbase、miranda、targetscan数据库进行靶基因分析,并进行RT-PCR的差异表达验证。结果 房颤组冠状窦血与外周血比较有14个miRNAs表达差异显著,其中6个表达上调:即 miR-1266、miR-4279、miR-4787-5p、miR-4666a-3p、kshv-miR-K12-6-3p 和 miR-3150a-5p,8 个表达下调:即 miR-892a、miR-3149、miR-3171、miR-3664-5p、miR-3591-3p、miR-4423-5p、miR-4473 和 miR-574-3p。其中,miR-1266在阵发性、持续性和永久性房颤组均明显升高,而miR-3171则显著降低。房颤组与对照组外周血及冠状窦血比较miRNAs表达也有明显差异。结论 房颤患者冠状窦血与外周血比较miRNAs表达均有显著差异,而冠状窦血miRNAs更能反映心脏的代谢与调控状况;血清miR-3171、miR-892a、miR-3149在房颤发生发展早期出现且持续表达差异,有可能成为早期预警诊断的标志物;miR-1266、miR-4279、miR-4666a-3p有可能成为未来治疗房颤的干预靶点。
心房颤动; 小分子RNA; 基因调控; 早期诊断
心房颤动(房颤,atrial fibrillation,AF)是目前最常见的心律失常,是造成脑卒中及心功能损害的主要原因[1-3]。但发病机制至今尚不清楚,且缺乏有效的早期预警诊断方法。
研究表明,小分子RNA(miRNA)参与调控房颤相关的多种基因[4]。随着检测技术的不断成熟[5,6],针对房颤相关miRNA的研究越来越多地受到了关注。Lu等[7]发现miR-328与瓣膜性房颤相关;张瑜等[8]、Liu等[9]分别用芯片和测序技术进行了非瓣膜性房颤外周血miRNA表达差异分析。但房颤患者冠状窦血miRNA与外周血比较的差异表达尚未见报道。本研究以高通量生物芯片技术,观察了20例阵发性、持续性和永久性房颤患者冠状窦血及外周血miRNA的特异性差异表达,并通过冠状窦血与外周血及与健康人的比较,试图发现miRNA调控房颤的机制,以及一些可能的房颤早期预警诊断标记物和干预靶点。
1 对象与方法
1.1 研究对象 本研究选取我院心内科15例行房颤射频消融术患者(分为阵发性、持续性和永久性房颤组各 5例),平均年龄(67.67±5.75)岁,女性8例,男性7例。正常对照组5例,平均年龄(61.40±3.36)岁。每位患者均有5份以上不同时间的ECG支持房颤诊断。排除标准:年龄>75岁,甲状腺功能亢进,糖尿病,血压控制不良(>140/90 mm Hg)(1 mm Hg=0.133 kPa),左室功能减低(EF<40%),严重冠状动脉疾病,肝、肾功能障碍,急、慢性感染疾病,心肌结构性病变。患者入组后均接受β受体阻滞剂(β-blocker)、血管紧张素转化酶抑制剂(ACEI)、血管紧张素受体抑制剂(ARB)、他汀类等药物规范控制血压、血脂。
本研究方案经院伦理委员会审批通过。参与患者均签署知情同意书。
1.2 试验仪器材料 第七代miRCURYTMLNA microRNA 芯片(v8.0 Exqion)、miRCURY Array Power Labeling kit标记试剂盒(Cat#208032-A Exiqon)Wash buffer试剂盒(Exiqon)、TRIzol Reagent(Invitrogen life technologies)、miRNeasy mini试剂盒(Qiagen)、分光光度计(Sigma NanodropR ND-1000)、Axon Gene Pix 4000B微阵列芯片扫描仪。
1.3 试验方法
1.3.1 标本收集及储存 射频消融术前、术中分别抽取外周血、冠状窦血各4 ml,分别置于EDTA抗凝管中,2 h内分离血浆,1500 r/min离心15 min,吸上清液至冻存管中,-80℃保存。
1.3.2 RNA的提取及标记 按照说明书用TRIzol Reagent和miRNeasy mini试剂盒提取总 RNA,分光光度计测定RNA浓度和纯度。分离RNA,采用miRCURYTMArray Power Labeling kit标记试剂盒进行miRNA标记。CIP和CIP buffer的混合物(1∶1),经孵育、离心后,依次加入标记缓冲液、荧光探针(Hy3TM)、DMSO和标记酶等,16℃下孵育1 h后终止,置于4℃保存。
1.3.3 芯片杂交 标记后,采用miRCURYTMLNA microRNA芯片对Hy3TM标记的样品进行杂交,操作按芯片说明书进行。样品混合物与杂交缓冲液混合,经变性、冰上孵育、杂交过夜后离心5 min,干燥;微阵列芯片扫描仪扫描玻片,GenePix pro V6.0数据分析。
1.3.4 实时定量PCR(real-time PCR) Real-time PCR检测标本中 5种 miRNA(miR-1266、miR-4279、miR-3171、miR-3149、miR-892a) 的表达情况。按照说明书Trizol LS Reagent提取样品中RNA。紫外吸收测定法进行RNA质量检测,使用Nano Drop ND-1000测定RNA浓度、纯度。使用样品的RNA进行cDNA合成。RT primers合成如表1(上海百力格生物)。
利用ViiA7 Real-time PCR System进行Realtime PCR反应。内参(has-miR-93)及所有指标均按以下程序进行:95℃,10 min;40个 PCR循环(95℃,10 sec;60℃,60 sec收集荧光),建立 PCR产物溶解曲线。各样品目的miRNA和内参分别进行Realtime PCR反应。数据采用2-△△CT法分析。
1.3.5 靶基因预测 预测miRNA靶基因主要通过mirbase、miranda、targetscan三个数据库进行。利用Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库对预测结果进行信号通路归类,而后根据Gene Ontology project数据库对靶基因参与的生化过程、细胞组分及分子功能进行分析。
1.4 统计学方法 采用SPSS 16.0统计学软件。本研究中均采用t检验。P<0.05表示差异具有统计学意义。

表1 RT引物序列
2 结果
芯片研究结果以标准值比值>1.5倍为显著上调(P<0.05),比值<1.5倍为显著下调(P<0.05)。
2.1 房颤患者组与正常对照组miRNAs表达的差异 房颤患者组冠状窦血(AFCS组)与正常对照外周血(N组)比较,共有64种表达增多,132种减少。其中miR-1266上调11.38倍,miR-4279上调2.38倍;miR-3171、miR-3664-5p 下调比值分别是0.09、0.14(相当于下调 11.43、6.96 倍),miR-892a、miR-3149无显著变化。见表2。
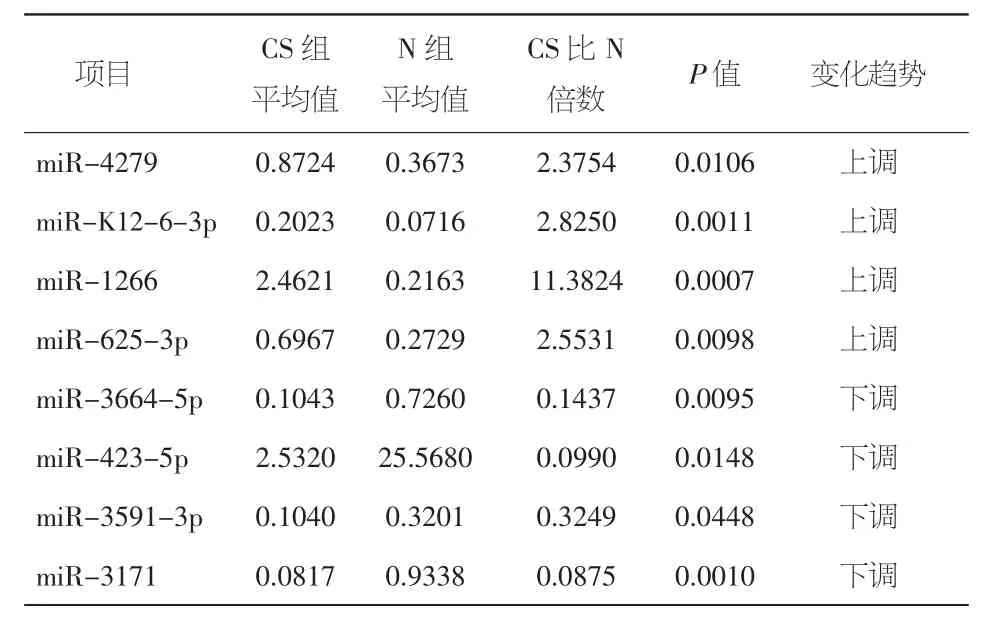
表2 房颤患者冠状窦血与正常外周血比较miRNAs表达差异
房颤患者组外周血(AFPB)与正常对照组外周血(N组)比较,86种miRNAs表达增高,202种降低,其中16种明显上调,24种明显下降。其中miR-892a、miR-3149分别增加约 2.32倍和 2.35倍;而miR-3171表达下降比值约为0.21(相当于下调4.75倍)。见表3。
2.2 房颤患者组自身miRNAs表达差异 房颤患者组(包括所有阵发性、持续性和永久性房颤患者)冠状窦血与自身外周血比较,共有142种miRNAs表达差异,6种miRNAs显著上调,其中miR-1266分别在阵发性房颤、持续性房颤和永久性房颤组上调5.55倍、8.41倍和4.70倍;miR-4279在三组则分别上调5.55倍、8.41倍和4.41倍;而miR-4666a-3p分别上调6.41倍、4.50倍和2.11倍。见表4。
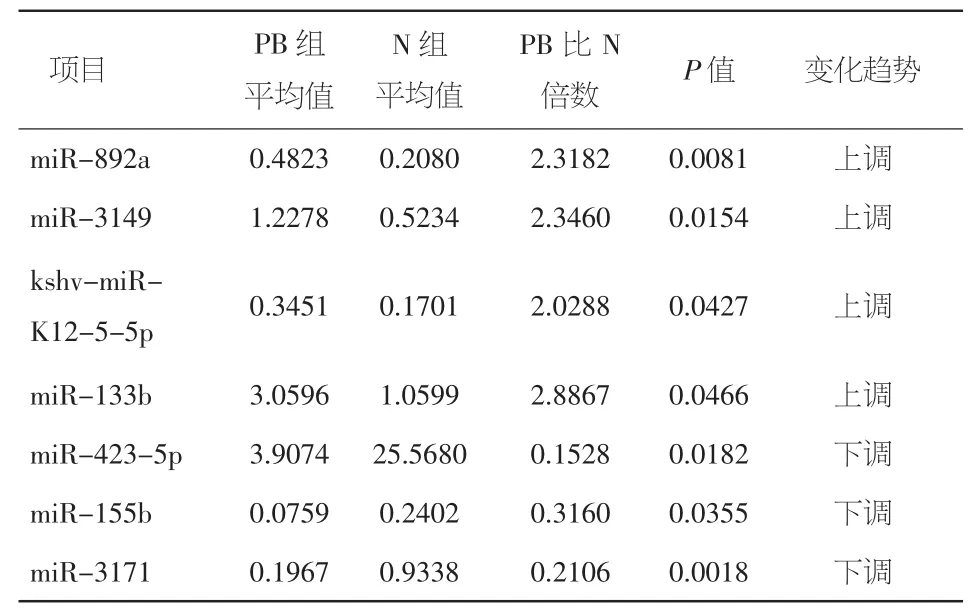
表3 房颤患者外周血与正常外周血比较miRNAs表达差异
8种显著下调,其中miR-3171分别在阵发性房颤、持续性房颤和永久性房颤组比值为0.52(1.92倍)、0.47(2.12倍)和 0.25(3.97倍);miR-3149则是 0.24(4.21倍)、0.28(3.59倍)和 0.15(5.11倍),miR-892a 的改变分别是 0.29、0.13、0.20,约为下调3.40倍、4.38倍和5.11倍。见表4。
2.3 Real-time PCR结果 本试验中使用Realtime PCR检测验证5种候选miRNAs(miR-1266、miR-4279、miR-892a、miR-3149、miR-3171) 在全部房颤患者组冠状窦血及自身外周血的表达差异,miR-1266与miR-4279在两组中的表达差异均呈明显上调,而 miR-892a、miR-3149、miR-3171 表达则明显下调。五种miRNAs的表达趋势与芯片结果保持一致。见图1。
2.4 miRNAs靶基因预测结果 为揭示miRNAs参与调控房颤病理生理过程的机制,本研究进一步对上述差异表达的miRNAs进行靶基因预测,对不同功能的靶基因归类,筛选出可能与房颤相关的靶基因,其功能涉及房颤发病机制的多个方面。本研究主要通过 3 个数据库(mirbase、miranda、targetscan)进行预测,筛选所得靶基因至少存于2个数据库中。
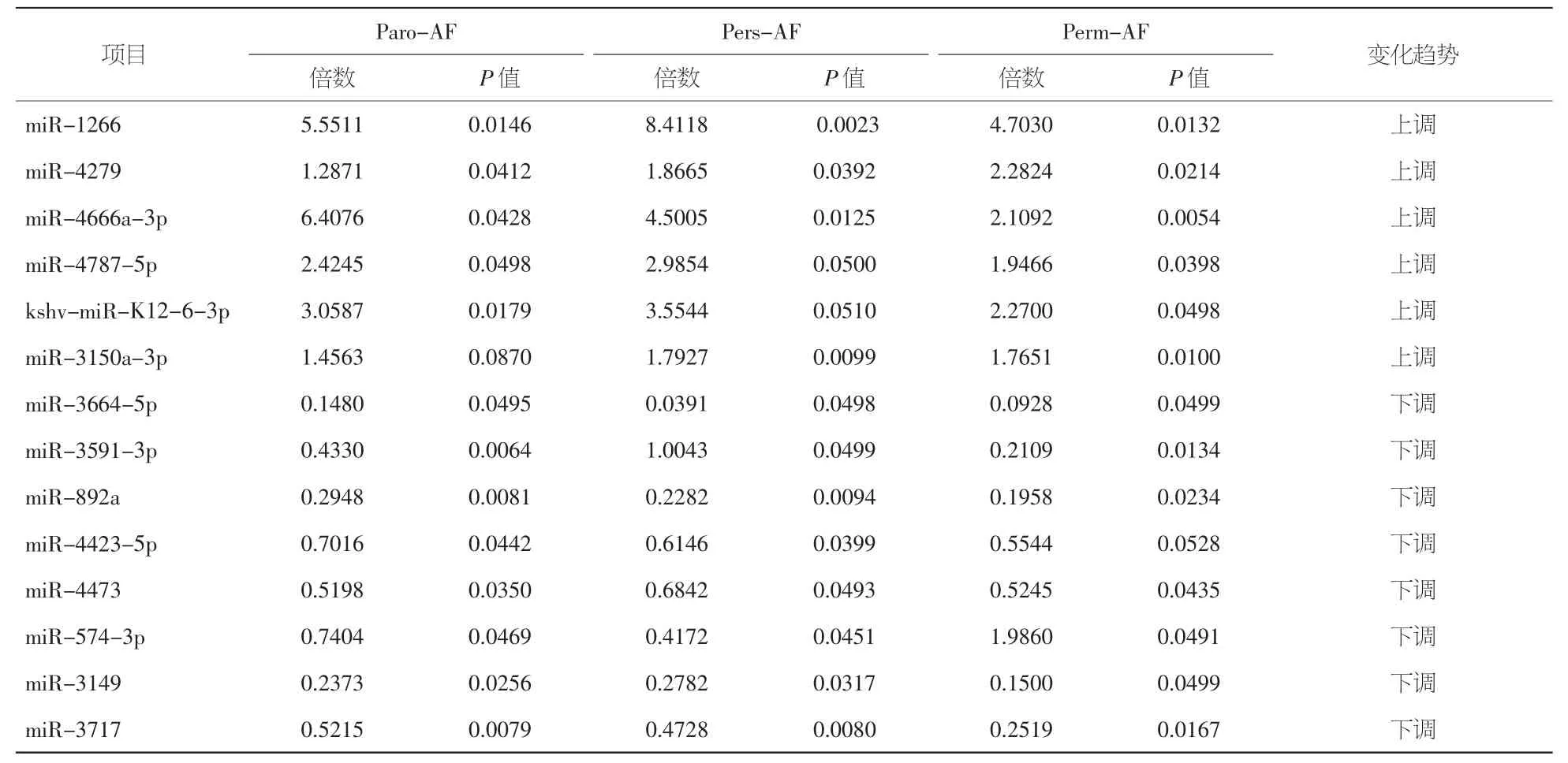
表4 不同类型房颤患者冠状窦血与自身外周血比较miRNAs表达差异
3 讨论
房颤的发生涉及多种离子通道功能的改变[10]。而miRNA参与调控多种心脏电活动相关蛋白的表达[11],miRNA失衡引起离子通道功能失调可能是房颤发生的基础,也可能成为心律失常的潜在标志物[12,13]。MiRNAs作为生物学标志物已应用于心肌梗死、心衰的诊断、治疗中[14,15],房颤患者外周循环血及心房组织中miRNA的表达水平已有报道[9,16],但结果不完全一致,不能明确揭示房颤的miRNA调控机制,差异表达的miRNA也不能完全作为早期预警诊断的标记物。
结合以上问题,我们从临床实际出发,提出了“不同病因所致房颤中参与调控的miRNA可能不同;房颤不同发展阶段有不同的miRNA参与调控。寻找从阵发性到永久性房颤均参与的关键miRNA可能对未来房颤的预警、诊断和干预具有重要意义”。同时提出“冠状窦血miRNA可能更能反映房颤发作时心肌miRNA的调控状况和代谢水平”的设想。所以,本研究在房颤射频消融术中从冠状窦取血,分别与自身外周血和正常外周血对照比较,力求发现参与从阵发性、持续性到永久性房颤发生发展和维持的关键miRNA,为房颤的早期预警诊断治疗奠定基础。
3.1 冠状窦血与外周血比较的意义 本研究发现,房颤组冠状窦血与外周血比较,共有142种miRNAs表达差异,14个miRNAs表达显著差异,其中6个表达上调:即miR-1266、miR-4279、miR-4787-5p、miR-4666a-3p、kshv-miR-K12-6-3p、miR-3150a-5p;8个表达下调:即miR-892a、miR-3149、miR-3171、miR-3664-5p、miR-3591-3p、miR-4423-5p、miR-4473、miR-574-3p。房颤组与对照组外周血及房颤组冠状窦血与对照组外周血比较,miRNAs表达也有明显差异。本结果与张瑜等[8]对房颤患者外周血进行芯片检测有所不同,他们发现持续和阵发性房颤患者血清中miR-3169、miR-3612、miR-634、miR-376a、miR-377* 上调 2 倍以上,下调的有kshv-miR-K12-5、miR-378c及miR-204。Liu等[9]用测序技术检测房颤患者外周血发现,miR-146-5p、miR-155-5p、miR-199a 表达上调。上述研究与本结果不一致的原因可能有:①样本来源不同,患者冠状窦血与外周血表达miRNA有较明显差异;②入组患者病情轻重、病程长短、基础疾病等差别的影响;③所采用的芯片版本、检测手段不一致;④高通量检测手段灵敏度过高可能造成结果偏差。另外,本研究结果中发现的关键miRNA多为新发现的miRNA,可能与本试验采用冠状窦血及采用最新芯片分析有关。
3.2 新发现miRNAs的可能价值 本结果发现,所有房颤组患者中自身冠状窦血与外周血比较,miR-1266、miR-4279、miR-4666a-3p 均明显上调。靶基因预测结果显示,三者分别调控数十种离子通道相关基因。MiR-1266靶基因NALCN称为“Na漏”电流通道基因,可调节细胞起搏活性[17];靶基因CACNA1E缺失可致大鼠心律失常发生[18];miR-4279可能同时调控Ca2+通道基因CACNA1C,以及Ca2+激活K+通道蛋白基因3(KCNN3)。循证医学研究发现,KCNN3基因能明显增加房颤的风险。Lu等[7]动物实验已证实靶基因CACNA1C参与房颤调控。MiR-1266、miR-4279均可能调控 K+通道基因 KCNE1、KCNH2、KCNJ5。大规模基因筛查发现,这些K+通道基因多态性与房颤的发生密切相关[19-23]。MiR-4666a-3p同样可调控 CACNA1C基因及K+通道蛋白的KCNG3基因,其与神经递质释放、神经兴奋性、心率、平滑肌收缩等调节有关。
上述分析进一步说明,miR-1266、miR-4279、miR-4666a-3p在房颤患者冠状窦血与自身外周血中均明显增高,说明其可能是来自心肌组织的特异性miRNA,上述代谢特征支持其作为房颤调控关键miRNA的研究,它们不仅可能参与调控房颤的发生发展,更有可能成为未来房颤治疗的潜在靶点。但三者在患者外周血中未表现明显增高,可能与样本量不足有关,其能否作为房颤早期标志物有待进一步研究。
与健康人外周血比较,miR-3171在房颤患者冠状窦血和自身外周血中的表达均降低,提示其可能主要由心脏以外组织分泌,经过冠脉循环与心肌组织结合参与房颤调控后,使冠状窦血和外周血中水平降低。其中miR-3171在阵发性、持续性和永久性房颤组患者外周血均明显、持续下降,有可能成为房颤早期诊断的标志物。
各组房颤患者外周血miR-892a、miR-3149的表达均高于冠状窦血及正常对照组外周血,而冠状窦血与正常外周血之间未见明显差异,这些代谢特征说明其可能来源于心肌外组织,经冠脉循环后结合于心肌组织,所以冠状窦血中水平降低。这可能是其成为调控房颤关键miRNA的有力证据。此外,二者虽在冠状窦血中表达降低,但在外周血中明显增高,极可能成为房颤诊断的标志物,也可能与患者衰老、高血压、高脂血症等全身疾病或交感兴奋和炎症反应状态有关。
3.3 展望与不足 本研究发现的miRNA多数为新近发现,对其功能的研究仍处于探索阶段。未来与房颤相关的关键miRNA的探讨,可能不仅仅局限与离子通道调控相关的miRNA,要做到早期预警诊断、预防和治疗,可能要涉及细胞增殖、衰老、凋亡、炎症、纤维化等多种生物学过程的调控。已有报道称,miR-1266在炎症反应中发挥调控作用[24],miR-892a则介导细胞色素P450转录后抑制[25],但与房颤发生的关系还需进一步研究。
由于冠状窦血较难收集,芯片检测miRNAs表达谱较为昂贵,本试验测定的病例数较少,结果有待于进一步验证。此外,所发现的miRNAs功能研究正在进行中。
房颤患者小分子RNA组学研究结果与分析 P995
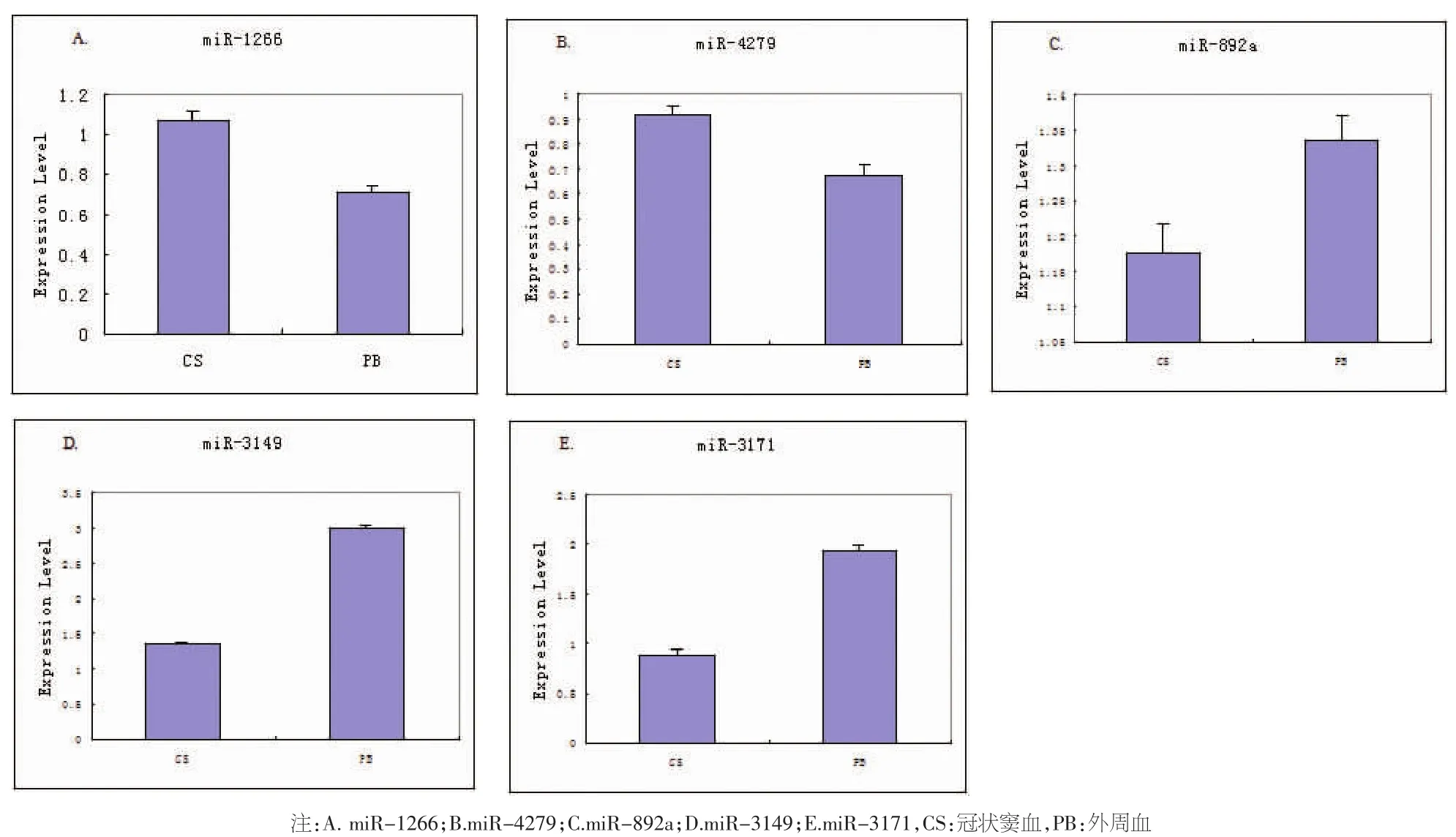
图1 房颤患者冠状窦血与外周血中miRNAs表达real-time PCR结果
[1]Saxena A,Dinh DT,Smith JA,et al.Usefulness of postoperative atrial fibrillation as an independent predictor for worse early and late outcomesafterisolated coronary artery bypassgrafting(multicenter Australian study of 19497 patients).Am J Cardiol,2012,109:219-225.
[2]Bode K,Sommer P,Bollmann A,et al.Therapeutic management of non-valvular atrial fibrillation:Update 2013.Herz,2013-Sep-26.
[3]Grace AA,Narayan SM.Common threads in atrial fibrillation and heart failure.Heart Fail Clin,2013,9:373-383.
[4]Wang Z,Lu Y,Yang B.MicroRNAs and atrial fibrillation:new fundamentals.Cardiovasc Res,2011,89:710-721.
[5] De Planell-Saguer M,Rodicio MC.Detection methods for microRNAs in clinic practice.Clin Biochem,2013,46:869-878.
[6]Hagiwara S,Kantharidis P,Cooper ME,et al.MicroRNAs as biomarkersand regulatorofcardiovasculardevelopmentand disease.Curr Pharm Des,2014,20:2347-2370.
[7]Lu Y,Zhang Y,Wang N,et al.Micro-328 contributes to adverse electrical remodeling in atrial fibrillation.Circulation,2010,122:2378-2387.
[8]张瑜,赵月香,郭红阳,等.心房颤动患者循环microRNAs表达谱的初步研究.解放军医学杂志,2012,37:195-199.
[9]Liu Z,Zhou C,Liu Y,et al.The expression level of plasma microRNAs in atrial fibrillation patients.PLoS One,2012,7:e44906.
[10]Gao M,Wang J,Wang Z,et al.An altered expression of genes involved in the regulation of ion channels in atrial myocytes is correlated with the risk of atrial fibrillation in patients with heart failure.Exp Ther Med,2013,5:1239-1243.
[11] Luo X, Pan Z, Shan H, et al.MicroRNA-26 governsprofibrillatory inward-rectifier potassium current changes in atrial fibrillation.J Clin Invest,2013,123:1939-1951.
[12]Orenes-Pinero E,Montoro-Garcia S,Patel JV,et al.Role of microRNAs in cardiac remodeling:New insights and future perspectives.Int J Cardiol,2013,167:1651-1659.
[13]Luo X,Zhang H,Xiao J,et al.Regulation of human cardiac ion cardiacion channelgenesby microRNAs:theoretical perspective and pathophysiological implications.Cell Physiol Biochem,2010,25:571-586.
[14] Deddens JC,Colojn JM,Oerlemans MI,et al.Circulating microRNAs as novel biomarkers for the early diagnosis of acute coronary syndrome.J Cardiovasc Transl Res,2013,6:884-898.
[15] Vogel B,Keller A,Frese KS,et al.Multivariate miRNA signatures as biomarkers for non-ischaemic systolic heart failure.Eur Heart J,2013,34:2812-2823.
[16]Nishi H,Sakaguchi T,Miyagawa S,et al.Impact of microRNA expression in human atrialtissue in patients with atrial fibrillation undergoing cardiac surgery.PLoS One,2013,8:e73397.
[17]Lu TZ,Feng ZP.NALCN:a regulator of pacemaker activity.Mol Neurobiol,2012,45:415-423.
[18]Lu ZJ,Pereverzev A,Liu HL,et al.Arryhthmia in isolated prenatal hearts after ablation of the Cav2.3 α1E subunit of the voltage-gated Ca channels.Cell Physiol Biochem,2003,14:11-12.
[19]Olesen MS,Bentzen BH,Nielsen JB,et al.Mutations in the potassium channel subunit KCNE1 are associated with earlyonset familial atrial fibrillation.BMC Med Genet,2012,13:24.
[20] Chan PJ,Osteen JD,Xiong D,et al.Characterization of KCNQ1 atrial fibrillation mutations reveals distinct dependence on KCNE1.J Gen Physiol,2012,139:135-144.
[21]Wang QS,Wang XF,Chen XD,et al.Genetic polymorphism of KCNH2 confers predisposition of acquired atrial fibrillation in Chinese.J Cardiovasc Electrophysiol,2009,20:1158-1162.
[22]Zhang C,Yuan GH,Cheng ZF,et al.The single nucleotide polymorphisma of kir3.4 gene and their correlation with lone paroxysmal atrial fibrillation in Chnese Han population.Heart Lung Circ,2009,18:257-261.
[23] Jabbari J,Olesen MS,Holst AG,et al.Common polymorphisms in KCNJ5 are associated with early-onset lone atrial fibrillation in Caucasians.Cardiology,2011,118:116-120.
[24]Ichihara A,Jinnin M,Oyama R,et al.Increased serum levels ofmiR-1266 in patientswith psoriasisvulgaris.EurJ Dermatol,2012,22:68-71.
[25]Choi YM,An S,Lee EM,et al.CYP1A1 is a target of miR-892a-mediated post-transcriptional repression.Int J Oncol,2012,41:331-336.
长城会先心病介入论坛学术亮点
本届长城会结构性心脏病论坛历时2天,共设先心病现状与进展、先心病外科手术治疗、先心病心律失常与介入治疗并发症的管理、先心病相关介入治疗、少见结构性心脏病的介入治疗、先心病与卒中、瓣膜病的介入治疗、结构性心脏病介入治疗病例讨论8个专题,包括35个专题讲座和10个病例报告。共邀请了45名国内外著名结构性心脏病方面的专家,其中包括7名外籍专家。
本届长城会结构性心脏病论坛继续秉承“引进、创新、合作、发展”的会议宗旨和“学术、开放、引领、传播”的会议方针,在往届长城会结构性心脏病论坛的基础上,本次会议更加侧重于目前结构性心脏病领域的热点、焦点和难点问题,如左心耳封堵术、经皮主动脉瓣置换术、卵圆孔未闭与卒中相关问题等。会议内容丰富、涉及了内科、外科、镶嵌治疗、儿科、心脏超声、肺动脉高压、脑血管科等多个领域,讲座题目新颖、内涵丰富,特别是对同一问题的美国经验与中国经验对比型专题讲座将成为本届结构性心脏病论坛的新亮点与看点,而病例报告则会为与会者增添更多的临床经验。
(朱鲜阳)
The study of miRNA in patients with atrial fibrillation
YUE Yu-nan,YANG Shui-xiang.The Department of Cardiology of Beijing Shijitan Hospital CMU,Beijing 100038,China
YANG Shui-xiang,E-mail:sxyang68@163.com
Objective To investigate the expression profiles of miRNAs in coronary sinus circulating,regulation mechanism and the value of earlier diagnosis of miRNAs in patients with atrial fibrillation(AF)of nonvalvular heart disease.Methods The total 15 patients were divided into 4 groups:paroxysmal,persistent and permanent atrial fibrillation patient’s groups,each group contained 5 patients,while the control group 5 normal volunteers.The peripheral blood(PB)and coronary sinus blood(CSB)were taken from patients before and during the operation of AF radiofrequency ablation,the total RNA was extracted and hybridized with the microRNA chips(microRNA v 18.0),the microarray analysis of expression profile,differential expression of miRNA and clustering analysis in whole genome were made with Volcano Plot and tMEV software respectively.The target gene analysis of miRNAs was research through the database of Mirbase,Miranda and Targetscan.Results There were 14 miRNAs different expression in CSB group compared with in PB group significantly,6 was upregulation:miR-1266,miR-4279,miR-4787-5p,miR-4666a-3p,kshv-miR-K12-6-3p and miR-3150a-5p,and 8 downregulation:miR-892a,miR-3149,miR-3171,miR-3664-5p,miR-3591-3p,miR-4423-5p,miR-4473 and miR-574-3p.Among them,the expression of miR-1266 was increased,but the miR-3171 decreased dramatically whatever in paroxysmal,persistent and permanent atrial fibrillation groups.Also,the different expression of miRNAs in CSB group of AF patients compared with in PB group of normal control persons was shown significantly.Conclusion Compared with PB,the expression of miRNAs in CSB in AF patients themselves group was equal different markedly,which may indicate the miRNAs in CSB can better reflect the real metabolism and regulation status of myocardium in AF condition.The miR-3171,miR-892a and miR-3149 in plasma may be used as biomarker in earlier diagnosis of AF because their expression was increased or decreased respectively from early to end stage of AF continuously;miR-1266,miR-4279,miR-4666a-3p may be served as potential intervening targets of AF in the future.
Atrial fibrillation; miRNA; Gene regulation; Earlier diagnosis
100038 北京市,首都医科大学附属北京世纪坛医院心内科
杨水祥,E-mail:sxyang68@163.com
10.3969/j.issn.1672-5301.2014.11.010
R541.7
A
1672-5301(2014)11-0995-06
2014-08-13)
