PPARs激动剂对RAW264.7巨噬细胞源性泡沫细胞内胆固醇含量的影响
2014-08-30赵婷婷王庸晋曹文君王治平燕李晨
赵婷婷 王庸晋 曹文君 王治平 燕李晨
PPARs激动剂对RAW264.7巨噬细胞源性泡沫细胞内胆固醇含量的影响
赵婷婷 王庸晋 曹文君 王治平 燕李晨
目的 探讨PPARs激动剂吡格列酮对RAW264.7巨噬细胞源性泡沫细胞内胆固醇含量的影响。方法 首先用50 mg/L氧化型低密度脂蛋白(ox-LDL)将体外培养的RAW264.7巨噬细胞诱导分化为泡沫细胞,然后进行油红O染色,并在光镜下鉴定泡沫细胞形态及变化;再以不同浓度吡格列酮(0μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L)作用泡沫细胞 24 h,以 30 μmol/L的吡格列酮作用 0 h、6 h、12 h、24 h、48 h;最后酶法检测泡沫细胞内胆固醇的含量。结果 ①50 mg/Lox-LDL诱导巨噬细胞48 h后分化为泡沫细胞。②与对照组相比,不同浓度吡格列酮作用后泡沫细胞内胆固醇含量均减少,差异有统计学意义(P<0.01),且呈剂量依赖性。③与对照组相比,30μmol/L的吡格列酮作用6 h、12 h、24 h、48 h后,泡沫细胞内胆固醇含量均减少,差异有统计学意义(P<0.01),且呈时间依赖性。结论 PPARs激动剂吡格列酮能够减少泡沫细胞内胆固醇含量,且呈剂量和时间依赖性。
巨噬细胞; 吡格列酮; 胆固醇; 动脉粥样硬化
泡沫细胞由巨噬细胞吞噬大量氧化修饰的低密度脂蛋白,致细胞内脂质堆积而形成,是动脉粥样硬化斑块内出现的特征性病理细胞。血脂水平增高会导致血管内皮细胞功能受损,促进氧化应激和炎症反应,诱导泡沫细胞形成,加速动脉粥样硬化的进程[1]。因此,减少细胞内脂质的形成和堆积已成为防治动脉粥样硬化的一种有效治疗策略。吡格列酮属于噻唑烷二酮类药物,是已知的PPARγ激动剂。有动物实验表明,吡格列酮可改善高脂血症大鼠血脂水平,延缓主动脉粥样硬化病理改变[2]。本研究通过测定过氧化物酶体增殖物激活受体(PPARs)激动剂吡格列酮对RAW264.7巨噬细胞源性泡沫细胞内胆固醇含量的影响,进一步探讨其可能的作用机制,为动脉粥样硬化的防治提供科学的实验依据。
1 材料与方法
1.1 材料 RAW264.7巨噬细胞由中国科学院上海细胞库提供,DEME培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶均购自 Hyclone公司,低密度脂蛋白(LDL)购自上海生物工程有限公司,吡格列酮购自石药集团远大(大连)制药有限公司,胆固醇测定试剂盒购自中生北控生物科技股份有限公司,其他试剂均为进口或国产分析纯。
1.2 低密度脂蛋白(LDL)的氧化修饰 用pH 7.2 0.01 mol/LPBS将LDL浓度调整为1.6 g/L,加入CuSO4使LDL溶液终浓度为10 μmol/L,37℃氧化12 h,将溶液装入透析袋,4℃条件下透析24 h以终止氧化。期间换液10次,前4次在透析液中加入终浓度为0.5 mmol/L的EDTA以终止氧化,用0.45 μm滤膜过滤除菌,4℃避光保存备用。
1.3 细胞培养 用含10%FBS的DMEM培养基在37℃、5%CO2培养箱中培养RAW264.7巨噬细胞。待细胞生长至对数期时,接种至6孔培养板,密度为4×105/孔,加入50 mg/ml的ox-LDL孵育48 h,诱导分化成泡沫细胞。
1.4 油红O染色 将细胞培养于放有消毒盖玻片的6孔培养板内,细胞终止培养后,弃去原培养液,用PBS洗3次,60%异丙醇固定30 min,吸去固定液后PBS洗3次,油红O染色液室温染色30 min,弃去染色液PBS洗3次,在倒置显微镜下观察细胞的形态变化。
1.5 实验分组和干预实验 ①量效试验:对照组不做处理,实验组用 5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L的吡格列酮孵育RAW264.7巨噬细胞源性泡沫细胞24 h。②时效实验:对照组不做处理,实验组用30 μmol/L的吡格列酮孵育RAW264.7巨噬细胞源性泡沫细胞 6 h、12 h、24 h、48 h。
1.6 泡沫细胞内胆固醇含量的检测 0.1 mmol/L氯化钠室温作用30 min裂解细胞,BCA法测定蛋白质的含量。冲入无水乙醇1 ml,分为等体积的2份,其中一份加入10 mol/L氢氧化钠溶液500 μl,50℃水浴1 h,使酯化胆固醇转化为游离胆固醇,用于总胆固醇的测定;另一份加入1 mol/L氢氧化钠溶液500 μl,室温放置2 h,为游离胆固醇的测定。胆固醇酯=总胆固醇-游离胆固醇。按试剂盒说明用酶比色法测定胆固醇的含量,在酶标仪上测定样品和标准品在500 nm处的吸光度值(OD),以mg/g计算其含量。
1.7 统计学方法 采用SPSS 18.0统计学软件对实验数据进行统计学分析。计量资料采用±s表示,组间比较采用单因素方差分析(F检验),多重比较采用LDL检验。P<0.05为差异具有统计学意义。
2 结果
2.1 RAW264.7巨噬细胞源性泡沫细胞模型的建立 RAW264.7巨噬细胞复苏后,在显微镜下观察细胞生长情况:RAW264.7巨噬细胞贴壁生长,以类圆形和不规则多边形为主,一般含1~2个核,有伪足,细胞胞体较小,生长快,5~6 d可融合(图1)。巨噬细胞吞噬50 mg/ml ox-LDL 48 h后可见细胞体积明显增大,胞内有大小不等的脂滴(见图2)。油红O染色后,巨噬细胞大量红染物质(见图3)。
2.2 不同浓度吡格列酮对RAW264.7巨噬细胞源性泡沫细胞内胆固醇含量的影响 用 50 mg/ml ox-LDL培养 RAW264.7巨噬细胞48 h,使其诱导分化为泡沫细胞,再加不同浓度吡格列酮作用24 h,酶法检测泡沫细胞内胆固醇的含量。结果显示,随着吡格列酮浓度增加,细胞内总胆固醇(TC)、胆固醇酯(CE)的含量及TC/CE显著下降,与对照组比较差异有统计学意义(P<0.01),并呈明显剂量依赖性。见表1。
2.3 30 μmol/L吡格列酮作用RAW264.7巨噬细胞源性泡沫细胞不同时间后对细胞内胆固醇含量的影响 与对照组相比,30 μmol/L吡格列酮作用于泡沫细胞 6 h、12 h、24 h、48 h 后,细胞内 TC、CE及TC/CE明显下降,差异有统计学意义(P<0.01),并呈明显的时间依赖性。见表2。
表1 不同浓度吡格列酮作用RAW264.7巨噬细胞源性泡沫细胞24 h后对细胞内胆固醇含量的影响(±s)

表1 不同浓度吡格列酮作用RAW264.7巨噬细胞源性泡沫细胞24 h后对细胞内胆固醇含量的影响(±s)
注:与对照组比较,aP<0.01;与 5 μmol/L 比较,bP<0.01;与 10 μmol/L 比较,cP<0.01;与 20 μmol/L 比较,dP<0.01
组别 例数 TC CE CE/TC对照组 5 86.55±2.96 47.61±2.88 0.55±0.11 5 μmol/L 5 67.25±1.81 36.90±1.63 0.54±0.02 10 μmol/L 5 54.29±4.13ab 25.65±1.84ab 0.47±0.05ab20 μmol/L 5 41.24±2.43abc 16.13±2.24abc 0.39±0.04abc30 μmol/L 5 31.24±3.81abcd 10.79±3.61abcd 0.34±0.06abcd
表2 30 μmol/L吡格列酮作用RAW264.7巨噬细胞源性泡沫细胞不同时间后对细胞内胆固醇含量的影响(±s)
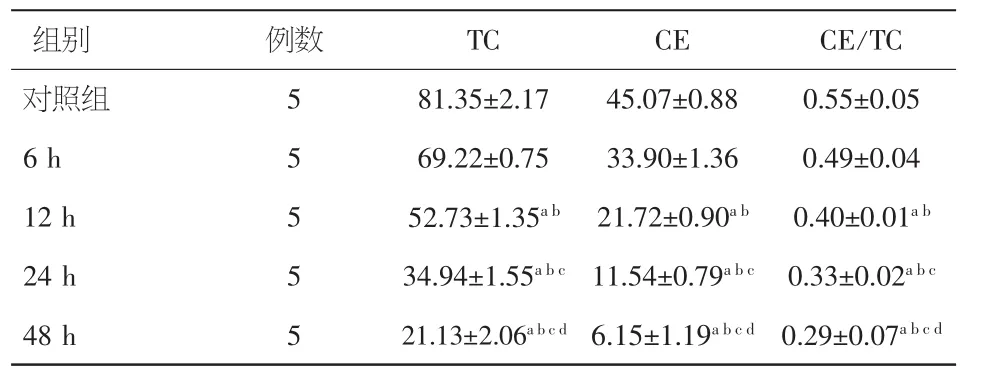
表2 30 μmol/L吡格列酮作用RAW264.7巨噬细胞源性泡沫细胞不同时间后对细胞内胆固醇含量的影响(±s)
注:与对照组比较,aP<0.01;与 6 h 比较,bP<0.01;与 12 h 比较,cP<0.01;与24 h比较,dP<0.01
组别 例数 TC CE CE/TC对照组 5 81.35±2.17 45.07±0.88 0.55±0.05 6 h 5 69.22±0.75 33.90±1.36 0.49±0.04 12 h 5 52.73±1.35ab 21.72±0.90ab 0.40±0.01ab24 h 5 34.94±1.55abc 11.54±0.79abc 0.33±0.02abc48 h 5 21.13±2.06abcd 6.15±1.19abcd 0.29±0.07abcd
3 讨论
随着社会经济的发展、人民生活水平的提高及生活方式的改变,我国居民的平均血清TC水平在逐步升高。与此同时,与血脂异常密切相关的糖尿病和代谢综合征在我国也十分常见。致动脉粥样硬化脂蛋白谱由一组血脂异常组成,包括TG升高、HDL-C低和小而致密LDL升高[3]。在动脉内膜受损的情况下,血液中的单核细胞黏附在内皮细胞上的数量增多,并通过内皮间隙在内膜下转化为巨噬细胞,通过A型清道夫受体(SR-A)吞噬大量ox-LDL,导致细胞内脂质堆积,最终形成泡沫细胞[4]。因此,减少胆固醇的流入或促进其流出对防治AS的发生具有十分重要的意义。这一过程受到细胞膜上不同脂质蛋白转运体的介导,如三磷酸腺苷结合盒转运子(ABCAl与ABCGl)和清道夫受体(SRBI)等。这些脂质蛋白转运体构成了细胞脂质释放的特异性途径,即ABCAl径路、ABCGl径路、SR-BI径路及非特异性的液相扩散径路[5]。高密度脂蛋白(HDL)和载脂蛋白A-I(apoA-I)是血浆内胆固醇天然受体,对于胆固醇流出也十分重要[6]。
吡格列酮作为更新一代的人工合成PPARγ激动剂,有更高的配体亲和力。吡格列酮的主要作用有调节血糖、增加胰岛素敏感性,同时还有较好的心血管保护作用[7]。Nakaya等[8]发现,吡格列酮可以阻止高脂饮食的基因敲除LDLR的小鼠早期动脉粥样硬化的发展。Clark等[9]通过评价吡格列酮对肥胖猫胰岛素抵抗的影响,发现吡格列酮不仅可以显著改善肥胖猫胰岛素抵抗,同时还可以改善肥胖猫的脂质代谢。虽然目前对吡格列酮抗动脉粥样硬化的作用机制不甚清楚,有学者通过研究认为吡格列酮和22羟胆固醇协同作用减少脂质沉积,可能通过激活 PPARγ-LXRα-ABCA1通路,上调ABCA1基因的表达,增加胆囊上皮细胞胆固醇的流出[10]。此外,Vaccinate发现吡格列酮可在HepG2细胞中诱导ApoAI的转录,改善高密度脂蛋白的功能,阻止动脉粥样硬化的进一步发展[11]。
本实验以RAW264.7小鼠巨噬细胞为研究对象,加入50 mg/ml ox-LDL诱导分化建立泡沫细胞细胞模型,经油红O染色,在光镜下可见胞浆内有明显的红染脂质颗粒,在形态学上符合泡沫细胞,表明采用上述方法成功建立了RAW264.7小鼠巨噬细胞源性泡沫细胞模型。实验结果表明,随着吡格列酮浓度增加及作用时间延长,巨噬细胞内TC、CE含量逐渐减少,与对照组比较,差异有统计学意义。提示吡格列酮可明显减少巨噬细胞源性泡沫细胞胆固醇酯聚积,促进巨噬细胞胆固醇流出。吡格列酮是通过上述何种途径参与调节泡沫细胞内胆固醇含量的变化,仍有待进一步研究证实。
PPARs激动剂对RAW264.7巨噬细胞源性泡沫细胞内胆固醇含量的影响 P1040

图1 RAW264.7巨噬细胞10×20 倍

图2 ox-LDL诱导后泡沫细胞10×20 倍

图3 泡沫细胞油红O染色10×40 倍
[1]Rodriguez C,Slevin M,Rodriguez-Calvo R,et al.Modula-tion of endothelium and endothelial progenitor cell function by lowdensity lipoproteins:implication for vascular repair,angiogenesis and vasculogenesis.Pathobiology,2009,76:11-22.
[2]蔡辉,董晓蕾,李蓉,等.吡格列酮对实验性动脉粥样硬化大鼠血脂水平的影响及临床意义.实用老年医学,2012,26:238-241.
[3] Chapman MJ,Ginsberg HN,Amarenco P,et al.European Atherosclerosis Society Consensus Panel:Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease:evidence and guidance for management.Eur Heart,2011,32:1345-1361.
[4]Hansson KG.Inflammation,atherosclerosis,and coronary artery disease.N Engl J Med,2005,352:1685-1695.
[5]Betteridge DJ,De Fronzo RA,Chilton RJ.PROactive:time forcritical appraisal.Eur Heart J,2008,29:969-983.
[6]徐留建,杨小东,张剑梅,等.细胞胆固醇流出通路研究进展.中国心血管病研究,2012,10:309-312.
[7]仝其广,张坡,胡大一.高密度脂蛋白功能与动脉粥样硬化.中国心血管病研究,2011,9:524-526.
[8]Nakaya H,Summers BD,Nicholson AC,et al.Athemscle-rosis in LDLR-knockout mice is inhibited but not mversed,by thePPARgamma ligand pioglitazone.Am J Pathol,2009,174:2007-2014.
[9]Clark M,Thomaseth K,Dirikolu L,et al.Effects of pioglitazone on insulin sensitivity and serum lipids in obese cats.J Vet Intern Med,2014,28:166-174.
[10]Wang JM,Wang D,Tan YY,et al.22(R)-hydroxycholesterol and pioglitazone synergistically decrease cholesterol ester via the PPARγ -LXRα -ABCA1 pathway in cholesterosis ofthe gallbladder.Biochem Biophys Res Commun,2014,447:152-157.
[11] Zhang LH, Kamanna VS, Ganji SH, et al.Pioglitazone increases apolipoprotein A-I production by directly enhancing PPRE-dependent transcription in HepG2 cells.J Lipid Res,2010,51:2211-2222.
全剂量ARB/HCTZ(氯沙坦钾/100 mg/氢氯噻嗪12.5 mg)正式全国上市
“我国是一个高血压大国,流行病学调查提示,目前我国高血压防控现状呈现‘三高三低’,即患病率高、死亡率高、致残率高和知晓率低、治疗率低、控制率低。因此,加强我国高血压临床诊疗规范性,普及患者教育,提高其对治疗的依从性是高血压防控工作中的重要内容,而优化的高血压治疗方案可增加疗效从而改善患者依从性。血管紧张素Ⅱ受体拮抗剂(ARB)与利尿剂是两种不同降压机制药物,其联合治疗是国内外指南推荐的优选组合之一。”这是中国老年学学会心脑血管病专业委员会主任委员胡大一教授对我国高血压现状所做的介绍。
2014年10月17日,在第25届长城国际心脏病学会议上,正式发布了氯沙坦钾/氢氯噻嗪片(100 mg/12.5 mg)上市信息。与会的专家均一致表示,全剂量的ARB/HCTZ如氯沙坦钾/100 mg/氢氯噻嗪12.5 mg将在帮助高血压患者的血压尽快达标,并提供更有效的靶器官保护方面,将是临床更好的选择。
中国医师协会心血管分会会长马长生教授表示:“全剂量的ARB/HCTZ如氯沙坦钾/100mg/氢氯噻嗪12.5 mg将在帮助高血压患者的血压尽快达标,并提供更有效的靶器官保护方面,将是临床更好的选择。细究ARB相关的循证研究可发现,获得阴性或中性结果的研究ARB剂量多不足,而采用大剂量ARB的LIFE研究(氯沙坦平均剂量为82 mg/d)和RENAAL研究(氯沙坦平均剂量为86 mg/d)均获得了阳性结果,提示表观分布容积较低、药物无法到达靶器官或是相关研究未获得阳性结果的原因。故对表观分布容积较低的大多数ARB而言,如果要想达到较好的靶器官保护疗效,必须要提高剂量。”
浙江大学医学院附属第一医院朱建华教授指出:“由于高血压的发病机制尚未明晰,故目前的治疗需要多途径阻断其发病机制,这是联合治疗的理论基础。此外,既往临床研究显示,提高单药治疗的剂量并不能使疗效相应增长,而不良反应发生率则会上升,提示仅增加单药治疗剂量并不是降压的好方法。采用不同机制的降压药物联合治疗可以达到增加疗效、降低不良反应发生率的作用,此种‘黄金搭档’不一定需要采用两种非常强效的药物,作用机制互补的药物往往疗效佳、不良反应少,让患者可以坚持服药,最终提高血压达标率。”
北京大学人民医院孙宁玲教授回顾了在去年更新的高血压指南(JNC8,2013ESH/ESC)的明确建议,强调应更及时、更普遍进行联合降压治疗。与以往指南相比,新指南还特别强调联合降压治疗也应使用足剂量,使用临床试验验证过的足剂量,以提高降压治疗的达标率。足剂量增加的降压疗效是显而易见的,其治疗效果(efficacy)与效率(efficiency)都显著增加,对ARB与利尿剂组成的复方制剂而言,还可以显著减少不良反应,提高降压治疗的耐受性和依从性,从而实现更多降压获益。
“除降压疗效外,在保护靶器官方面,LIFE研究证实ARB氯沙坦(100 mg)与和利尿剂氢氯噻嗪(12.5 mg)联合治疗可降低伴左心室肥厚的高血压患者心血管疾病的发生率和死亡率,且不良反应较少,提示ARB联合小剂量利尿病可使患者疗效改善,并减少不良反应的发生。另有研究显示,增加ARB剂量可增加其器官保护作用,因此,对于ARB联合小剂量利尿剂的治疗方案可根据患者情况增加ARB剂量(如氯沙坦100 mg)或可为患者带来更佳的疗效,同时不增加治疗带来的不良反应。而临床实践也表明,这种联合方式具有更好的依从性和疗效。”中山大学附属第一医院董吁钢教授又作出了如上补充。
The effects of PPARs agonist on cholesterol levels in RAW264.7 macrophage-derived foam cell
ZHAO Ting-ting*,WANG Yong-jin,CAO Wen-jun,et al.*Department of Cardiology,Shanxi Medical University First Subsidary Clinical Hospital,Taiyuan 030001,China
WANG Yong-jin,E-mail:yongjinwang2008@sohu.com
Objective To observe the effects of PPARs agonist Pioglitazone on cholesterol levels in RAW264.7 macrophage-derived foam cell.Methods Firstly,with 50 mg/L oxidized low density lipoprotein(ox-LDL) induce the mouse RAW264.7 cells into foam cells.Secondly,using red oil O staining technique and transmission light microscope was applied to appraise the morphology and change of foam cells.Thirdly,Pioglitazone of different concentrations(0 μmol/L,5 μmol/L,10 μmol/L,20 μmol/L,30 μmol/L) were incubated with RAW264.7 macrophage-derived foam cell for 24 h and 20μmol/L pioglitazone were incubated with RAW264.7 macrophage-derived foam cell for 6 h,12 h,24 h,48 h.Lastly,the cholesterol content of foam cells was measured by enzyme assay.Results ⑴The mouse RAW264.7 cells could be differentiated into macrophages after 48h induction by 50 mg/L oxidized low density lipoprotein(ox-LDL).⑵Compared with the control group,treatment of RAW264.7 macrophage-derived foam cell with 5 μmol/L,10 μmol/L,20 μmol/L,30 μmol/L pioglitazone for 24 h,resulted in an decrease in the cholesterol content of foam cells,differences are statistically significant(P<0.01).⑶Compared with the control group,treatment of RAW264.7 macrophage-derived foam cell with 20 μmol/L pioglitazone for 6 h,12 h,24 h,48 h,resulted in a decrease in the cholesterol content of foam cells,differences were statistically significant(P<0.01).Conclusion PPARs agonist pioglitazone reducescholesterol levels in foam cells in dose and time dependent.
Macrophage; Pioglitazone; Cholesterol; Atherosclerosis
山西省科学技术发展计划项目(项目编号:20130321029-01),山西省“131”领军人才资助项目
030001 山西省太原市,山西医科大学附属第一临床医院心内科(赵婷婷);长治医学院心血管研究所(赵婷婷、王庸晋、曹文君、燕李晨);长治医学院附属和平医院心内科(王庸晋、王治平)
王庸晋,E-mail:yongjinwang2008@sohu.com
10.3969/j.issn.1672-5301.2014.11.023
R541.4
A
1672-5301(2014)11-1040-04
2014-07-11)
