乳腺浸润性导管癌连接蛋白43和上皮性钙黏蛋白相关性研究
2014-08-28,,,
,, ,
(解放军第174医院普通外科,福建 厦门 361003)
连接蛋白43(Connexin43,Cx43)和上皮性钙黏蛋白(E-cadherin,E-cad)的表达情况及功能状态已被证实与多种人类疾病有关。目前,也有学者对两者的表达相关性关系进行研究,发现它们在肺癌、结肠癌、膀胱癌、喉癌等均有一定同向性及一致性。Cx43和E-cad同为表达于相邻细胞膜跨膜蛋白,共同对维持细胞间的稳定结构与调节细胞间的信息传递有着重要意义。为了解它们二者的表达是否具有相关性,作者对89例乳腺浸润性导管癌组织中的Cx43和E-cad的表达情况进行相关性分析,然后对48例分区取材的乳腺癌标本中Cx43和E-cad在同向表达时与淋巴结转移状态进行分析,探讨二者联合检测时是否有助于判断乳腺肿瘤的浸润转移能力。
1 材料与方法
1.1 临床资料
收集2010年9月至2013年10月本院普通外科收治的乳腺浸润性导管癌89例手术切除标本,每例病例在同一方向连续分3区取材,分别为肿瘤区,交界区,远癌区。肿瘤区为手术标本中肿瘤活检部分;交界区为肿瘤活检边缘外1~2 cm处的含有乳腺腺体组织部分;远癌区为肿瘤活检边缘外2~4 cm处的含有乳腺腺体组织部分,分区检测标本共有48例。将所有取材组织标记后制作成蜡块标本。所有病例资料完整,患者年龄36~68岁,中位年龄52岁;TNM Ⅰ期9例(18.7%),Ⅱ期26(54.2%)例,13例(27.1%);病理组织学Ⅰ级2例(4.2%),Ⅱ级9例(18.7%),Ⅲ级37例(77.1%);有淋巴结转移25例(52.0%),无淋巴结转移23例(48.0%)。所有病例术前均未进行放、化疗及内分泌治疗;手术方式为乳腺癌根治切除术或改良根治术;均由术后常规病理证实诊断为浸润性导管癌;关于病理分级及有无淋巴结转移也经由病理确诊;伴有其他部位的原发性肿瘤或转移性肿瘤均未入组。
1.2 试剂
Cx43多克隆抗体(ZA-0444,即用型)购自北京中杉金桥生物技术公司;E-cad单克隆抗体(MAB-0589,即用型)及ElivisionTM Plus二步法试剂盒、DAB显色剂购自福州迈新生物技术开发有限公司。
1.3 免疫组织化学
采用Elivision免疫组化法,石蜡切片,常规脱蜡水化;柠檬酸高温高压修复2 min;3%H2O2消除内源性过氧化物酶活性15~20 min;滴加I抗后置37 ℃水育箱孵育50 min;按说明先后加增强剂和酶标抗鼠/兔聚合物,分别室温孵育20 min、30 min;DAB显色30 s,苏木素复染,脱水,封片。每批染色均设立以PBS代替I抗的阴性对照及阳性对照(阳性对照Cx43为Wistar雄性大鼠心脏,E-cad用已知的阳性切片)。
1.4 结果判定
Cx43的判定参考高一菁的方法[1]:着色细胞小于10%(0分);10%~40%(1分);41%~70%(2分);>70%为3分;着色强度计分:无着色(0分);淡黄色(1分);棕黄色(2分)。两项相乘,总计分0~3分为异常表达(-);4分以上为正常表达(+)。E-cad阳性细胞为黄色-棕黄色着色。按阳性细胞比例: 阳性细胞数<10%(0分) , 10%~40%(1分),41~70%(2分),>70%(3分)。按组织的着色强度:不着色(0分),淡黄色(1分),黄色(2分),棕黄色(3分)。6分以下为减弱表达(-),6分以上为正常表达(+)。结果由2名正高病理医师独立评分,同一病例评分取平均值作为该病例的最终评分。
1.5 统计学处理
统计学分析运用SPSS 19.0软件,Cx43与E-cad的表达关系分析采用配对计数资料的McNemar检验和Kappa检验;以P<0.05为差异有统计学意义。
2 结果
2.1 Cx43与E-cad在浸润性导管癌的表达
在乳腺癌组织中Cx43蛋白表达明显下降,随着病理组织学分级的上升而减弱(图1)。E-cad在乳腺癌组织中,E-cad表达胞膜处,少数出现细胞浆异位表达,随肿瘤病理组织学分级的升高,表达减弱甚至缺失(见图1)。
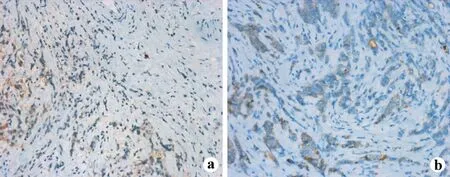
a:Cx43蛋白表达明显减弱,少数细胞出现胞核异位表达;b:E-cad的表达明显减弱
图1浸润性导管癌中III级Cx43及E-cad的表达( EP×100)
2.2 浸润性导管癌Cx43与E-cad表达的相关性
89例浸润性导管癌组织中,Cx43和E-cad同时呈阳性表达31例,同时呈阴性表达34例。采用交叉表卡方检验,P<0.001,具有统计学意义,提示两个基因的表达相关联。经相关性检验求得列联系数r=0.460(P<0.001)。采用Kappa分析对两者表达的结果进行一致性检验,求得K=0.510(P<0.001),见表1。
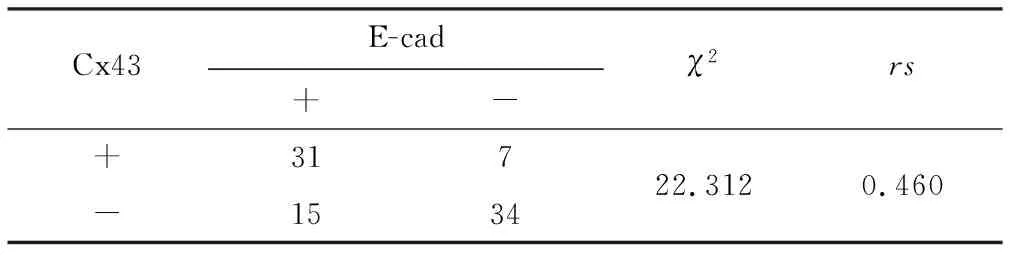
表1 Cx43与E-cad蛋白的表达关系
2.3 Cx43与E-cad 在乳腺癌3区中表达的相关性
48例乳腺癌手术标本分别检测肿瘤区、交界区及远癌区组织中Cx43和E-cad,分别获得同时呈阳性表达及同时呈阴性表达例数,并计算各组列联系数,采用Kappa分析对二者表达的结果进行内部一致性检验,求得K值(表2)。
2.4 Cx43与E-cad 共同表达和乳腺癌淋巴结转移的关系
肿瘤区及交界区中随着Cx43和E-cad阴性表达出现,淋巴结转移率逐渐增高,各组间差异有显著统计学意义;远癌区中各组间差异无统计学意义(P=0.341),见表3。

表2 CX43与E-cad在乳腺癌3区中表达的相关性(例)
表3CX43与E-cad在乳腺癌3区中表达与淋巴结转移的相关性[例(%)]
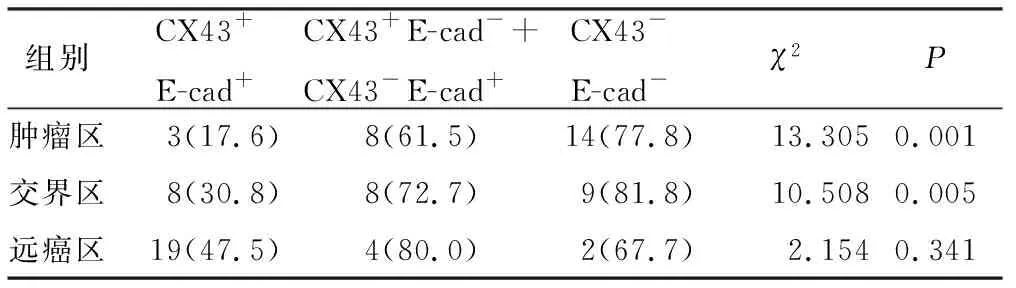
组别CX43+E-cad+CX43+E-cad-+CX43-E-cad+ CX43-E-cad-χ2P肿瘤区3(17.6)8(61.5)14(77.8)13.3050.001交界区8(30.8)8(72.7)9(81.8)10.5080.005远癌区19(47.5)4(80.0)2(67.7)2.1540.341
3 讨论
在乳腺癌的治疗上,无论是手术方式还是放化疗方案都已日趋成熟[2],但是仍有50%左右的患者在治疗后5年内出现复发而导致治疗失败。远处转移是乳腺癌患者的主要死因,也是影响乳腺癌预后的主要因素。因此从肿瘤生物学角度认识并寻求更合理、更准确预测转移的检测方法和标志性指标是一研究热点。E-cad通过介导Ca2+依赖性细胞间隙连接形成途径,促进Cx向胞膜转运,并引导由Cx43聚合的连接子对头铆接成间隙连接通道[3-6]。有研究发现Cx43可诱导E-cad的表达,并促进其转移到细胞膜,从而加强了细胞间隙连接通讯[7-9]。Bao等[10]认为钙黏蛋白是Cx组配的最主要因素之一,Cx43[11-12]及E-cad[13-15]与乳腺癌转移有关。
本研究通过检测89例浸润性导管癌组织发现,Cx43和E-cad的同向表达例数占总病例数的73.0%(65/89),证实二者在同一标本中的表达确有一定的正相关性。48例分区取材检测结果提示,Cx43和E-cad在肿瘤区、交界区、远癌区均有一定的相关性和较好的一致性。分区取材的研究结果说明,Cx43和E-cad在肿瘤区、交界区中Cx43和E-cad共同表达与淋巴结的转移有相关,且当Cx43和E-cad同时为阴性表达时,淋巴结转移率最高(77.8%),与其它学者研究相仿[16-18]。说明在浸润性导管癌组织中,E-cad通过调节Cx43聚合和转运从而促进了间隙连接的形成;缺乏E-cad使肿瘤细胞的间隙连接形成减少,肿瘤细胞也因缺乏间隙连接通信的监控从而易于脱落发生转移。因此我们认为Cx43和E-cad的表达下降可能是乳腺浸润性导管癌发生和发展过程中的共同事件,联合检测Cx43和E-cad可作为判断乳腺癌愈后的生物学指标。
[参考文献]
[1] 高一菁,陈 战,李 锐.连接蛋白43和上皮细胞钙黏蛋白在乳腺浸润性导管癌组织中表达的意义[J].中华乳腺病杂志(电子版),2012,6(3):26-29.
[2] 蔡新良,郑业华,龚 剑,等.基于计算机视觉的早期乳腺癌放射治疗一体化摆位系统研究[J].局解手术学杂志,2012,21(1):6-9.
[3] Alexander DB,Goldberg GS.Transfer of biologically important molecules between cells through gap junction channels[J].Curr Med Chem,2003,10(19):2045-2058.
[4] Berx G,Staes K,Van Hengel J,et al.Cloning and characterization of the human invasion suppressor gene E-cadherin (CDH1)[J].Genomics,1995,26(2):281-289.
[5] Li MW,Mruk DD,Lee WM,et al.Connexin 43 is critical to maintain the homeostasis of the blood-testis barrier via its effects on tight junction reassembly[J].Proc Natl Acad Sci USA,2010,107(42):17998-18003.
[6] Chakraborty S,Mitra S,Falk MM,et al.E-cadherin differentially regulates the assembly of Connexin43 and Connexin32 into gap junctions in human squamous carcinoma cells[J].J Biol Chem,2010,285(14):10761-10776.
[7] Gao FH,Wang Q,Wu YL,et al.c-Jun N-terminal kinase mediates AML1-ETO protein-induced connexin-43 expression[J].Biochem Biophys Res Commun,2007,356(2):505-511.
[8] Yano T,Yamasaki H.Regulation of cellular invasion and matrix metallo Proteinase activity in Hep G2 cell by connexin 26 transfection[J].Mol Carcinog,2001,31(2):101-109.
[9] Govindarajan R,Chakraborty S,Johnson KE,et al.Assembly of connexin43 into gap junctions is regulated differentially by E-cadherin and N-cadherin in rat liver epithelial cells[J].Mol Biol Cell,2010,21(23):4089-4107.
[10] Bao B,Jiang J,Yanase T,et al.Connexon-mediated cell adhesion drives microtissue self-assembly[J].FASEB J,2011,25(1):255-264.
[11] Laird DW,Fistouris P,Batist G,et al.Deficiency of Connexin43 gap junctions is an independent marker for breast tumors[J].Cancer Res,1999,59(5):4104- 4110.
[12] 杜俊泽,范林军,齐晓伟,等.MicroRNA-206可能通过调控Cx43表达调节人乳腺癌细胞的转移能力[J].第三军医大学学报,2013,3(2):115-120.
[13] Dong C,Wu Y,Yao J,et al.G9a interacts with Snail and is critical for Snail-mediated E-cadherin repression in human breast cancer[J].J Clin Invest ,2012,122(4):1469-1486.
[14] 李 忠,董 鹏,高默杰,等.上皮细胞钙粘蛋白与乳腺癌研究进展[J].武警医学院学报,2008,17(11):1023-1025.
[15] 黄 平,匡久树.乳腺癌手术治疗后血清E-cad、CA153和VEGF水平检测的临床意义[J].医学信息,2009,12(22):2767-2769.
[16] 王晓琳,吕世军.连接蛋白43在乳腺癌组织及癌前病变组织中的表达意义[J].肿瘤基础与临床,2010,23(4):292-295.
[17] Jamieson S,Going JJ,D’Arcy R,et al.Expression of gap junction proteins connexin 26 and connexin 43 in normal human breast and in breast tumours[J].J Pathol,1998,184(1):37-43.
[18] Frixen UH,Behrens J,Sachs M,et al.E-cadherin-mediated cell-cell adhesion prevents invasiveness of human carcinoma cells[J].J Cell Biol,1991,113(1):173-185.
