手工克隆小鼠胚胎的研究
2014-08-28张海平borVajta陈文彬杜玉涛
陈 玉,李 杏,张海平,Gábor Vajta,陈文彬,刘 杰,李 林,杜玉涛
(1.深圳华大方舟生物技术有限公司,广东 深圳 518083;2.深圳华大基因研究院,广东 深圳 518083)
众所周知,1997年首次获得的体细胞克隆绵羊[1]是在显微操作仪器辅助下,通过显微操作技术(传统克隆)把供体核移入去除遗传物质的成熟卵母细胞中,新移入的细胞核,发生发育重编程过程,形成重构胚。在获得克隆绵羊之后,黄牛、水牛、山羊、骡子、马、猪、小鼠、大鼠、兔子、猫、狗等多种克隆动物均通过显微操作技术相继问世[2]。
2004年,Vajta等人,利用手工克隆方法成功获得了克隆牛[3]。此方法是在体视显微镜下,手持特制刀片将无透明带卵母细胞的核切除,从而达到去核目的。手工克隆与传统克隆相比,无需使用显微操作仪,仅使用较简单的仪器设备和技术要求即可生产克隆动物。至今,通过手工克隆技术,已经生产出了猪[4]、基因猪[5]、转基因绵羊[6]等哺乳动物。
小鼠由于具有遗传背景清楚,繁殖周期短,饲养成本较低,材料比较容易得到等优点,成为一种广泛使用的模式实验动物[7,8]。第一只成纤维细胞克隆小鼠,由Wakayama等人在1998年获得[9]。研究人员通过显微操作直接将供体细胞注入去核卵母细胞,成功得到了来自颗粒细胞作为供体核的正常后代,以及支持细胞和神经细胞作为供体核的正常胎儿[9]。Atsuo Ogura等人,通过电融合法,将供体细胞核注入卵周隙,加以一定强度电脉冲,使供体细胞核与去核卵母细胞胞质产生融合,成功获得小鼠尾尖细胞克隆小鼠[9]。R.Ribas等人,在2005年发表的文章中,阐述了以钝头去核针和顶端封闭的分离管结合使用,去除无透明带卵母细胞细胞核,经电融合构建重构胚,继而获得克隆小鼠的实验[10]。
研究人员通过对卵母细胞透明带消化试剂、电激活参数、化学激活时间,以及培养试剂的研究,初步建立了一套适合本实验室运用的手工克隆技术及在体外条件下生产小鼠胚胎的实验流程,为转基因、胚胎干细胞、模式动物克隆等研究提供材料。
1 材料与方法
1.1 试剂
孕马血清促性腺激素(PMSG),人绒毛膜促性腺激素(hCG)购自宁波制药二厂。其余试剂购自Sigma公司。
1.2 实验动物
KM品系鼠,C57品系鼠和CF-1品系鼠均采购自广东省医学实验动物中心。
1.3 溶液配制
卵子采集液:M2,参考[11]配制。
去核液:为含有5 μg/mL细胞松弛素和10 μg/mL,20 μg/mL,或100 μg/mL链蛋白酶(pronase)的M2,即CBMP。
电融合液:PFM,参考[4]配制。
化学激活液:含5 mmol/L或10 mmol/L氯化锶(SrCl2)和5 μg/mL CB的无钙CZB液体。
培养液:CZB,配制参考[11]。mPZM,配制参考[12]。
体细胞培养液及细胞消化液:商品化高糖DMEM液加入1%谷氨酰胺(GLU),非必需氨基酸(NEAA),15%胎牛血清(FBS)配制成完全DMEM细胞培养液。商品化PBS粉末配制D-PBS。商品化0.05%胰蛋白酶(Trypsin)。
1.4 卵母细胞采集
室温条件下,7~8周龄的KM雌鼠,每只空腹腔注射10IU的PMSG,48 h后腹腔注射10IU hCG。在注射hCG 13 h后,采用断颈椎法处死小鼠,并且剪下输卵管连接卵巢段,转移至显微镜下,挑破输卵管膨大部,收集卵丘卵母细胞复合体(COCs)。将COCs放入含有透明质酸酶(Hya)的M2滴中,卵丘细胞脱落后的卵母细胞在M2中洗涤3遍,转移至切割盘里的M2滴中。
1.5 核供体细胞准备
核供体细胞系来自12.5 d的CF-C胎鼠,由CF-1♂与C57♀杂交得到,来自本实验室。在进行克隆实验之前1 h,选择24孔板中培养核供体细胞生长至汇合率达90%培养孔,用0.05%胰蛋白酶(Trysin)消化细胞,完全培养基终止消化,移液器轻微吹打后,液体转移到EP管中。
1.6 卵母细胞去核
用口吸管将切割盘里M2滴中卵母细胞一次转移10~15枚至20μL CBMP滴中,观察透明胞质中细胞核的位置,待透明带变薄变软时,用特殊HMC刀片将含有核的胞质部分切除,转移去核后细胞质到M2滴中存放。循环此动作至所有卵母细胞全部完成去核。
1.7 电融合过程
打开融合仪(BLS CF-150/B),调节电压及脉冲间隔。设计三组参数,Ⅰ为DC 130 V,83 μs;Ⅱ为DC 43 V,80 μs;Ⅲ为DC 80 V,40 μs。在融合盘中,将一枚去核胞质与一枚核供体细胞用植物凝集素(PHA)粘合后,置于PFM液滴中平衡,与另一枚去核胞质配对,再移入盛有融合液的融合槽电极之间(电极之间宽650 μm),用玻璃针轻拨,通过电流作用使重构体(去核胞质-核供体细胞-去核胞质)方向和电流方向垂直,最后开启电击。一次电击5套重构体,循环操作至所有配对重构体电融合完成。电击后,用玻璃针轻柔取下重构体,移入M2滴中。将融合后的重构胚置于CZB液中,于CO2培养箱,37 ℃中放置1 h。
1.8 化学激活
从培养箱中取出重构胚,在无钙离子CZB液中清洗3遍,移入含有Srcl2(5 mmol/L或10 mmol/L)及CB(5 μg/mL)的化学激活孔中,置于CO2培养箱,37 ℃,放置6 h。
1.9 重构胚培养
重构胚无透明带,故采用WOW培养系统。将化学激活后的重构胚,在CZB液中清洗3遍,逐个移入盛有CZB或mPZM的WOW孔中,置于CO2培养箱,37 ℃,培养至第4天,可观察囊胚发育情况。
1.10 统计分析
所有试验组至少重复3次,所得试验数据均用方差分析统计,确定差异的显著性。
2 结果
2.1 去核液中Pronase浓度对消化透明带时间的影响
统一脱去卵丘细胞的卵母细胞,15个卵母细胞为一组,放入含不同Pronase浓度的CBMP液滴中消化透明带并进行去核。由表1可见,三个浓度组别间差异显著。10 μg/mL组相比其它两个浓度组,卵母细胞可在10 μg/mL组液滴中存放更长时间(2.73±0.06 min)透明带才会完全消失,方便实验人员去核操作。在以后实验中,CBMP均采用10 μg/mL Pronase浓度配制。
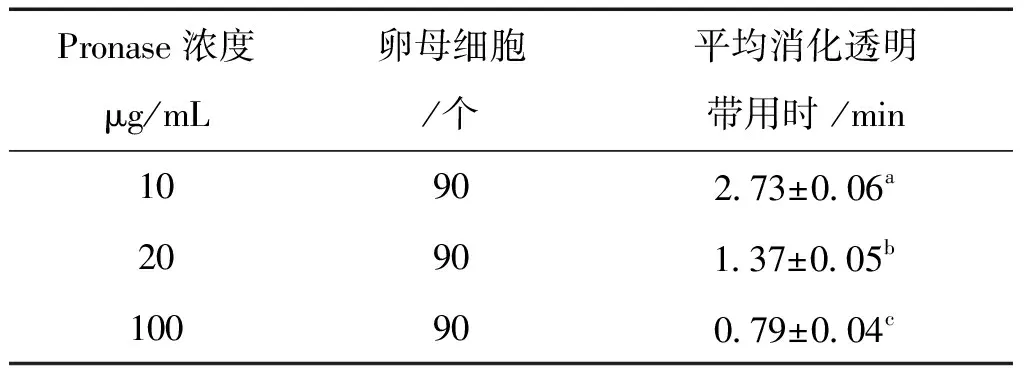
表1 不同Pronase浓度消化透明带时间比较
注:同一列表中上标不同表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05),下表同。
2.2 不同电融合参数对融合率的影响
实验采用3组电融合参数对用PHA粘合后的重构体进行电融合,结果如表2所示,只有Ⅲ(DC 80 V,40 μs)出现了融合,其余两组重构体在电击时或是电击后细胞质弥散,死亡。故电融合时,电融合仪器设置为DC 80 V,40 μs。
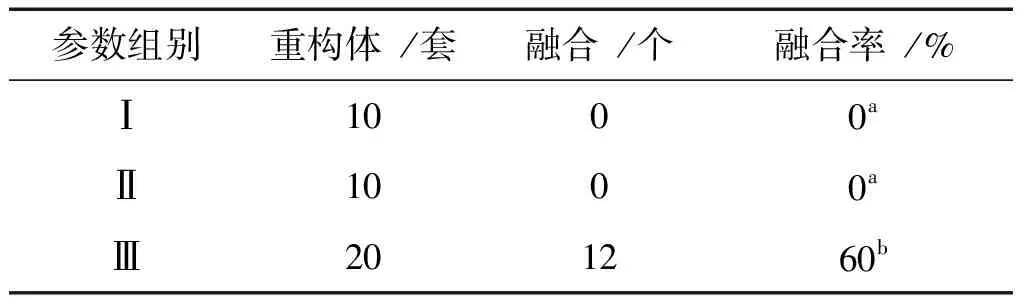
表2 不同电融合参数比较
2.3 不同氯化锶浓度的化学激活液对激活效果的影响
实验对添加两种不同浓度氯化锶的化学激活液进行了比较,结果可见表3,两组间差异显著。经过添加10 mmol/L Srcl2的激活液处理的重构胚,可以得到更多的囊胚。

表3 不同氯化锶浓度对激活效果的比较
2.4 不同培养液对胚胎发育的影响
在其他操作相同的情况下,比较了两种培养液对小鼠HMC重构胚体外发育的影响。结果如表4所示,两者在IVC囊胚率上无显著差异(P>0.05)。平均囊胚率显示,CZB作为IVC培养液可获得比较高的囊胚率,故实验选用CZB作为IVC液。

表4 不同培养液对胚胎发育的比较
3 讨论
传统克隆均用显微操作仪完成,本实验室首次采用HMC方法进行小鼠克隆胚胎生产。结合透明带消化、电激活参数设置、化学激活试剂浓度及培养液的选择,对小鼠HMC进行了尝试,摸索了小鼠体外生产克隆胚胎的新方法,并取得了初步的成果。
Pronase具有消化卵母细胞透明带的作用,研究人员参考牛和猪HMC[3,4]中去核液Pronase添加浓度,设计了本实验中Pronase浓度,并创新性地将Pronase与CB结合配制出CBMP,作为去核液。此消化液使得卵母细胞在透明带被消化的同时,细胞质疏松,易于切割去核,避免了单独用Pronase消化造成透明带消化过度,卵母细胞去核存活率低的现象。研究发现,使用10 μg/mL Pronase浓度的CBMP,可以让研究人员有充足的时间在15枚卵母细胞透明带未完全消化之前完成去核。
融合是体细胞核移植中的重要环节,细胞融合起源于膜的融合,膜的融合最初发生在两个细胞接触的部位,并逐渐扩大至完全融合为一个细胞[13]。R.RIBAS等,使用250 μm宽的融合槽,2.00 KV/cm,2×16 μs的参数融合无透明带卵母细胞与体细胞[10]取得了比较好的效果。但此参数对于本实验室操作不适用,而猪HMC中电融合参数也不能取得好的效果,在电击一瞬间,两枚胞质涣散死亡,或在从融合槽取出重构体后,在M2滴中死亡。使用DC 80 V,40 μs作为电击参数,可以取得60%平均融合率,在往后实验中需要进一步优化融合步骤及参数。
化学激活亦是核移植中不可缺少的步骤。本实验对比了在无钙离子CZB中添加CB及不同浓度氯化锶作为激活液,结果表明使用10 mmol/L氯化锶的激活效果优于5 mmol/L的浓度,此结果与R.RIBAS等[10]的结论一致。
小鼠胚胎操作实验手册[11]中介绍了CZB作为小鼠IVC培养液的配方,而在DasariAmarnath等发表的文章中,介绍了mPZM作为培养液IVC小鼠胚胎的效果[12]。本实验结果表明,两种培养液对小鼠HMC重构胚IVC效果无显著差异,从平均囊胚率上比较,CZB(29±3%)略优于mPZM(24±5%)。
综上所述,本实验室使用M2配制的含5 μg/mL CB和10 μg/mL Pronase的CBMP作为去核液,650 μm融合槽,PFM作为融合液,DC 80 V,40 μs电融合,融合后放置1 h,无钙离子CZB含10 mmol/L Srcl2与5 μg/mL CB作为激活液,CO2培养箱内,37 ℃激活6 h后,CZB作为IVC液,WOW系统培养,这一系列的操作后,可获得通过HMC方法体外生产小鼠胚胎。
目前,小鼠克隆效率仍然很低,在理论和技术上都还不成熟,对胚胎发育机制及调控还需要进一步的研究。我们相信,随着对哺乳动物细胞核移植研究的不断增多和深入,核移植各个环节的效率均会有所提高。小鼠HMC也将进行更进一步的优化和完善。
[1] Wilmutt,Schnieke A E,Mcwhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
[2] C Palmieri,P Loi,G Ptak,et al.Review paper:A review of the pathology of abnormal placentae of somatic cell nuclear transfer clone pregnancies in cattle,sheep,and mice [J].Veterinary Pathology Online,2012,865-880.
[3] Vajta G,Bartels P,Joubert J,et al.Production of a healthy calf by somatic cell nuclear transfer without micromanipulatiors and carbon dioxide incubators using the Handmade Cloning(HMC)and the Submarine Incubation System(SIS).Theriogenology,2004,Nov;62(8),1465-72.
[4] Du Y,Kraqh PM,Zhang Y,et al.Piglets born from handmade cloning,an innovative cloning method without micromanipulation[J].Theriogenology,2007,Nov;68(8),1104-10.
[5] Zhang P,Zhang Y,Dou H,et al.Handmade cloned transgenic piglets expressing the nematode fat-1 gene[J].Cell Reprogram,2012,Jun,14(3),258-66.
[6] Zhang P,Liu P,Dou H,et al.Handmade cloned transgenic sheep rich in omega-3 Fatty acids[J].PLoS One,2013,8(2).
[7] 郭淑华.小鼠体细胞核移植研究进展[J].安徽农业科学,2008,36(28),12279-12281.
[8] 王怡.小鼠体细胞核移植研究进展[J].中国畜牧兽医,2009,36(3),97-101.
[9] Atsuo Ogura,Kimiko Inoue,Kaoru Takano,et al.Birth of Mice After Nuclear Transfer by Electrofusion Using Tail Tip Cells[J].Molecular Reproduction and Development,2000,57:55-59.
[10] R Ribas,Oback,W Ritchie,et al.Development of a Zona-Free Method of Nuclear Transfer in the Mouse[J].Cloning and Stem Cells,2005,7:126-138.
[11] 孙青原,陈大元 主译.小鼠胚胎操作实验手册[M].第三版,2005,9.
[12] DasariAmarnath,Sayaka Wakayama,Jie Zhu,et al.The novel use of modified pig zygotic medium for the efficient culture of the preimplantation mouse embryos.Theriogenology,2011,1639-1646.
[13] 王怡,鞠辉明,薛整风,等.融合条件对小鼠体细胞核移植融合率的影响[J].实验动物与比较医学,2009,29(6),366-371.
Abstract:Compared with the traditional cloning,cloned animals could be made by more simple equipments and technical operations,and that procedure is handmade cloning(HMC).
As model animals,mouse are applied in many fields.In the present study,nuclear donor came from hybrided fetal cell lines;zona pellucida digestion and enucleating happed in droplets of Cytochalasin B(CB)and Pronase and 2% serum M199hepes buffer(CBMP);1hour after electric fusion,the reconstructed embryos were set into Ca2+-free activation medium containing SrCl2and CB(5 mu g/mL)for the next 6 hours;finally,the embryos were culture to blastocyst stages in a WOW system with culture medium(IVC).The results show that:Firstly,compared with 20μg/mL and 100μg/mL,CBMP with 10μg/mL pronase was suitable for operation due to zona pellucid had sufficient time for digestion while enucleating.Secondly,80v DC,with 40μs endurance time,the fusion rate achieved 60%.Third,chemical activation with10mM SrCl2significantly increased the blastocyst rate compared with 5mM(29±3% vs 13±3%,P<0.05).Fourthly,a comparison between CZB and mPZM,there was no significant difference in blastocyst rate(29±3% vs 24±5%,P>0.05),but more blastocysts could be obtained when embryos cultured in CZB.
After investigate the digestion time,fusion parameters,chemical activation and culture mediums,a novel HMC procedure for cloned embryos of mouse is established for the first time,although the technical optimization and higher efficiency are required further research.
Keywords:mouse;HMC;zona pellucida digestion;electric fusion;chemical activation;in vitro culture
