体外成熟培养前后山羊卵泡发育相关基因及其受体表达特性的研究
2014-08-28张春香郑亚琳张彩霞岳文斌任有蛇
张春香,秦 雪,郑亚琳,张彩霞,岳文斌,任有蛇
(山西农业大学 动物科技学院,山西 太谷 030801)
卵母细胞成熟过程中受到许多基因及受体基因的调控,其中转移生长因子β家族的基因,例如生长分化因子9(GDF9)、骨形态蛋白15(BMP15)、BMP6直接或间接影响卵母细胞发育和成熟[1],BMPs作用于颗粒细胞、卵母细胞,通过自分泌或旁分泌作用调节卵泡的生长和发育[2]。Juengel等已在绵羊原始卵泡及处于不同发育阶段的卵泡中发现表达有GDF9和BMP6 mRNA[3,4]。BMP15主要表达在初级卵母细胞阶段[5],可以增强卵母细胞发育的全能型[6]。GDF9、BMP15和BMP6可以增强颗粒细胞的有丝分裂活性[3,7]。GDF9、BMP15和BMP6在卵巢中发挥作用需与受体BMPRII、TGFBR1和BMPR1B结合,激活丝氨酸-苏氨酸蛋白激酶相级联的信号通路。另外。卵丘细胞特异性表达的前列腺素内过氧化物酶2(Ptgs2)在体外成熟中也起重要作用,Dinchuk等[8]认为,Ptgs2功能缺陷可能会导致卵母细胞不能成熟,具体表现为不排出第一极体。以上所述基因不仅与卵母细胞成熟有关,而且也是与高繁殖力相关的基因。目前这些研究主要集中在人、鼠、绵羊上,然而关于山羊卵母细胞体外成熟培养前后这些转移生长因子β基因及其受体表达特性的研究还未见报道。本试验以晋岚绒山羊6~8周龄母羔为供体,通过超数排卵获取未成熟卵母细胞,经体外成熟培养后,比较分析卵母细胞成熟前后卵泡发育相关基因和受体基因的表达情况。
1 材料与方法
1.1 样品采集
1.1.1 卵丘-卵母细胞复合体的收集 本试验选用6~8周龄、健康状况良好、体重相近的3只晋岚绒山羊母羔作为超数排卵对象,每天注射2次FSH(BIONICHE Animal Health Canada INC),每次4 mg,连续注射2 d,最后1次加注400 IU PMSG(宁波三生药业有限公司)。采用手术活体取卵,然后在体视镜下检出形态正常的卵丘-卵母细胞复合体(COCs),记录每只羔羊所获得未成熟卵母细胞数。试验用母羔由山西农业大学动物科技学院生态畜牧站提供。
1.1.2 卵母细胞成熟培养及收集 将检出的COCs用预热的采卵液(9.5 mg/mL TCM199,5.958 mg/mL hepes,2.2 mg/mL NaHCO3,10 μg/mL heparin,3 mg/mL BSA,0.05 mg/mL链霉素和0.06 mg/mL链霉素)冲洗3次,用成熟液(9.5 mg/mL TCM199、5.958 mg/mL hepes、2.2 mg/mL NaHCO3、10% FBS、0.3 mmol/L丙酮酸钠、100 μg/mL谷氨酰胺、50 ng/mL IGF-I、10 μg/mL FSH,10 μg/mL LH、1 μg/mL E2、100 μg/mL链霉素和100 μg/mL链霉素)冲洗2次。将每只羔羊收获的卵母细胞平均分为2份,其中1份将周围颗粒细胞吹打后放入冻存管中,标记,液氮中保存;另一份放入预平衡好的四孔板(成熟培养液600 μL,石蜡油280 μL),于38.6 ℃、5%CO2和100%饱和湿度的CO2培养箱内培养24 h。将培养后的细胞放入0.1%的透明质酸酶中,吹打除去卵丘细胞为止。观察卵母细胞,以排出第一极体作为卵母细胞成熟的标志,检出成熟卵母细胞,放入冻存管中,标记,液氮中保存备用。
1.2 RT-PCR定量分析
1.2.1 引物设计与合成 本试验荧光定量PCR所用引物中BMP6、BMP15、GDF9是引自Ebrahimi等[9],Ptgs2、BMPRII、TGFβRI和BMPR1B引自Kyasari等[10]。18s内参基因根据Genbank数据库中DQ222453设计,引物序列见表1。引物由北京六合华大生物技术有限公司合成。

表1 荧光定量PCR引物序列
1.2.2 卵母细胞RNA提取 按照Array PureTMNano-scale RNA Purification Kit说明书步骤提取卵母细胞的RNA,并用核酸蛋白测定仪测定RNA浓度和纯度。根据PrimeScriptTMRT Master说明书,以RNA为模板合成cDNA,-20 ℃保存备用。
1.2.3 RT-PCR标准曲线的绘制 卵母细胞样本的cDNA 2×稀释6个梯度,使每个PCR反应体系中起始模板数分别为26、25、24、23、22、21,同时设不加cDNA空白管为阴性对照。根据SYBR Premix Ex TaqTM试剂盒说明书建议的反应体系:SYBR Premix Ex TaqTM12.5 μl,cDNA模板2.0 μl,正反向引物各0.5 μl(18S rRNA 内参和7个目的基因),ddH2O 9.5 μl,总体积25 μl;95 ℃ 10 s变性,95 ℃ 5 s,63~64 ℃ 30 s,共44个循环,进行荧光定量反应,软件自动得出扩增曲线、熔解曲线和循环阈值,分析所得结果。
1.2.4 目的基因RT-PCR反应 3只羊的未成熟卵母细胞和成熟卵母细胞共6个样本,每个样本另设技术重复3次,进行内参基因和目的基因的相对定量分析。根据CT值和标准曲线来计算定量的结果。
1.3 统计分析
RT-PCR的试验结果应用MX3000P导出。目的基因与内参基因使用-△△CT法来获得它们的相对表达量。使用SPSS17.0软件处理数据。
2 结果与分析
2.1 总RNA提取与RT-PCR检测
经核酸蛋白测定仪测定卵母细胞总RNA的浓度和纯度,所有样品OD260/OD280均在1.8~2.0之间,这说明提取的总RNA质量可靠,符合后续试验要求。
2.2 标准曲线的建立与RT-PCR结果
图1为软件自动生成的BMP15基因和内参基因18 s RNA标准曲线,由图可以看出,BMP15基因和内参基因18 s RNA在6个数量级上呈现良好的线性关系,回归系数分别为0.999和0.998,扩增效率分别为101.6%和105.5%,均在100%~110%之间,说明本试验建立的内参基因18 s和目的基因的定量检测方法是有效的。图2为目的基因和内参基因18 s RNA的 RT-PCR扩增曲线,从图可以看出,所有扩增曲线的基线平稳、拐点清楚、曲线整体的一致性和平行性良好,说明本试验建立的定量检测的结果是可靠的。
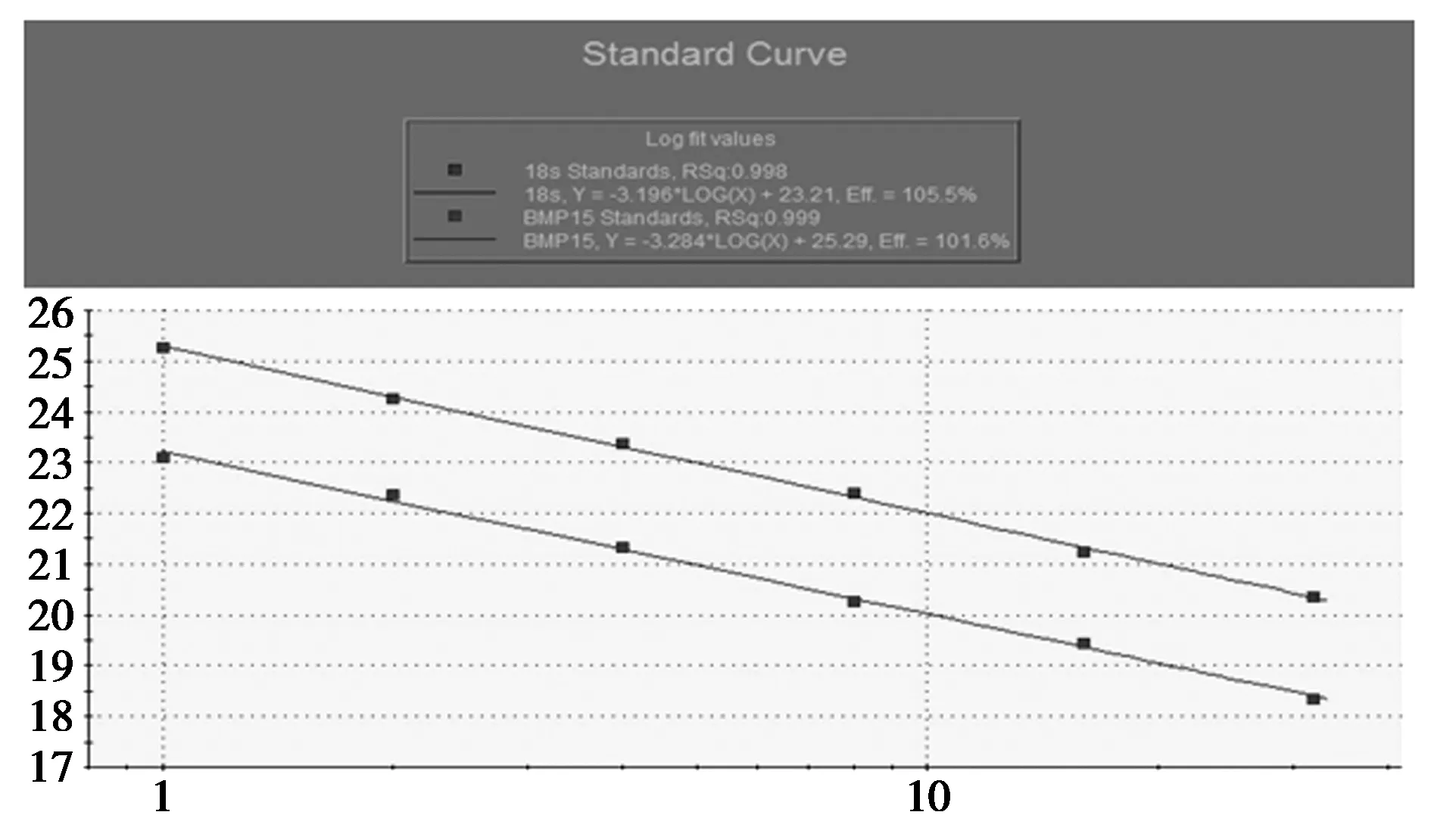
图1 BMP15和18 s rRNA标准曲线
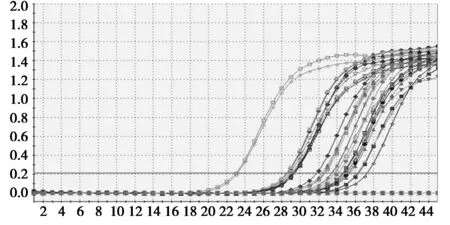
图2 部分目的基因与18 s rRNA扩增曲线
2.3 卵泡发育相关基因和受体基因的表达差异
体外成熟培养前后卵母细胞发育相关基因及其受体的表达情况见图3和图4。图3为与卵母细胞发育相关基因BMP6、BMP15、GDF9和Ptgs2的相对表达量结果。从图3可以看出,未成熟卵母细胞中GDF9和BMP15的mRNA表达量与成熟卵母细胞中的表达量差异不显著(P>0.05)。成熟卵母细胞中BMP6的mRNA表达量显著高于未成熟卵母细胞的表达量(P<0.05),然而成熟卵母细胞中Ptgs2的mRNA极显著低于未成熟卵母细胞的表达量(P<0.01)。

图3 BMP6、BMP15、GDF9和Ptgs2基因在山羊未成熟和成熟卵母细胞中的相对表达量

图4 TGFβRI、BMPRIB和BMPRII基因在山羊未成熟和成熟卵母细胞中的相对表达量
图4为其受体基因TGFβRI、BMPRII、BMPRIB的相对表达量结果。从图4可以看出,卵母细胞成熟后,BMPRⅡ、TGFβRI和BMPRIB的表达量极显著上调(P<0.01)。
3 讨论
卵母细胞的成熟主要依赖于卵泡及卵泡周围细胞RNA和蛋白质的产生及积累。Sanchez等[11]结果显示,家鼠卵母细胞体外成熟培养后BMP15和GDF9 mRNA表达量显著降低。然而Assou等[12]结果显示,人卵母细胞成熟后BMP15 mRNA表达量显著上调,GDF9 mRNA表达量显著下调。Lequarre等[13]报道,肉牛卵母细胞成熟前后GDF9 mRNA表达量无显著差异。本研究结果显示山羊卵母细胞培养前后GDF9和BMP15的mRNA表达量差异不显著,与绵羊卵母细胞培养前后GDF9和BMP15的mRNA表达量的变化趋势基本一致[10]。然而本研究结果显示BMP6 mRNA表达量显著增加,而绵羊的在成熟培养前后其表达量差异不显著。也就是说,不同动物种类之间其卵母细胞体外培养前后BMP15、GDF9和BMP6 mRNA表达量变化是有差异的。
Ptgs2主要表达在颗粒细胞中,对卵母细胞成熟有调控作用。本研究结果显示Ptgs2基因在卵母细胞成熟后显著下调,这说明其可能主要在未成熟卵母细胞中发挥作用。然而Kyasari等[10]结果显示绵羊卵母细胞成熟前后Ptgs2 mRNA表达量差异不显著。目前关于卵母细胞成熟前后Ptgs2 mRNA表达特性的研究较少,还有待进一步深入研究和验证。
有研究显示在绵羊卵母细胞成熟后BMPRIB 和BMPRⅡ mRNA表达量显著增加,TGFβRI mRNA表达量无显著差异[10]。而本研究结果显示山羊卵母细胞成熟后BMPRIB、BMPRⅡ和TGFβRI三个受体的表达水平均显著增加。BMPRⅡ可以作为BMP15、GDF9和BMP6的受体,其mRNA表达量增加可以直接增加BMP15、GDF9和BMP6的生物学作用;另一方面,成熟后BMP6表达量增加可能诱导其受体BMPRⅡ和BMPRIB的增加。TGFβRI在绵羊和山羊卵母细胞成熟前后的不一致性,需要进一步的验证。
[1] Erickson G F,Shimasaki S.The role of the oocyte in folliculogenesis[J].Trends Endocrinol Metab,2000,11:193-198.
[2] Shimasaki S,Zachow R J,Li D,et al.A functional bone morphogenetic protein system in the ovary [J].Proceedings of the National Academy of Sciences,1999,96(13):7282-7287.
[3] Juengel JL1,Bodensteiner KJ,Heath DA.Physiology of GDF9 and BMP15 signalling molecules[J].Anim Reprod Sci.2004,82-83:447-60.
[4] Juengel J L,Reader K L,Bibby A H,et al.The role of bone morphogenetic proteins 2,4,6 and 7 during ovarian follicular development in sheep:contrast to rat [J].Reproduction,2006,131(3):501-513.
[5] Juengel JL,Hudson NL,Heath DA,et al.Growth differentiation factor 9 and bone morphogenetic protein 15 are essential for ovarian follicular development in sheep[J].Biol Reprod.2002,67(6):1777-1789.
[6] Sudiman J,Sutton-McDowall ML,Ritter LJ.et al.Bone morphogenetic protein 15 in the pro-mature complex form enhances bovine oocyte developmental competence[J].PLoS One.2014,9(7):e103563.
[7] Glister C,Kemp C F,Knight P G.Bone morphogenetic protein(BMP)ligands and receptors in bovine ovarian follicle cells:and actions of BMP-4,-6 and-7 on granulose cells and differential modulation of Smad-1 phosphorylation by follistatin[J].Reproduction 2004,127:239-254.
[8] Dinchuk J E,Car B D,Focht R J,et al.Renal abnormalities and an altered inflammatory response in mice lacking cyclooxygenase Ⅱ [J].Nature,1995,378(6555):406-409.
[9] Ebahimi B,Valojerdi M R,Eftekhari-Yazdi P,et al.IVM and gene expression of sheep cumulus-oocytes complexes following different methods of vitrification[J].Reprod Biomed Online,2010,20:26-34.
[10] Kyasari OR1,Valojerdi MR,Farrokhi A,et al.Expression of maturation genes and their receptors during in vitro maturation of sheep COCs in the presence and absence of somatic cells of cumulus origin[J].Theriogenology.2012,77(1):12-20.
[11] Sánchez F,Adriaenssens T,Romero S,et al.Quantification of oocyte-specific transcripts in follicle-enclosed oocytes during antral development and maturation in vitro[J].Mol Hum Reprod.2009,15(9):539-50.
[12] Assou S,Anahory T,Pantesco V,et al.The human cumulus-oocyte complex gene-expression profile[J].Hum Reprod.2006,21(7):1705-1719.
[13] Lequarre AS,Traverso JM,Marchandise J,et al.Poly(A)RNA is reduced by half during bovine oocyte maturation but increases when meiotic arrest is maintained with CDK inhibitors[J].Biol Reprod.2004,71(2):425-431.
