西红花酸改善大鼠酒精性脂肪肝作用机制研究
2014-08-28王建敏
王建敏 李 伟 刘 江
(河北医科大学第四附属医院药学部,河北 石家庄 050011)
实验研究
西红花酸改善大鼠酒精性脂肪肝作用机制研究
王建敏 李 伟 刘 江
(河北医科大学第四附属医院药学部,河北 石家庄 050011)
目的研究西红花酸对酒精性脂肪肝大鼠的作用及其机制。方法将30只雄性SD大鼠随机分为健康对照组、模型组及西红花酸组,每组各10只。模型组及西红花组大鼠均行酒精性脂肪肝造模,同时西红花酸组予西红花酸50mg/(kg·d)灌胃预防性治疗。比较3组大鼠血清丙氨酸氨基转移酶(ALT)、甘油三酯(TG)水平及肝脏极低密度脂蛋白(VLDL)分泌速率,肝脏TG、游离脂肪酸(FFA)含量,肝脏脂肪酸线粒体β-氧化速率及脂肪酸过氧化物酶体β-氧化速率,苯胺羟化酶(ANH)、乙醇脱氢酶(ADH)及乙醛脱氢酶(ALDH)活性,肝脏超氧化物歧化酶(SOD)活性、谷胱甘肽(GSH)含量及丙二醛(MDA)含量。结果模型组与西红花酸组大鼠血清ALT和TG含量、肝脏TG和FFA含量、肝质量系数均高于健康对照组(P<0.01,P<0.05),而西红花酸组均低于模型组(P<0.01,P<0.05);模型组及西红花酸组大鼠肝脏脂肪酸线粒体β-氧化速率、过氧化物酶体β-氧化速率和VLDL分泌速率均低于健康对照组(P<0.05,P<0.01),且西红花酸组脂肪酸线粒体β-氧化速率高于模型组(P<0.05);与健康对照组比较,模型组ANH活性及MDA含量升高(P<0.05),ADH、ALDH、SOD活性及GSH含量降低(P<0.01),而西红花酸组ANH活性及MDA含量较模型组降低(P<0.05),ADH、ALDH、SOD活性及GSH含量升高(P<0.05)。结论西红花酸对酒精性脂肪肝有改善作用,其作用机制可能是通过加速肝脏线粒体脂肪酸氧化,增强血浆中TG消除速度,减轻肝脏脂肪堆积,增强ALDH活性,进而加速乙醇和乙醛的清除。
脂肪肝,酒精性;西红花;疾病模型,动物;动物,实验
由于人们社交、生活环境的改变,酒精性脂肪肝(alcoholic fatty liver,AFI)的发病率也逐年升高,导致酒精性肝炎、酒精性肝纤维化和肝硬化的发病率也升高。近几年,对AFI的研究越来越多,其发病机制主要是乙醇使肝内脂肪代谢发生障碍,导致脂肪在肝细胞内堆积,最终形成脂肪肝[1]。还有研究表明,大量乙醇可使体内游离脂肪酸(FFA)增加,而FFA可损害生物膜,增加肿瘤坏死因子(TNF)的毒性作用,导致肝细胞脂肪变性[2]。
西红花酸(crocetin)是番红花属植物西红花中的提取物,是一种特殊的水溶性类胡萝卜素。有研究报道,西红花酸可抑制细胞氧化,增强细胞抗氧化作用,主要活性部位在肝脏和肾脏,且可用于治疗动脉粥样硬化、心肌缺血、脑缺血等多种疾病,对心血管系统具有广泛的活性,可改善能量代谢[3-5]。本研究通过对SD大鼠进行酒精性脂肪肝造模,同时预防性给予西红花酸治疗,探讨西红花酸改善AFL的作用机制,结果如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠30只,由中国药科大学实验动物中心提供,动物合格证号SYXK(苏) 2013-0010,体质量250~300g,置室温(22±3) ℃,明暗各12h(8:00-20:00)饲养,自由饮水。
1.1.2 实验药品 西红花酸:根据文献[6]中Wittig Homer反应方法生成西红花酸二甲酯,西红花酸二甲酯水解得西红花酸,高效液相色谱法(HPLC法)测定含量>80%西红花酸,用0.9%氯化钠注射液配制成混悬液。氧化型辅酶Ⅱ(NAD,广州市齐云生物科研试剂有限公司),还原型辅酶Ⅱ(NADPH,广州市齐云生物科研试剂有限公司),辅酶A(COA,上海金穗生物科技有限公司),软脂酰辅酶A(palmitoyl COA,上海金穗生物科技有限公司),软脂酰肉毒碱(paimitoyl carnitine)、鱼藤酮、表面活性剂(Triton WR-1339)、TritonX-100均由美国Sigma公司生产,其余试剂均为分析纯。
1.1.3 试剂 丙氨酸氨基转移酶(ALT)试剂盒、乙醇脱氢酶(ADH)试剂盒、超氧化物歧化酶(SOD)试剂盒、甘油三酯(TG)试剂盒、游离脂肪酸(FFA)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒,均购自南京建成生物工程研究所。
1.1.4 主要仪器 离心机、 UniCel DxC 800Synchron全自动分析仪,均为美国贝克曼Beckman coulter公司。
1.2 动物分组及造模 取雄性SD大鼠30只,随机分为3组,即健康对照组、模型组及西红花酸组,每组各10只。健康对照组予标准饲料饲养,0.9%氯化钠注射液15mL/(kg·d)灌胃10周。模型组和西红花酸组予高脂饲料饲养(广州启正化工科技有限公司提供,含10%猪油、37%蔗糖和2%胆固醇)10周,同时前4周予20%乙醇15mL/(kg·d)灌胃,后6周改为50%乙醇15mL/(kg·d)灌胃。在此期间,西红花酸组予西红花酸50mg/(kg·d)灌胃进行预防性治疗。
1.3 检测指标
1.3.1 血清ALT、TG含量及肝脏极低密度脂蛋白(VLDL)分泌速率测定 各组大鼠末次给药后禁食8 h,眼眶取血,1500r/min,离心5min获得血清,按试剂盒方法测定血清ALT、TG。静脉注射 Triton WR-1339,于注射前(TG0)、注射后45min和90min(TG1)眼眶取血测定TG水平,通过测定不同时间点血浆TG含量,计算VLDL分泌速率。VLDL分泌速度计算公式:VLDL=(TG1- TG0)/T×(0.0276×BW+3.380)×60,其中T为90min,BW为小鼠体质量[7]。
1.3.2 肝质量系数、肝脏TG和FFA含量测定 各组大鼠断头处死,取肝脏称质量,计算肝质量系数[计算公式为:肝质量系数=(肝质量/体质量)×100%]。肝组织按质量体积比1g∶9 mL加入0.9%氯化钠注射液于冰浴中制成匀浆,取0.1mL匀浆,加入0.9 mL脂质抽提液,混匀,涡旋,3500r/min,离心15min,取0.5mL,有机相,用氮气吹干,加入异丙醇250μL,溶解,按试剂盒方法测定肝脏TG和FFA。
1.3.3 肝脏脂肪酸线粒体β-氧化速率和脂肪酸过氧化物酶体β-氧化速率测定 按照文献[8]方法测定脂肪酸线粒体β-氧化速率,按照文献[9]方法测定脂肪酸过氧化物酶体β-氧化速率。
1.3.4 苯胺羟化酶(ANH)、乙醇脱氢酶(ADH)及乙醛脱氢酶(ALDH)活性测定 根据参考文献[10]方法测定ANH活性。肝组织按1g∶9 mL加入预冷0.01mmol/L Tris液,匀浆,1500r/min 离心10min,取上清液,10000r/min 离心15min,取上清液,按试剂盒方法测定ADH活性。按参考文献[11]方法测定ALDH活性。
1.3.5 肝脏超氧化物歧化酶(SOD)活性、谷胱甘肽(GSH)及丙二醛(MDA)含量测定 取肝脏匀浆,SOD的测定方法参考文献[12],GSH的测定方法参考文献[13],MDA含量测定参考文献[14]。
1.3.6 肝脏病理学检测 取各组大鼠肝脏右叶,用4%甲醛溶液固定,经石蜡包埋,切片,苏木素-伊红(HE)染色,光镜下观察肝脏。

2 结 果
2.1 3组大鼠血清ALT和TG、肝脏TG和FFA含量及肝质量系数比较 见表1。
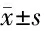

组 别n血清ALT(U/L)血清TG(mmol/L)肝脏TG(mmol/L)肝脏FFA(mmol/L)肝质量系数(%)健康对照组1051.3±4.22.44±0.212.51±0.262.31±0.322.37±0.12模型组1095.6±10.3∗6.79±1.02∗∗5.30±1.05∗∗4.03±1.51∗∗4.98±1.11∗西红花酸组1065.7±8.7∗△3.99±0.57∗△3.43±0.71∗△3.08±0.27∗3.83±0.66∗△
与健康对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05
由表1可见,与健康对照组比较,模型组大鼠血清ALT和TG含量、肝脏TG和FFA含量、肝质量系数均升高,比较差异有统计学意义(P<0.05,P<0.01),而西红花酸组均低于模型组(P<0.05),但仍高于健康对照组(P<0.05)。
2.2 3组大鼠肝脏脂肪酸线粒体β-氧化速率、脂肪酸过氧化物酶体β-氧化速率及VLDL分泌速率比较 见表2。
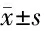

组 别n肝脏脂肪酸线粒体β-氧化速率[nmol/(5min·mg)]肝脏脂肪酸过氧化物酶体β-氧化速率[nmol/(min·mgpro)]VLDL分泌速率[mmol/(L·min)]健康对照组103.3±0.22.5±0.30.46±0.1模型组101.9±0.5∗1.4±0.2∗∗0.21±0.4∗∗西红花酸组102.4±0.1∗△1.5±0.9∗0.23±0.2∗
与健康对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05
由表2可见,模型组及西红花酸组大鼠肝脏脂肪酸线粒体β-氧化速率、脂肪酸过氧化物酶体β-氧化速率及VLDL分泌速率均较健康对照组降低(P<0.05,P<0.01),而西红花酸组肝脏脂肪酸线粒体β-氧化速率高于模型组(P<0.05),脂肪酸过氧化物酶体β-氧化速率和VLDL分泌速率与模型组比较差异无统计学意义(P>0.05)。2.3 3组大鼠ANH、ADH及ALDH活性比较 见表3。
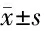

组 别nANH[nmol/(min·mg)]ADH(U/mg)ALDH(U/mg)健康对照组109.54±1.2340.61±5.0326.55±7.61模型组1015.39±2.50∗18.44±7.12∗∗15.33±3.94∗∗西红花酸组109.90±1.91△35.5±8.09△18.19±2.99△
与健康对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05
由表3可见,与健康对照组比较,模型组ANH活性升高(P<0.05),ADH及ALDH活性降低(P<0.01);而西红花酸组ANH活性较模型组降低(P<0.05),ADH及ALDH活性升高(P<0.05),与健康对照组比较差异无统计学意义(P>0.05)。
2.4 3组大鼠肝脏MDA、GSH含量及SOD活性比较 见表4。
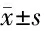

组 别nMDA(nmol/mg)GSH(U/g)SOD(U/mg)健康对照组103.57±1.53180.9±25.8126.6±17.1模型组1012.19±1.40∗138.4±17.1∗∗105.3±13.4∗∗西红花酸组104.10±1.05△175.5±10.9△119.9±12.9△
与健康对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05
由表4可见,与健康对照组比较,模型组MDA含量升高(P<0.05),GSH含量及SOD活性降低(P<0.01);而西红花酸组MDA含量较模型组降低(P<0.05),MDA含量及SOD活性升高(P<0.05),与健康对照组比较差异无统计学意义(P>0.05)。
2.5 3组大鼠肝脏病理学比较 健康对照组可见正常肝细胞(见封3,图1)。模型组可见大量脂质沉积,脂肪变性细胞(见封3,图2)。西红花酸组可见脂质沉积,脂肪变性,但程度较模型组轻(见封3,图3)。
3 讨 论
国内外研究发现,西红花酸具有清除氧自由基和抗脂质过氧化功能的作用,对心血管、肝肾功能均有保护作用[15-16]。文娜等[16]通过对大鼠心肌缺血再灌注损伤造模,同时给予西红花酸预防治疗发现,其对心肌损伤有到一定的改善作用,其作用机制可能是增加缺血心肌能量物质含量,保护ATPase活性,进而改善能量代谢障碍。刘同征等[17]通过对异丙肾上腺素致大鼠急性心肌缺血研究发现,西红花酸通过降低血清肌酸激酶、低密度脂蛋白的释放,以及MDA水平而抑制心肌水肿,保护心肌。
酒精性脂肪肝发病机制主要是乙醇在体内代谢过程中生成的乙醛量增加,使二羧酸循环受到抑制,脂肪酸氧化能力降低,导致脂肪代谢和转运紊乱。因此,加速乙醛代谢,降低肝脏中FFA和TG含量,可减少脂肪在肝中的沉积,减轻脂肪肝发生程度。西红花酸可清除羟自由基,抑制红细胞溶血,并降低脂质过氧化反应的终产物MDA,对肝线粒体诱导氧化引起的MDA产生有明显抑制作用,由此增强脂肪酸的氧化和外排。
本实验通过对大鼠酒精性脂肪肝造模,同时给予西红花酸预防治疗,并对肝细胞线粒体和过氧化物酶体2个指标进行检验,结果发现西红花酸能够增强脂肪酸线粒体β-氧化活性,而对过氧化物酶体系统和VLDL分泌速度没有明显影响,说明西红花酸对于酒精性脂肪肝的改善作用来源于对线粒体脂肪酸氧化系统的活化,而与过氧化物酶体以及VLDL的外排没有关系,这与施韵等[18]得出的结论一致。同时,本实验通过对血清及肝脏中TG的检测发现,西红花酸对TG的消除具有增强作用,其作用机制主要是通过降低脂蛋白酶抑制因子载脂蛋白-C的水平,提高了肝脏脂蛋白酶活性,增强血浆中TG消除速度,最终降低血清TG水平。有研究表明,西红花酸可激活过氧化物酶增殖体激活受体-α(PPARa)活性,而PPARa活性的升高造成肝脏脂蛋白酶表达的增强和载脂蛋白-CⅢ表达水平的下降,这与本研究结果一致[19]。
综上所述,西红花酸不仅可改善心脑血管损伤,还可改善酒精性脂肪肝,其作用机制是通过加速肝脏线粒体脂肪酸氧化,增强ALDH活性,进而加速乙醇和乙醛的清除。同时,通过降低脂蛋白酶抑制因子载脂蛋白-C的水平,提高了肝脏脂蛋白酶活性,增强血浆中TG消除速度,最终降低血中TG水平,减轻肝脏脂肪堆积。
[1]王冬梅,王兵,于聪,等.酒精性脂肪肝形成过程中肝细胞脂肪性病变的机制[J].山东大学学报:医学版,2012,50(7):19-25.
[2]宫嫚,罗生强,张宁,等.酒精性肝病的发病机制研究进展[J].临床荟萃,2013,28(3):350-352.
[3]向敏,王建梅,周成华,等.西红花酸对AGEs诱导血管内皮细胞通透性增加的抑制作用[J].中国药理学通报,2011,27(9):1254-1259.
[4]Potenza MA,Gagliardi S,Nacci C,et al.Endothelial dysfunction in diabetes:from mechanisms to therapeutic targets[J].Curr Med Chem,2009,16(1):94-112.
[5]向敏,周成华,钱之玉.西红花酸对晚期糖基化终产物诱导牛血管内皮细胞E-选择素表达的抑制作用[J].中国临床药理学与治疗学,2010,15(7):764-769.
[6]张俊国,张宏,张伶,等.西红花酸的合成[J].化学学报,2008,66(12):1451-1454.
[7]Funatsu T,Goto M,Kakuta H,et al.Reduetion in hepatic non-esterifed fatty acid concentration after longterm treatment with atorveststin lowers hepatic triglyceride synthesis and its secretion in sucrose-fed rats[J].Biochim Biophys Acta,2002,1580(2-3):161-170.
[8]Osmundsen H.Spectrophotometric procedure for measuring mitochondrial β-oxidation[J].Methods Enzymol,1981,72:306-314.
[9]Osmundsen H,Brodal B,Hovik R.A luminometric assay for peroxisomalβ-oxidation[J].Biochem J,1989,260(1):215-220.
[10]Burke MD,Prough RA,Mayer RT.Characteristics of a microsomal cytochrome P-448-mediated reaction.Ethoxyresorufin O-de-ethylation[J].Drug Metab Dispos,1977,5(1):1-8.
[11]Koivisto T,Eriksson CJ.Hepatic aldehyde and alcohol dehydrogenases in alcohol-preferring and alcohol-avoiding rat lines[J].Biochem Pharmacol,1994,48(8):1551-1558.
[12]Oyanagui Y.Reevaluation of assay methods and establishment of kit for superoxide dismutase activity[J].Anal Biochem,1984,142(2):290-296.
[13]Hafeman DG,Sunde RA,Hoekstra WG.Effect of dietary selenium on erythrocyte and liver glutathione peroxidase in the rat[J].J Nutr,1974,104(5):580-587.
[14]Placer ZA,Cushman LI,Johnsen BC.Estimation of product of lipid peroxidation,alindialdehyde in biochemical system[J].Anal Biochem,1966,16(2):359-364.
[15]Venkatraman M,Konga D,Peramaiyan R,et al.Reduction of mitochondrial oxidative damage and improved mitochondrial efficiency by administration of crocetin againstbenzo[a]pyrene induced experimental animals[J].Biol Pharm Bull,2008,31(9):1639-1645.
[16]文娜,钱之玉,饶淑云,等.西红花酸对大鼠心肌缺血再灌注损伤能量代谢的影响[J].中国新药杂志,2005,14(11):1294-1297.
[17]刘同征,钱之玉.西红花酸对异丙肾上腺素致大鼠急性心肌缺血损伤的保护作用[J].中草药,2003,34(5):439-442.
[18]施韵,盛亮,钱之玉,等.西红花酸对大鼠酒精性脂肪肝的改善作用及机制探讨[J].中国新药杂志,2008,17(24):2115-2118.
[19]盛亮,钱之玉,季晖.西红花酸改善大鼠高三酰甘油血症的作用机制[J].中国新药杂志,2008,17(21):1843-1847.
(本文编辑:曹志娟)
Studyofmechanismofactionforcrocetinonalcoholicfattyliverrats
WANGJianmin,LIWei,LIUJiang.
DepartmentofPharmacology,theFourthHospitalofHebeiMedicalUniversity,Hebei,Shijiazhuang050000
ObjectiveTo investigate the improving effect of crocetin in rats with alcoholic fatty liver,and to elucidate the possible mechanism.Methods30SD rats were randomly divided into three groups, health control group, model group and crocetin group.Rats in model group andcrocetin group were prepared alcoholic fatty liver model by feeding high lipid diet plus alcohol for10weeks.Rats in crocetin group
crocetin [50mg/ (kg·d)] by intragastric administration.Then,liver index,TG, FFA, rate of VLDL-secretion, activity of aniline hydroxylase (ANH),alcohol dehydrogenase (ADH), aldenhyde dehydrogenase (ALDH), SOD and MDA were measured.Alanine aminotransferase (ALT) activity and TG concentration in serum andpathological changes in liver were also observed.ResultsThe contents of ALT and TG inserum, TG and FFA content of liver and liver weight coefficient in model group and crocetingroup were higher than those in health control group (P<0.01,P<0.05).Those in crocetin group were lower than those in model group (P<0.01,P<0.05).Fatty acid mitochondria beta oxidation rate, the peroxisomal beta oxidation rate and VLDL-secretion rate in model group and crocetingroup were lower than those in healthy controls (P<0.01,P<0.05).Fatty acid mitochondria beta oxidation rate in crocetin group was higher than that in model group (P<0.05).Compared with those in health control group, ANH activity and MDA concentration were increased in model group (P<0.05).The activities of ADH, ALDH and SOD and GSH concentration were decreased (P<0.01).ANH activity and MDA concentration in crocetin group were decreased in comparison with those in model group (P<0.05).The activities of ADH, ALDH and SOD and GSH concentration were increased (P<0.05).ConclusionCrocetin can improve alcoholic fatty liver rats.This effect relates to the increase of liver mitochondrial fatty acid oxidation,reduction of fatty sediment,inhibition of lipid peroxidation,and acceleration of the elimination of alcohol and aldehyde.
Alcoholic fatty liver; Crocetin; Disease model; Animal; Experiment
王建敏(1972—),女,主管护师,学士。研究方向:药学。
R965.1;R975.5
A
1002-2619(2014)11-1703-04
2014-02-28)
