大肠癌外周血循环肿瘤细胞数的检测及临床意义
2014-08-24郝立群
王 成, 郝立群
(吉林省肿瘤医院 内四科, 吉林 长春, 130012)
手术或化疗治疗后,经病理学检查为阴性的大肠癌(CRC)患者通常会在若干年后再次复发,因为肿瘤细胞存在微转移-难以检测的循环肿瘤细胞(CTCs)进入血液,并形成新的病灶。CRC患者肿瘤细胞高表达两种肿瘤标志物,细胞角蛋白20(CK 20)[1]和癌胚抗原(CEA)[2]。进入外周血的CTCs也表达CK 20和CEA。CK20于1990年被发现,只局限性表达在胃肠上皮细胞,而在正常淋巴组织、血液组织、骨髓组织中不表达,在非上皮组织中检测到CK 20提示存在当有大肠癌细胞存在时。CK20是检测肠癌微转移的既特异又敏感的良好标志物。CEA是一种常用的大肠癌诊断标志物,但准确性只有50%左右。使用多重聚合酶链式反应(PCR)[3]结合荧光定量PCR(RTFQ PCR)方法检测血液中的CK20及CEA mRNA阳性表达率,旨在建立一种非侵袭性、高效的检测CRC微转移的方法。现将结果报告如下。
1 资料与方法
1.1 一般资料
选取吉林省肿瘤医院2011年11月—2013年11月收治的经病理检查确诊的大肠癌患者58例(CRC组),其中结肠癌20例,直肠癌38例。男32例,女26例;年龄41~67岁,中位年龄53岁; Ducke′s分期为: A期9例,B期16例,C期13例,D期20例。同时选取24例非恶性病变腹部手术患者作为对照。其中男14例,女10例;年龄44~75岁,中位年龄56岁。2组患者性别、年龄等一般资料无显著性差异(P>0.05), 具有可比性。
1.2 标本采集
所有患者于治疗前于上肢浅静脉取血,弃去注射器抽取的前5 mL血液以减少标本被皮肤细胞污染可能。常规肝素抗凝,淋巴细胞分离液分离单个核细胞,加入1 mL Trizol保存于-20 ℃。
1.3 主要试剂和仪器
Trizol Reagent RNA提取试剂盒(美国Invitrogen公司),SuperScript Ⅲ First-Strand Synthesis System cDNA合成试剂盒(M-MLV)、RNase抑制剂(美国Promega公司),焦炭酸二磷脂(DEPC)(美国Sigma公司), dNTP mixture(南京天为生物有限公司), 2×PCR Mix [0.1 U Taq Polymerase/μL, 500 μmol/L dNTP each, 20 mmol/L Tris-HCl (pH 8.3), 100 mmol/L KCl, 3 mmol/L MgCl2]、Oligo(dT)、DNase I (RNase-free)(美国Fermentas公司),ROX Reference Dye(美国罗氏公司),实时荧光定量PCR仪(美国ABI公司)。
1.4 总RNA提取鉴定及cDNA合成
严格按照RNA抽提试剂盒说明书操作提取总RNA,纯化后以DNA标准品为参照进行琼脂糖凝胶电泳鉴定提取产物,上样量3 μg。随后取RNA样品10 μL, Oligo(dT) 2 μL(混匀,70 ℃孵育5 min, 立即冰水浴,稍离心), 5×M-MLV Buffer 4 μL, 无核酸酶水2 μL, 2种dNTP mixture(10 mmol/L each) 共2 μL, RNase inhibitor 1 μL, 共21 μL。50 ℃孵育50 min, 然后85 ℃反应5 min, 立即置于冰上。离心收集产物。加入1 μL RNase抑制剂, 37 ℃孵育20 min。cDNA合成以后置于-20 ℃保存。
1.5 RTFQ PCR反应
1.5.1 引物:引物由宝生物工程(大连)有限公司合成。CK20引物上游序列5′-CAGACACACGGTGAACTATGG-3′, 下游5′-GATCAGCTTCCACTGTTAGACG-3′, 扩增长度为370 bp; CEA上游引物5′-TTATTGGCAGGTCAGGAGAAGAGCC-3′, 下游引物5′-CGCGACTTGATGTCCATGAGCCGCTGGTAC-3′, 扩增长度745bp; β-actin上游引物5′-TCATCACCATTGGCAATGAG-3′, 下游引物5′-CACTGTGTTGGCGTACAGGT-3′, 扩增长度154 bp。
1.5.2 反应体系:反应体系中加入SYBR Premix Ex Taq (2) 12.5 μL, 上下游引物(各10 μmol/L)混合液1 μL, Rox reference dye 0.5 μL,cDNA样品1 μL, 无菌水10 μL。聚合酶活化95 ℃ 30 s, PCR扩增95 ℃ 5 s/60 ℃ 30 s共40个循环。各RTFQ PCR产物做融解曲线分析。使用7300 system software v1.3.1,2-ΔΔCt法分析实验数据。根据产物的荧光扩增曲线计算外周血CTCs检出率。
1.6 观察指标
观察RTFQ PCR产物荧光扩增曲线。若无内参β-actin扩增曲线则判为实验失败,仅有1条β-actin扩增曲线则判为阴性。具有β-actin、CK20及CEA扩增曲线判为CTCs强阳性,仅有β-actin及CEA扩增曲线则判为弱阳性。CTCs阳性检出率=CK20+CEA mRNA阳性率=(强阳性+弱阳性)例数/总例数×100%。
2 结 果
2.1 总RNA鉴定
如图1所示,琼脂糖凝胶快速电泳显示所提取的总RNA具有清晰的28S、18S条带,这表明所提总RNA纯度高、无降解,质量能够满足实时荧光定量PCR实验要求。
图1 总RNA琼脂糖电泳图
2.2 各组CK20和CEA mRNA阳性率情况
PCR结果所示无1例PCR扩增失败。对照组外周血几乎未检测到2种蛋白的阳性表达。CRC组Ducke's A期、B期、C期、D期2种蛋白mRNA阳性率分别为11.1%(1/9)、62.5%(10/16)、76.9%(10/13)及100%(20/20),总阳性率为93.1%(54/58)。
2.3 CTCs阳性检出率与临床病理参数关系
CTCs阳性检出率与临床分期及远处转移有关(P<0.05), 但与分化程度无关(P>0.05)。见表1。
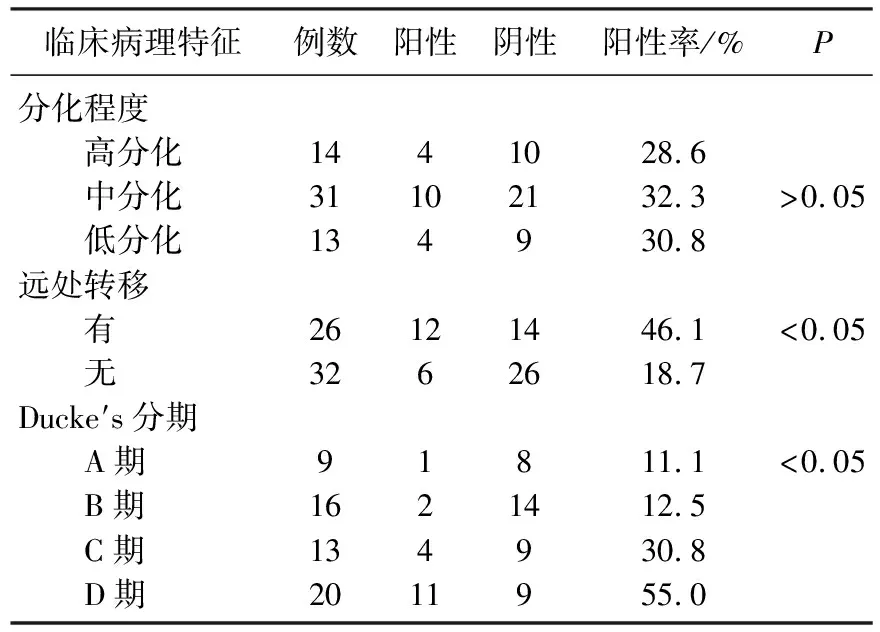
表1 外周血CTCs阳性检出率与CRC临床病理特征的关系
3 讨 论
近年来,CTCs检测作为一项独立的高危因素用于预测肿瘤患者复发转移的风险及预后,通过检测存在于外周血的微转移肿瘤细胞[4],提示风险的意义更大。而血液循环中肿瘤细胞数量极少,检测十分困难,形态学检查、流式细胞术或传统细胞遗传学检测方法敏感性太低,免疫化学技术容易产生假阳性结果[5]。RTFQ PCR是一种新定量实验技术,通过荧光标记的特异性探针检测目的基因表达而实现检测CTCs,荧光信号的累积与PCR产物形成同步,具有高度特异和敏感性,定量结果准确、稳定,产物污染的风险性低,多重RTFQ PCR联合监测多个肿瘤标志物目前正广泛用于瘤基因检测实现肿瘤病诊断[6]。研究证实RTFQ PCR法检测血液中大肠癌细胞的灵敏度为百万分之一,即106个血细胞中混入1~10个肿瘤细胞就可以检出[7]。
研究认为,临床转移一般由微转移发展而来,微转移的瘤细胞灶常以单个细胞或微小细胞团形成,通过淋巴系统、血液循环转移至其他组织器官。CRC患者早期常无明显症状,部分大肠癌患者确诊时已到晚期,多数患者最终死于局部复发或转移(淋巴结转移及远处转移),严重影响治疗效果和预后[8]。大肠癌外周血微转移发生率较高,即使在癌症早期,患者外周血循环癌细胞阳性率已达24%[9]。随着疾病的进展,CTCs检出率进一步升高,提示动态观察外周血中特异性高的CRC诊断标志物有助于判断疾病的恶性程度及预后。
细胞角蛋白20(CK 20)在组织分化、肿瘤分型、检测肿瘤转移中日渐受到重视[10]。CK是上皮细胞发生、分化、成熟过程中逐渐形成的,是所有哺乳动物细胞骨架中间丝之一。不同于CK 18、CK 19等,CK 20仅表达于CRC肿瘤细胞[11],而正常血细胞、骨髓细胞、胃肠道和泌尿道黏膜细胞、和淋巴细胞等均不表达。因此,应用RTFQ PCR检测外周血、淋巴结、骨髓中有无CK20的表达,可作为有效检测CTCs的指标。CEA mRNA是细胞恶变时有关肿瘤基因的转录产物,CEA常应用于胃肠道消化系统肿瘤的辅助诊断和疗效的动态监测[12]。约82%CRC及40%以上的乳腺等肿瘤细胞及几乎所有的上皮细胞包括上皮性肿瘤细胞,而在正常非上皮细胞中则不能检出,细胞之外不能存在游离的CEA mRNA。CEA虽然不是肿瘤特异性抗原,但CEA mRNA已成为分泌性肿瘤的标志基因,在外周血中,若能检测到CEA mRNA的表达,即可推断有表达CEA的肿瘤细胞已发生转移或易位。同时CEA mRNA可作为结直肠癌患者疗效的辅助检测[13]。
多重RT-PCR联合检测外周血CK20及CEA mRNA表达,可特异性检测出CRC治疗后阳性CTCs数,判断是否发生微转移及CRC患者预后[14]。本研究发现CRC患者外周血中CK20及CEA mRNA阳性表达显著高于对照组,这与秦海春[15]等、姜立新[10]等研究结果一致,提示CTCs存在。CK 20及CEA mRNA阳性表达率与Ducke′s分期及是否发生淋巴结转移有关,而与肿瘤细胞分化程度并不相关,提示Ducke′s分期高及发生淋巴结转移时,CTCs检出率高。结果初步提示多重PCR联合监测2种特异性CRC肿瘤标志物,有助于高效准确的监测大肠癌治疗的疗效以及判断预后。关于少量循环癌细胞与转移灶的形成或复发之间的关系是否明确,有待于加大样本,并进行长期随访研究。
[1] 叶欣, 李毅, 侯刚, 等. 大肠癌患者淋巴结细胞角蛋白-20 mRNA基因表达的临床意义[J]. 中华肿瘤杂志, 2002, 24(3): 261.
[2] 赵富锋. 大肠癌患者肿瘤标记物联合检测及其诊断价值[J]. 医学信息, 2011, 24(1): 9.
[3] Tsouma A, Aggeli C, Lembessis P, et al. Multiplex RT-PCR-based detections of CEA, CK20 and EGFR in colorectal cancer patients[J]. World J Gastroenterol, 2010, 16(47): 5965.
[4] Sonoda H, Tani T. Clinical significance of molecular diagnosis for gastric cancer lymph node micrometastasis[J]. World J Gastroenterol, 2014, 20(38): 13728.
[5] Cho W C. Emerging techniques in molecular detection of circulating tumor cells[J]. Expert Rev Mol Diagn, 2014, 14(2): 131.
[6] Vaiopoulos A G, Kostakis I D, Gkioka E, et al. Detection of circulating tumor cells in colorectal and gastric cancer using a multiplex PCR assay[J]. Anticancer Res, 2014, 34(6): 3083.
[7] Samija I, Lukac J, Mubrin M K, et al. Detection of cytokeratin-20-positive cells in preoperative and postoperative blood samples from colorectal cancer patients by real-time RT-PCR[J]. Int J Biol Markers, 2013, 28(2): 174.
[8] 黄毅捷, 袁建明. 结肠直肠癌淋巴结微转移及其I临床意义[J]. 外科理论与实践, 2009, 14(2): 245.
[9] Soster M, Juris R, Bonacchi S, et al. Targeted dual-color silica nanoparticles provide univocal identification of micrometastases in preclinical models of colorectal cancer[J]. Int J Nanomedicine, 2012, 7: 4797.
[10] 姜立新, 张翼飞, 郑海涛, 等. CK20检测散发性结直肠癌淋巴结微转移的临床意义[J]. 中华胃肠外科杂志, 2009, 12(6): 636.
[11] 马杰, 岳欣. 恶性肿瘤的微转移和细胞角蛋白检测的应用意义[J]. 中国综合临床, 2008, 24(1): 93.
[12] Nagayasu K, Komiyama H, Ishiyama S, et al. Investigation of free cancer cells in peripheral blood using CEA mRNA expression in perioperative colorectal cancer patients[J]. Mol Clin Oncol, 2013, 1(4): 668.
[13] Wallin U, Rothenberger D, Lowry A, et al. CEA-a predictor for pathologic complete response after neoadjuvant therapy for rectal cancer[J]. Dis Colon Rectum, 2013, 56(7): 859.
[14] Liu Y, Qian J, Feng J G, et al. Detection of circulating tumor cells in peripheral blood of colorectal cancer patients without distant organ metastases[J]. Cell Oncol (Dordr), 2013, 36(1): 43.
[15] 秦海春, 刘俊, 杜廷义, 等. 大肠癌手术前后外周血CEA蛋白、CEA mRNA的变化及临床意义[J]. 中国老年学杂志, 2012, 32(3): 499.
