siRNA沉默E2F1对膀胱癌T24恶性生物学行为的影响*
2014-08-24司马学琴宋铁山刘复兴宁志丰
武 倩,邱 敏,司马学琴,宋铁山,刘复兴,宁志丰
(1.湖北科技学院护理学院,湖北 咸宁437100;2.湖北科技学院基础医学院)
在人类,转录因子E2F1是由E2F1基因编码的一个蛋白,是E2F家族的一个成员。关于它在膀胱癌中的确切作用目前还不清楚。
1 材料与方法
1.1 实验材料
膀胱癌T24细胞购自武汉大学中国典型培养物保藏中心,RPMI1640培养基和胎牛血清为Gibco公司产品,双抗和胰酶购自武汉科瑞生物,转染试剂脂质体Lipofectamin 2000购自Invitrogen公司,E2F1一抗(兔抗)购自Santa Cruz公司,羊抗兔二抗购自武汉博士德公司,siRNA由上海吉玛制药公司合成。其它试剂为生化分析纯。
1.2 细胞培养
使用RPMI1640+10%FBS+100U/ml青霉素+100μg/ml链霉素在5%CO2、37℃、饱和湿度的环境中对T24予以培养,待细胞密度达80%~90%时予以传代。
1.3 siRNA干扰
采用本课题组以前报道过的方法[1]。将20μmol/L的siRNA 8μl稀释于250μl无血清RPMI1640,轻轻混匀,室温孵育5 min。转染前1d将细胞接种于6孔培养板,接种密度为1×105/孔,使得次日转染时细胞融合达60%~70%。实验分为对照组、siRNA-E2F1组,每组3个复孔,每个实验均重复3次。培养20~72h。
1.4 免疫印迹检测E2F1基因的沉默效果
RIPA裂解液抽提两群细胞的总蛋白,10%SDS-PAGE胶分离蛋白,转NC膜,一抗(稀释浓度为1∶1000),4℃过夜,二抗室温孵育30min,ECL发光液显影,将图片扫描后应用Gel Doc 2000 Gel Documentation System(Bio-Rad公司)成像,通过Quantity One成像分析软件进行半定量分析。强度以吸光度来表示。
1.5 MTT法检测转染前后T24存活能力的变化
将对照组和siRNA-E2F1转染组以每孔2000个细胞接种在96孔板上,200μl/孔,各6个复孔,培养1d后,连续观察7d,MTT法检测每孔的吸光值(OD值),绘制生长曲线。
1.6 平板克隆形成实验检测转染前后T24克隆形成能力的变化
将对照组和siRNA-E2F1转染组以每孔1000个细胞接种在6孔培养板上,各3个复孔,常规培养2周,镜下观察待大多数克隆长到大于50个细胞时终止培养,甲醇固定,0.1%结晶紫染液染色后计数克隆,100倍镜下大于50个细胞的为阳性克隆。克隆形成率(%)=阳性克隆数/种板细胞数×100%。
1.7 Transwell小室检测迁移和侵袭能力的变化
方法参考以前发表过的文献[2]。其中迁移实验在Transwell小室下室加入500μl不含FBS的1640培养基,上室中添加200μl含2×105/ml细胞并添加有完全培养基的细胞悬液。
侵袭实验除在小室上层膜上铺有100μl 1mg/ml的Matrigel外,其余步骤同迁移实验。
1.8 统计学分析
使用配对t检验来分析两群细胞之间的差异。P<0.05被认为有差异,数值大小以均值±标准差来表示,所有数据来自3个独立的实验。以Graphpad Prism 5.0软件统计并作图。
2 结 果
2.1 E2F1沉默效果的检测
使用siRNA在线设计工具siRNA Selection Program设计3对siRNA干扰序列,针对绿色荧光蛋白的干扰序列作为阴性对照序列(见表1),如图1所示,3#干扰序列的沉默效率可达90%左右,故选择siRNA-3#做进一步的实验。

表1 E2F1-siRNA干扰序列

图1 0:对照;1:siRNA1#;2:siRNA2#;3:siRNA3#
2.2 沉默E2F1前后T24生存能力的变化
siRNA沉默E2F1后T24的生存能力减弱(P=0.0385),见图2。

图2 沉默E2F1前后T24生存能力的变化
2.3 沉默E2F1前后T24克隆形成能力的变化
siRNA沉默E2F1后T24的克隆形成能力减弱(83.8±5.1 v.s39.6±8.1,P<0.0001),见图3。

图3 沉默E2F1前后T24克隆形成能力的变化
2.4 沉默E2F1前后T24迁移能力的变化
siRNA沉默E2F1后T24的迁移能力减弱(769.0±78.3 v.s.369.3±76.1,P=0.0015),见图4。
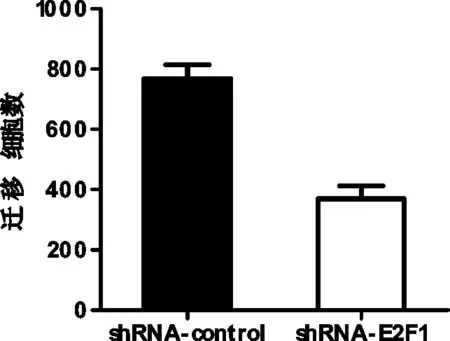
图4 沉默E2F1前后T24迁移能力的变化
2.5 沉默E2F1前后T24侵袭能力的变化
siRNA沉默E2F1后T24的侵袭能力减弱(216.3±34.3 v.s. 100.7±24.1,P=0.0028),见图5。
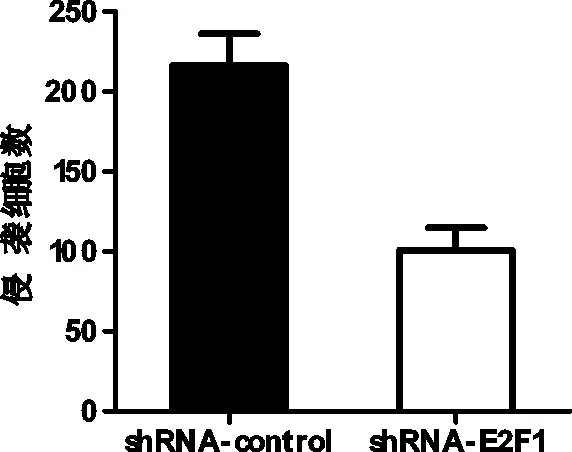
图5 沉默E2F1前后T24侵袭能力的变化
3 讨 论
转录因子E2F家族通过调节细胞周期和凋亡参与了许多细胞功能。对E2F家族的研究始于20世纪80年代中期,当时它们被确认为腺病毒E2启动子的转录激活物[3]。E2F家族的原型成员-E2F1在癌症中的作用直到20世纪90年代初才得到确认。研究人员发现通过E2F1类似物或通过与pRB相关蛋白(口袋蛋白)相互作用,E2F1能够结合并调节pRB蛋白[4]。通过离体研究,可以将E2F家族成员分为激活物和抑制物两类。前者在癌症中起促癌的作用,后者起抑癌的作用。但是在体研究提示E2F家族的功能非常复杂[5]。因此有必要对E2F家族在癌症中的作用开展深入研究。
E2F1在膀胱癌中的确切作用还未明确,对于是促癌还是抑癌存在争议。1999年美国纽约Memorial Sloan-Kettering Cancer Center的Rabbani等[6]使用聚合酶链反应-单链构象多态性(PCR-SSCP)分析和DNA测序发现133例膀胱癌中有7例存在第7外显子的393位密码子的核苷酸改变(GGC-->AGC [Gly-->Ser]),但是这些单核苷酸多态性并没有引起E2F1蛋白水平的改变,而且免疫组化提示E2F1较低的核染与增加的转移和死亡风险相关,提示E2F1在膀胱癌中起抑癌的作用。但是,2010年韩国Lee等[7]收集了165例膀胱癌组织样本的基因表达数据,使用统计学方法包括leave-one-out cross validation等证实E2F1及与其相关的基因能够作为预测浅表性膀胱癌向浸润性膀胱癌进展的标志物,并利用另外一组353例膀胱癌样本对该结论进行了验证,结果发表在著名期刊《Journal of Clinical Oncology》上。该研究提示E2F1在膀胱癌中起促癌的作用。国内刘卓等[8]发现E2F-1在膀胱癌组织中表达显著上调,提示E2F1在膀胱癌中可能起促癌作用。程坤等[9]运用免疫组化对122例膀胱肿瘤组织中E2F1蛋白的表达进行了研究,发现E2F1在膀胱癌组织中表达显著高于膀胱乳头状瘤,并随组织分化程度的降低而增高,提示E2F1可以作为诊断膀胱癌和判断恶性程度的一个标志物。
在本研究中,我们对E2F1在膀胱癌细胞株T24中的功能进行了分析,运用siRNA干扰E2F1后,膀胱癌T24的存活能力、克隆形成能力、迁移和侵袭能力均受到不同程度的抑制,提示E2F1对维持T24的恶性行为起一定的作用。我们的研究结果部分与Kim等[10]和Zhang等[11]相一致。前者发现E2F1在膀胱癌细胞株表达增高,但是没有做进一步的功能试验,后者发现抗糖尿病药物二甲双胍能够抑制膀胱癌T24的增殖,伴随着E2F1的下降,间接提示E2F1在T24中起促癌的功能。但是关于E2F1在膀胱癌中的促癌机制还有待进一步研究。
[1]宁志丰, 庞洪, 司马学琴, 等. siRNA 沉默 RIP1 对膀胱癌细胞株 T24 恶性生物学行为的影响[J]. 解剖学研究,2013,35:165
[2]宁志丰,庞洪,武倩,等. 结肠癌细胞株COLO201中癌干细胞样细胞的分离与鉴定[J]. 湖北科技学院学报(医学版),2013,27(1):1
[3]Kovesdi I, Reichel R, Nevins JR. Identification of a cellular transcription factor involved in E1A trans-activation[J]. Cell,1986,45:219
[4]Bandara LR, La Thangue NB. Adenovirus E1a prevents the retinoblastoma gene product from complexing with a cellular transcription factor[J]. Nature,1991,351:494
[5]Chen HZ, Tsai SY, Leone G. Emerging roles of E2Fs in cancer: an exit from cell cycle control[J]. Nat Rev Cancer,2009,9:785
[6]Rabbani F, Richon VM, Orlow I,et al. Prognostic significance of transcription factor E2F-1 in bladder cancer: genotypic and phenotypic characterization[J]. J Natl Cancer Inst,1999,91:874
[7]Lee JS, Leem SH, Lee SY, et al. Expression signature of E2F1 and its associated genes predict superficial to invasive progression of bladder tumors[J]. J Clin Oncol, 2010,28:2660
[8]刘卓, 杨为民, 陈志强, 等. E2F-1, E2F-3 在膀胱癌组织的表达及临床意义[J].临床泌尿外科杂志,2007,22:60
[9]程坤. 膀胱肿瘤组织中 Rb, E2F-1 及 P21 的表达及其意义[J]. 现代肿瘤医学,2010, 18:1588
[10]Kim DH, Roh YG, Lee HH, et al. The E2F1 oncogene transcriptionally regulates NELL2 in cancer cells[J]. DNA Cell Biol,2013,32:517
[11]Zhang T, Guo P, Zhang Y, et al. The antidiabetic drug metformin inhibits the proliferation of bladder cancer cells in vitro and in vivo[J]. Int J Mol Sci,2013, 14:24603
