化学-酶法合成胸苷的研究
2014-08-24,,,,
,, , ,
(浙江工业大学 药学院,浙江 杭州 310014)
核苷类药物在抗病毒、抗肿瘤方面具有显著疗效,目前使用的抗病毒药物中近50%属于核苷类药物[1],因此对核苷类原料药的需求量也越来越大.但原料药的生产往往会给环境造成较大的负担,所以采用低毒、少污染、高选择以及高效的合成方法将是核苷类药物研究的方向[2].
胸苷是核苷类药物齐多夫定和司他夫定合成的重要原料[3].目前,合成胸苷的方法主要有化学法、生物酶法、发酵法和天然产物提取法[4].其中,化学法合成胸苷是比较传统的方法,其主要缺点是糖苷键的形成缺乏立体专一性[2],且合成过程中,要多次对核糖基或碱基上的基团进行保护和脱保护,消耗大量的试剂,且存在一定毒性[5-6].与化学法相比,生物酶法具有专一性强,反应条件温和,对环境友好等优点,但存在周期长,产物不易分离的缺点.目前所报道的酶法合成核苷多数仍是以核苷为原料,加入目标核苷所对应的碱基,通过碱基交换反应生成目标核苷.但是以核苷为原料价格昂贵,尤其是脱氧核苷来源较少,成本更高.而且未反应完全的底物核苷与产物核苷由于结构相似,极性相差小,难以分离[7].化学-酶组合技术可以通过取长补短,克服化学法和酶法的不足,因此该技术已被不少研究者用于促进核苷的高效绿色生产[8-10].笔者以化学方法合成中间体2-脱氧-α-D-核糖-1-磷酸二环己胺盐,然后以其为底物,结合生物酶的催化作用合成胸苷.该方法能有效解决核苷合成过程中遇到的诸如原料来源缺乏、化学合成立体选择性差等问题,并减少有毒试剂的使用.
1 实验部分
1.1 菌种和试剂
大肠杆菌(Escherichiacoli(Migula) Castellani et chulmers)购自广东微生物菌种保藏中心,编号为ATCC8739.1-氯-2-脱氧-3’,5’-二-O-对氯苯甲酰基-D-核糖购自武汉嘉凯隆科技有限公司,纯度≥90%;胸腺嘧啶购自上海生工生物有限公司,纯度≥90%;其他试剂均为市售国产分析纯或化学纯.
1.2 合成路线设计
天然的核苷磷酸化酶不能识别β构型的核糖-1-磷酸,而只能识别α构型的核糖-1-磷酸并将其合成β核苷[11],因此首先参考文献方法[12-13],通过结晶诱导不对称转化的化学方法合成2-脱氧-α-D-核糖-1-磷酸二环己胺盐(化合物Ⅲ).2-脱氧-α-D-核糖-1-磷酸二环己胺盐的合成路线为

以上合成路线中所示字母分别表示:a为H3PO4/CH3CN;b为Bu3N;c为环己胺;d为CH3OH/环己胺;R为对氯苯甲酰基.化合物Ⅲ会在反应液中水解成2-脱氧-α-D-核糖-1-磷酸,即为生物酶催化合成胸苷过程中的重要中间体.因此可结合生物酶的催化作用,利用E.coli的全细胞作为酶源,在其胞内酶核苷磷酸化酶的作用下,进入生物酶催化反应过程,生成单一构型的β-胸苷.胸苷的生物酶转化过程分为两步,其路线为

1.3 中间体2-脱氧-α-D-核糖-1-磷酸二环己胺盐的制备
称取以上所得的化合物Ⅱ7.02 g,溶于110 mL甲醇,加入环己胺2.95 mL,40 ℃搅拌反应36 h,得到白色沉淀,过滤,滤饼用无水乙醇洗涤,25 ℃真空干燥得到白色固体,即化合物Ⅲ为3.5 g.经计算,收率为84.9%(按化合物Ⅱ计).测得其熔点为165~167 ℃(文献值为168~169 ℃).其红外光谱和核磁共振氢谱数据分别为IR(KBr,cm-1):2 940,2 870,1 091,937;1H NMR(500 MHz,D2O)δ:5.71~5.61(m,1H),4.11(ddt,J=8.9,7.3,3.6 Hz,2H),3.62(dd,J=12.2,3.6 Hz,1H),3.50(dd,J=12.2,5.3 Hz,1H),3.11~2.98(m,2H),2.30~2.20(m,1H),2.02~1.94(m,1H),1.88(t,J=10.1 Hz,4H),1.77~1.63(m,4H),1.56(dd,J=7.9,6.9 Hz,2H),1.31~1.15(m,8H),1.14~1.00(m,2H).
1.4 胸苷的生物酶催化合成
先挑取经过活化培养的大肠杆菌,接种于摇瓶种子培养基,于37 ℃,180 r/min培养16 h,然后以2%接种量接种于发酵培养基,于37 ℃,180 r/min培养24 h.培养液7 000 r/min离心10 min,去上清液,所得湿菌体于4 ℃冰箱保存备用.种子和发酵培养基组成为:蛋白胨10 g/L,酵母浸出粉5 g/L,NaCl 10 g/L,pH 7,121 ℃高压蒸汽灭菌30 min.
在反应体系中加入20 mmol/L化合物Ⅲ,20 mmol/L胸腺嘧啶,10 mL的30 mmol/L PBS缓冲液(pH 7)和100 g/L的湿菌体作为酶源,于60 ℃,150 r/min的水浴振荡器中恒温振荡反应6 h后取出,10 000 r/min离心10 min,取上清液稀释20~50倍后用HPLC法分析,所用色谱柱型号为Agilent Eclipse XDB-C18,5 μm(4.6 mm×150 mm),流动相为V(水)∶V(甲醇)=90∶10,流速为1.0 mL/min,波长260 nm,进样20 μL,室温检测.产物中胸苷的浓度采用外标法计算.
转化率的计算公式为
1.5 产物胸苷的分离
将生物催化得到的反应液置于4 ℃冰箱2~5 d,过滤,弃去滤渣,加入适量活性炭脱色,过滤得到透明液体,于60 ℃减压蒸干,得到微黄色固体粉末.然后用硅胶柱进行分离,采用湿法装柱,干法上样1 g,选用洗脱剂为V(甲醇)∶V(二氯甲烷)=1∶15,进行等度洗脱,合并胸苷部分,得到白色晶体样品0.12 g.
2 结果与讨论
2.1 化学法合成中间体2-脱氧-α-D-核糖-1-磷酸二环己胺盐
先以1-氯-2-脱氧-3’,5’-二-O-对氯苯甲酰基-D-核糖为原料,与磷酸在乙腈溶剂中反应形成α/β混合构型的核糖-1-磷酸中间体,接着用结晶诱导不对称转化技术合成α构型的2-脱氧-核糖-1-磷酸三丁基胺结合物,再加入环己胺,使性质不稳定的三丁基胺结合物以环己胺盐的形式析出,得到化合物Ⅱ,经HPLC测得其α与β构型的摩尔比为96.8∶3.2.然后,在碱性条件下,脱去化合物Ⅱ3’和5’位上的对氯苯甲酰基,得到化合物Ⅲ.
经红外光谱和核磁共振氢谱数据分析,化合物Ⅱ和化合物Ⅲ的图谱数据均与文献相符,表明最终所得化合物Ⅲ与目标产物一致,即为2-脱氧-α-D-核糖-1-磷酸二环己胺盐.经计算2-脱氧-α-D-核糖-1-磷酸二环己胺盐的收率为84.9%,经HPLC测定其纯度为94.7%.用结晶诱导不对称转化的化学技术能够使混合构型的2-脱氧-核糖-1-磷酸向目标构型转化,使α构型占绝对优势,合成的产物纯度较高,且对原料的构型没有严格要求,可以是α/β混合,降低了原料的成本.
2.2 生物酶催化合成胸苷的转化条件优化
2.2.1 底物浓度、菌体浓度对胸苷合成转化率的影响
由于化合物Ⅲ相对价格要高,因此采用先固定化合物Ⅲ浓度20 mmol/L不变,通过改变胸腺嘧啶的浓度,以确定化合物Ⅲ和胸腺嘧啶的最佳比例.然后在最佳比例下,最终确定底物浓度.由图1可知:当底物胸腺嘧啶与化合物Ⅲ的比例为4时最佳,继续增加比例,转化率的提高不明显,当比例大于6时,反而有下降趋势,这可能是胸腺嘧啶过量造成了底物抑制作用.
由图2可知:当化合物Ⅲ浓度为80 mmol/L,即胸腺嘧啶浓度为320 mmol/L时,胸苷的转化率最高,达到45.6%,继续增加底物浓度,转化率有所下降.若考虑生产效率,还可适当增加底物浓度,但是若底物浓度太大,由于底物在反应体系中的溶解度有限,尤其是胸腺嘧啶碱基的溶解度较低,利用率会降低.因此若能选择一种合适的溶剂,增加底物的溶解度,就能增加底物利用率,提高生产力.
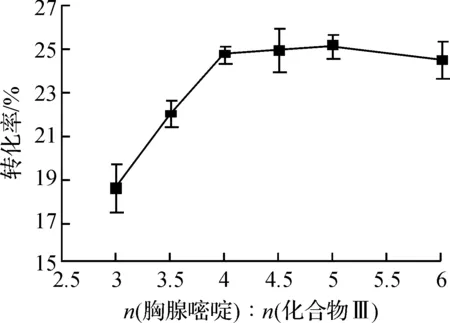
图1 底物比例对胸苷合成转化率的影响
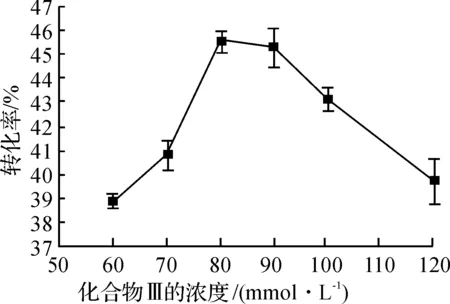
图2 化合物Ⅲ浓度对胸苷合成转化率的影响
在相同的底物浓度下考察湿菌体质量浓度从40~120 g/L对转化率的影响,由图3可知:当菌体量为80 g/L时,转化率已经达到最大,继续增大菌体浓度,转化率没有明显变化.

图3 菌体浓度对胸苷合成转化率的影响
2.2.2 缓冲液pH值、反应温度和反应时间对胸苷合成转化率的影响
在不同的pH条件下,加入80 g/L的菌体、80 mmol/L化合物Ⅲ和320 mmol/L胸腺嘧啶,于60 ℃下反应6 h,取样分析发现(图4),缓冲液pH值为8左右时,转化率最高,达到50.7%.这一方面与核苷磷酸化酶的最适pH为碱性有关,另一方面还可能因为胸腺嘧啶在碱性条件下溶解度增大而促进了反应的进行.

图4 缓冲液pH值对胸苷合成转化率的影响
在以上最佳底物浓度、菌体浓度和pH条件下,考察不同反应温度下胸苷的转化情况,由图5可知:在55 ℃时,转化率最高达到57.3%,而且转化率随温度变化幅度较大,高于或低于55 ℃时,转化率下降较明显.

图5 反应温度对胸苷合成转化率的影响
最后考察反应时间对转化率的影响.由图6可知:反应1 h转化率就已达40%以上,4 h时转化率达到50%以上,反应已经趋于平衡.由此可见酶催化的高效性,笔者选取反应时间为4 h.

图6 反应时间对胸苷合成转化率的影
2.2.3 生物酶催化合成胸苷转化条件的正交实验
根据2.2.1和2.2.2的单因素实验结果,设计四因素三水平的正交试验,其中底物比例n(胸腺嘧啶)∶n(化合物Ⅲ)确定为4,反应时间为4 h.正交实验结果如表1所示.
由表1得到正交实验后最佳因素组合:化合物Ⅲ浓度为100 mmol/L,则胸腺嘧啶浓度为400 mmol/L;菌体质量浓度80 g/L;缓冲液pH 8;反应温度55 ℃.其中,反应温度对转化率影响最大,底物浓度次之.以该组合做进一步验证,实验结果显示:当化合物Ⅲ浓度100 mmol/L,胸腺嘧啶浓度为400 mmol/L,菌体质量浓度80 g/L,缓冲液pH 8,反应温度55 ℃时,反应4 h,转化率为61.8%.

表1 胸苷的生物酶转化过程正交实验结果
2.3 产物胸苷的分离与鉴定
通过硅胶柱分离,得到胸苷产品纯度可达95.3%,计算收率为49.7%(按转化的胸苷计).测得其熔点为184~186 ℃(文献值为186~187 ℃).其红外光谱和核磁共振氢谱数据分别为IR(KBr,cm-1):3 313,1 706,1 477,1 274,1 066,904,628,470;1H NMR(500 MHz,MeOD)δ:7.83(d,J=1.0 Hz,1H),6.30(t,J=6.8 Hz,1H),4.41(dt,J=6.6,3.5 Hz,1H),3.92(q,J=3.4 Hz,1H),3.78(ddd,J=34.1,12.0,3.4 Hz,2H),2.33~2.16(m,2H),1.90(d,J=0.9 Hz,3H).经核磁共振氢谱和红外光谱数据分析,其图谱信息与目标产物一致,因此所合成的产物即为胸苷.
3 结 论
首先以化学方法合成的中间体2-脱氧-α-D-核糖-1-磷酸作为底物,解决了以核苷为原料来源少、成本高的问题,并且降低了以往以核苷为底物,产物核苷与底物核苷极性相似所造成的分离难度.该方法合成的核苷易分离,初步通过硅胶柱分离得到胸苷产品,其收率为49.7%,纯度为95.3%.然后结合生物酶催化的方法,以微生物全细胞作为酶源,利用其胞内酶核苷磷酸化酶的催化作用,简便、高效及高选择性地合成了单一构型的胸苷,克服了化学法缺乏立体专一性的缺陷,并减少了有毒试剂的使用.此外,通过优化得到最佳生物酶催化反应条件,转化率达到61.8%.该方法还可用于其他脱氧核苷的合成,对促进核苷的研究具有积极意义.
参考文献:
[1] 张绍谭,倪孟祥,阮期平.核苷类药物的酶法合成[J].药学进展,2005,29(2):56-61.
[2] 彭美红,钱捷,王鸿,等.核苷立体选择性合成研究进展[J].化学与生物工程,2011,28(6):12-15.
[3] 赵大同.胸苷的立体选择性合成[J].中国现代应用药学杂志,1998,8(15):23-24.
[4] 邱蔚然,沈荣坤.应用大肠杆菌的核苷磷酸化酶合成胸苷[J].华东理工大学学报,1996,22(6):701-705.
[5] BILLARD L, BENHADDOU R, GRANET R, et al. A novel route toβ-thymidine[J]. Organic and Organometallic Synthesis,1997,325(11):659-662.
[6] 周长林,邱蔚然,周利,等.用大肠杆菌游离细胞酶法合成核苷药物[J].华东理工大学学报,1997,23(5):535-539.
[7] 姜立春,古静燕,彭正松,等.一种快速、高效分离微生物转化产物5-氟尿苷的方法[J].天然产物研究与开发,2007,19(4):131-134.
[8] 辛自豪,丁庆豹,欧伶,等.化学酶法合成抗病毒药物2’,3’-双脱氧腺苷[J].药物生物技术,2007,14(4):268-272.
[9] GREGORY E R, MOIRA L, DANIEL F, et al. Integrated chemo-enzymatic route for preparation ofβ-thymidine, a key intermediate in the preparation of antiretrovirals[J]. Organic Process Research & Development,2011,15:258-265.
[10] KOMATSU H, AWANO H. Chemo-enzymatic synthesis of 2’, 3’-dideoxy-3’-fluoro-β-D-guanosine via 2,3-dideoxy-3-fluoro-α-D-ribose 1-phosphate[J]. Tetrahedron Letters,2003,44:2899-2901.
[11] KOMATSU H, IKEDA I. Synthesis of 2-deoxy-β-D-ribose-1-phosphate, NMR comparison and its enzymatic activity for structural elucidation of syntheticα-isomer[J]. Nucleosides, Nucleotides & Nucleic Acids,2003,22:1685-1686.
[12] 翁建全,高宗锦,徐勃,等.R-(+)-2-(4-羟基苯氧基)丙酸的不对称合成[J].浙江工业大学学报,2009,37(4):362-365.
[13] KOMATSU H, AWANO H. First stereoselective synthesis of 2-deoxy-α-D-ribosyl-1-phosphate: novel application of crystallization-induced asymmetric transformation[J]. Journal of Organic Chemistry,2002,67(15):5419-5421.
