直接进样杆在线衍生GC-MS测定阿司匹林中的水杨酸
2014-08-24,,2,,,
, ,2, ,,
(1.浙江工业大学 化学工程与材料学院,浙江 杭州 310032;2.浙江省化工研究院,浙江 杭州 310023)
水杨酸(邻羟基苯甲酸)是医药、香料、染料、橡胶助剂、光稳定剂[1]等精细化学品的重要原料,同时也是植物体内普遍存在的一种植物激素,被广泛应用于外源胁迫和刺激等逆境生理的研究[2].阿司匹林(乙酰水杨酸)是水杨酸类非甾体抗炎药,是常用的解热、消炎镇痛药.在临床上有治疗风湿痛,抑制血小板集聚[3]的功效.大量食用会引起呕吐、腹痛、频促、酸中毒等症状,严重地影响了人们的身体健康[4].因此,研究测定阿司匹林药物中水杨酸的含量具有实际意义.近年来报道水杨酸的测定方法主要有:分光光度法[5-6]、气质联用法[7]、高效液相色谱法[8-13]、液质联用法[14]、离子色谱法[15-16]等.
对于药物这种成分复杂的样品,高效液相色谱法经常出现干扰,需要利用气相色谱-质谱联用仪进行测定.对于气相色谱来说,一般选用弱极性或中等极性色谱柱.由于水杨酸属于极性较强的化合物.因此,需要进行衍生化处理[17-18],其中,使用四丁基硫酸氢铵作为衍生试剂较为普遍.Kruegert等[19]采用GC-FID测定液体洗涤剂和污水中的链状苯磺酸盐(LAS),经C18固相萃取柱净化后用0.005 mol/L四丁基硫酸氢铵将LAS衍生成其丁基酯.Liu等[20]采用分散液液微萃取(DLLME)离子对在线衍生联用GC-MS/MS测定水样中的全氟羧酸(PFCAs),采用四丁基硫酸氢铵在GC进样口中将PFCAs衍生为其丁基酯,在负化学电离源下进行MS/MS分析.Xu等[21]采用离子对液液萃取结合进样口衍生GC-MS测定非甾体类抗炎药(NSAIDs),用四丁基硫酸氢铵将待测物转变成其羧酸酯离子络合物,并用乙酸乙酯超声辅助萃取离子对衍生物.直接进样杆技术(Direct sample introduction,DSI)是1997年以色列学者Amirav等[22]首次报道的一种新型的气相色谱进样技术,此技术将样品前处理减至最少,甚至无需样品净化即可获得准确的定性和定量结果,适合于分析复杂基质样品.同时采用进样口在线衍生[23-28]可提高检测灵敏度.本实验提出了一种新的丁基酯衍生化前处理方法,通过引进离子对试剂四丁基硫酸氢铵(TBAHS),在气相色谱进样口高温下得到衍生产物水杨酸丁酯,用来测定阿司匹林泡腾片中的游离水杨酸.
1 实验部分
1.1 仪器与试剂
气相色谱-质谱(GC-MS)联用仪(CP3800-Saturn2000),配有1079进样口和直接进样杆(ChromatoProbe)装置(图1),美国Varian公司制造;KQ-50E型超声波清洗器,昆山市超声仪器有限公司;分析天平,规格Max210g,d=0.1 mg,北京赛多利斯仪器系统有限公司;磁力搅拌器,美国Corning公司;TGL-16C离心机,上海安亭科学仪器厂;甲醇,分析纯,上海凌峰化学试剂有限公司;乙腈,特级色谱纯,天津四友精细化学品有限公司;无水硫酸钠,分析纯,上海试四赫维化工有限公司;冰醋酸,分析纯,杭州化学试剂厂;水杨酸,分析纯,上海化学试剂采购供应五联化工厂;离子对试剂:四丁基硫酸氢铵(TBAHS)(纯度为99.9%),四丁基溴化铵(TBABr)(纯度为99.9%),四丁基碘化铵(TBAI)(纯度为99.9%),美国Supelco公司;阿司匹林泡腾片,购自杭州九洲大药房.

图1 GC-MS分析中直接进样杆装置示意图
1.2 实验条件
1.2.1 色谱条件
色谱柱:J&W DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气(99.999%),流速为0.8 mL/min;1079进样口升温程序:起始温度90 ℃,保持1 min(分流比50:1),以200 ℃/min快速升温至280 ℃,保持2 min(不分流),之后进样口自动降温(分流比20∶1).柱温箱升温程序:起始柱温40 ℃,保持5 min,再以20 ℃/min升温至280 ℃,保持1 min(图2).

图2 分析过程中使用的升温程序
1.2.2 质谱条件
电离源为电子轰击(EI);EI电离能量为70 eV.离子阱温度为150 ℃,歧管温度为40 ℃,GC-MS传输线温度为280 ℃,质量扫描范围为45~200m/z,扫描速度为3 scans/s,灯丝电流10 μA,电子倍增器电压2 000 V.
1.3 实验步骤
准确称取一定量经粉碎后的待测样品粉末于40 mL顶空瓶中,加入10 mL含1%冰醋酸的乙腈溶剂,超声萃取10 min,加入200 μL浓度为0.5 mol/L的四丁基硫酸氢铵(TBAHS)离子对衍生试剂,放入磁子搅拌10 min,加入适量无水Na2SO4,混合均匀,静置,取2 μL至直接进样杆专用的微量样品瓶中进GC-MS分析.
2 结果与讨论
2.1 水杨酸与离子对试剂的衍生机理
水杨酸属于极性较强的酸性化合物,无论在非极性还是中等极性色谱柱上,其保留能力都很弱,色谱峰脱尾严重,响应较小,因此常规条件下难以进行分离测定.为了更好的对水杨酸进行测定,所以选用离子对试剂四丁基硫酸氢铵(TBAHS)与其反应,将其转化成易挥发的水杨酸丁酯,反应式为
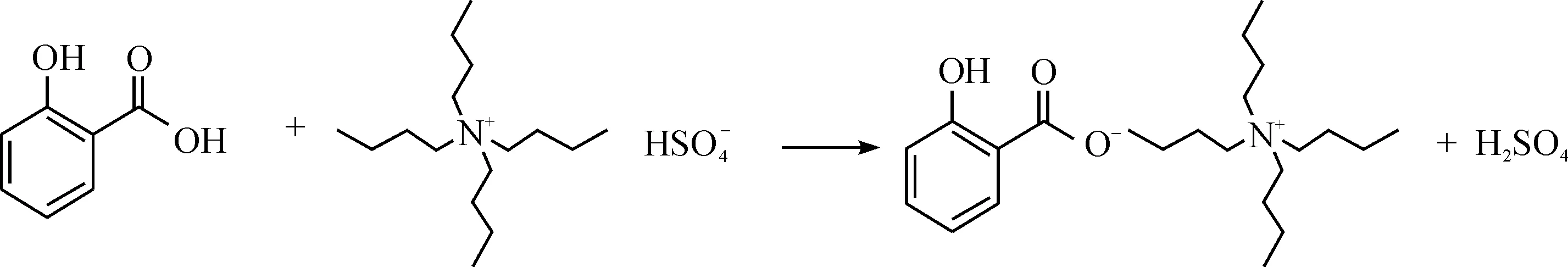
常温下,水杨酸与离子对试剂四丁基硫酸氢铵(TBAHS)反应生成络合物,且离子对试剂大大过量(摩尔比约1∶100).水杨酸与TBAHS反应生成的络合物在气相色谱进样口的高温作用下受热分解,生成易挥发的水杨酸丁酯,反应式为
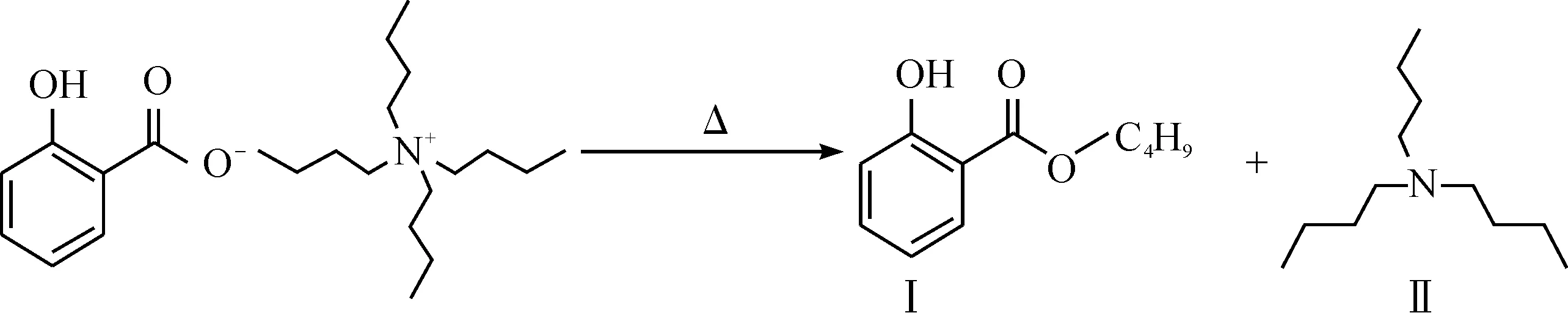
因此,采用气相色谱-质谱联用仪就可以进行水杨酸的定性和定量分析检测.
2.2 衍生产物的定性分析
经过离子对衍生处理后,水杨酸会衍生成为水杨酸丁酯,由于水杨酸衍生后极性减弱,沸点降低,信号响应较高.按照实验步骤,以水杨酸标准溶液与离子对试剂TBAHS形成的离子对络合物,在气相色谱进样口受热生成的水杨酸丁酯,在离子阱质谱EI全扫描条件下得出的总离子流图(TIC)如图3所示.
出峰时间为13.15 min所对应的质谱图如图4所示.

图3 水杨酸丁酯总离子流图
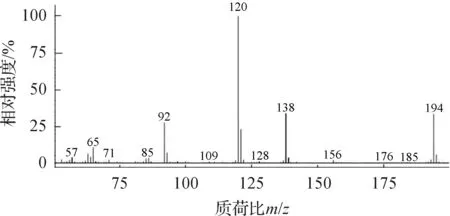
图4 水杨酸丁酯的质谱图
根据气相色谱程序升温条件和水杨酸丁酯的物理性质,在质谱全扫描模式下,由质谱碎片图(图4)可知:该化合物的主要的质谱碎片峰如下:m/z=194为水杨酸丁酯的分子离子峰;m/z=138[M-C4H9]碎片,为分子失去丁基后的离子碎片;m/z=120[M-C4H9-H2O]碎片,为失去羧基上的羟基连带一个氢质子后的碎片;m/z=92[M-C4H9-COOH]碎片,为在失去羧基上的羟基后再失去羰基后的碎片.结合NIST库中水杨酸丁酯的质谱图,以及水杨酸丁酯碎片的裂解方式,可以确定13.15 min峰处的化合物为水杨酸丁酯.
2.3 进样口分解温度的选择
进样口分解温度是影响衍生化效率的重要因素之一,分解温度对络合物分解反应的影响至关重要,温度过低,分解反应不完全.选择在200,250,280,290,300 ℃五个温度下进行实验(图5).结果表明:在280 ℃时衍生物色谱峰强度达到最高,能够得到最大峰面积.因此,选择280 ℃作为进样口分解温度.

图5 进样口衍生温度对水杨酸丁基衍生化的影响
2.4 进样口停留时间的选择
离子对络合物在进样口分解生成水杨酸丁酯的过程需要一定时间,因此,进样口停留时间也会对衍生化效率产生重要影响.本实验考察进样口停留时间分别为0.5,0.7,1.0,2.0和5.0 min时对衍生化效率的影响.由图6可知:停留时间对衍生效率有重要影响,当停留时间过短,离子对络合物还没有完全分解成为水杨酸丁酯,随着停留时间的增加,水杨酸丁酯的响应信号迅速升高,2 min后,水杨酸丁酯峰面积达到稳定,不再有增加趋势.因此,最终选择2 min为最优的进样口停留时间.

图6 进样口停留时间对水杨酸丁基衍生化的影响
2.5 离子对衍生试剂种类的选择
实验主要考察了四丁基硫酸氢铵(TBAHS),四丁基溴化铵(TBABr)和四丁基碘化铵(TBAI)3种离子对衍生化试剂对衍生效率的影响(图7).结果表明:3种衍生化试剂对衍生效果影响没有明显差别.考虑到四丁基硫酸氢铵(TBAHS)在文献报道中使用较多,应用广泛且相对成熟,因此,选择四丁基硫酸氢铵(TBAHS)作为衍生试剂进行后续实验.
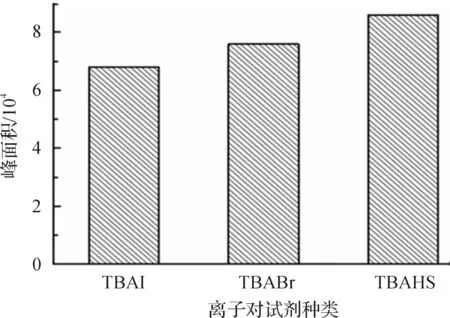
图7 离子对衍生试剂对衍生效率的影响
2.6 标准曲线和检出限
本实验采用质量浓度分别为1.0,5.0,10.0,20.0,30.0 μg/mL的水杨酸标准溶液,在上述优化的操作条件下以外标法来进行GC-MS定量分析,以被测物质峰面积Y和相对应的质量浓度X(μg/mL)作线性回归方程,平行测定3次,得出线性回归方程和相关系数Y=79 962X-422.49(r=0.997 8),分别以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)作为定性检出限和定量检出限,从表1中可看出:各组分在此浓度范围内具有良好的线性关系,相关系数均大于0.99,符合定量要求,峰面积相对标准偏差为5.45%,说明本方法具有良好的重现性.
2.7 方法的回收率实验
向已知不同质量浓度的样品中分别添加5.0和10.0 μg/mL的水杨酸标样,按1.3节的步骤进行处理,按照1.2方法进行气相色谱质谱检测,得到水杨酸的回收率和相对标准偏差(表2).

表1 方法的线性范围、线性关系、检出限

表2 样品加标回收率
2.8 实际样品的测定
取5.6 mg阿司匹林泡腾片实际样品按照1.3节的步骤进行超声提取制得待测样品溶液.准确移取2 μL待测样品溶液放入直接进样杆专用的微量样品瓶中,随直接进样杆进行气相色谱质谱检测.平行测定3次,取平均值,所测实际样品中水杨酸的含量结果见表3.结果显示:阿司匹林泡腾片中游离水杨酸含量测定结果(n=3)含量为2.70%,RSD为9.12%.

表3 阿司匹林泡腾片中游离水杨酸的测定结果
3 结 论
本方法采用直接进样杆在线衍生进样,样品不需要净化处理,而样品中不挥发或难挥发的杂质基质则会残留在直接进样杆专用的微量样品瓶中,不会污染色谱柱和质谱检测器.最佳的衍生条件为进样口衍生温度280 ℃,进样口停留时间2 min,离子对衍生试剂为四丁基硫酸氢铵(TBAHS).方法的定性检出限和定量检出限分别为0.09 μg/mL和0.28 μg/mL.结果表明:四丁基硫酸氢铵衍生试剂可以很好地将水杨酸衍生成为水杨酸丁酯,从而使其在仪器上的响应信号增大.该方法具有操作简单、准确性高、无需净化、适用范围广等优点,可应用于阿司匹林泡腾片中游离水杨酸的测定分析.
参考文献:
[1]李祖光,赵武利,赵晓涛,等.3,3′-亚甲基-双(6-羟基苯甲酸)的合成[J].浙江工业大学学报,2013,41(1):10-12.
[2]求红波,王丹,周示玉,等.外源水杨酸对重金属Pb毒害迷迭香挥发物释放的缓解效应[J].浙江工业大学学报,2012,40(3):270-274.
[3]王艳玲,王国海,李学明.HPLC法测定阿司匹林肠溶片的含量[J].西北药学杂志,2009,24(6):442-443.
[4]薛峰,林毅侃,马跃龙,等.品中水杨酸含量测定方法的研究进展[J].食品工业科技,2012,33(14):429-431.
[5]朱柳腾,吕翠盈,孙龙生,等.可见分光光度法测定阿司匹林中水杨酸含量的探究[J].山东化工,2009,38(10):38-41.
[6]李娟.紫外分光光度法测定ASP肠溶片中游离水杨酸含量[J].现代医药卫生,2010,26(15):2267-2268.
[7]SCOTTER M J, ROBERTS D P T, WILSON L A, et al. Free salicylic acid and acetyl salicylic acid content of foods using gas chromatography-mass spectrometry[J]. Food Chemistry,2007,105:273-279.
[8]陈少茹,吴怡,吴铁,等.HPLC测定复方水杨酸制剂中醋酸曲安奈德和水杨酸的含量[J].现代医药卫生,2011,27(23):3529-3532.
[9]石增强,魏顺尚.HPLC法测定阿司匹林肠溶片系列产品中游离水杨酸的含量[J].西北药学杂志,2010,25(4):255-256.
[10]李长福.HPLC法测定复方水杨酸擦剂中水杨酸和苯甲酸的含量[J].中国伤残医学,2011,19(3):37-39.
[11]曹玉华.HPLC法测定水杨酸滴耳液中水杨酸的含量[J].中国现代药物应用,2009,3(1):37-38.
[12]张玉玺,杨姣,刘春鹤,等.HPLC法测定杨硼洗剂中水杨酸和硼酸的含量[J].中国实用医药,2012,7(17):5-6.
[13]李飞玲.HPLC与UV测定阿司匹林肠溶片中阿司匹林和水杨酸的含量[J].长治医学院学报,2011,25(1):11-13.
[14]张瑞,陆舍铭,丁丽婷,等.超高效液相色谱-串联质谱法快速测定化妆品中水杨酸[J].理化检验,2011,47(1):65-67.
[15]董影杰,于泓,黄旭,等.离子液体作高效液相色谱流动相添加剂测定水杨酸[J].分析测试学报,2011,30(3):302-306.
[16]刘巧茹,石起增,董文举,等.高效离子色谱法测定水杨酸[J].分析科学学报,2006,22(3):357-358.
[17]王丽丽,贾以律,潘再法,等.热辅助下的在线甲基衍生化-气相色谱法分析银杏叶中的银杏酸[J].色谱,2008,26(6):731-735.
[18]王丽丽,周彦,贾以律,等.银杏叶化学成分的裂解甲基化气相色谱分析[J].浙江工业大学学报,2010,38(2):124-128.
[19]KRUEGERT C J, FIELD J A. In-Vial C18Empore disk elution coupled with injection port derivatization for the quantitative determination of linear alkylbenzenesulfonates by GC-FlD[J]. Analytical Chemistry,1995,67:3363-3366.
[20]LIU Wen-lin, KO Yen-chen, HWANG Bao-huey, et al. Determination of perfluorocarboxylic acids in water by ion-pair dispersive liquid-liquid microextraction and gas chromatography-tandem mass spectrometry with injection port derivatization[J]. Analytica Chimica Acta,2012,726:28-34.
[21]XU Li, JIANG Ming, LI Gao. Injection port derivatization following sonication-assisted ion-pair liquid-liquid extraction of nonsteroidal anti-inflammatory drugs[J]. Analytica Chimica Acta,2010,666:45-50.
[22]AMIRAV A, DAGAN S. A direct sample introduction device for mass spectrometry studies and gas chromatography mass spectrometry analyses[J]. European Journal of Mass Spectrometry,1997,3:105-111.
[23]TZING Shin-hwa, DING Wang-hsien. Determination of melamine and cyanuric acid in powdered milk using injection-port derivatization and gas chromatography-tandem mass spectrometry with furan chemical ionization[J]. Journal of Chromatography A,2010,1217:6267-6273.
[24]TZING Shin-hwa, GHULE A, LIU Jen-yu, et al. On-line derivatization gas chromatography with furan chemical ionization tandem mass spectrometry for screening of amphetamines in urine[J]. Journal of Chromatography A,2006,1137:76-83.
[25]LIN Wan-ching, CHEN Hsin-chang, DING Wang-hsien. Determination of pharmaceutical residues in waters by solid-phase extraction and large-volume on-line derivatization with gas chromatography-mass spectrometry[J]. Journal of Chromatography A,2005,1065:279-285.
[26]LIU Chi-hung, DING Wang-hsien. Determination of naphthalenesulfonic acid isomers by large-volume on-line derivatization and gas chromatography-mass spectrometry[J]. Journal of Chromatography A,2001,926:341-346.
[27]CHENG Chin-yuan, DING Wang-hsien. Determination of acidic degradation products of nonylphenol polyeth-oxylates by large-volume injection-port derivatization and gas chromatography/mass spectrometry[J]. Rapid Communications In Mass Spectrometry,2007,21:1687-1690.
[28]HSU Ching-lin, DING Wang-hsien. Determination of low-molecular-weight dicarboxylic acids in atmospheric aerosols by injection-port derivatization and gas chromatography-mass spectrometry[J]. Talanta,2009,80:1025-1028.
