射频消融治疗大鼠肝泡状棘球蚴病及病理改变
2014-08-21桑泽杰朱帝文纪卫政任伟新顾俊鹏张海潇
桑泽杰,朱帝文,纪卫政,任伟新,顾俊鹏,张海潇,温 浩
射频消融(radiofrequency ablation,RFA)是 20世纪90年代初发展的微创治疗肝肿瘤的方法,通过热能使肿瘤组织发生凝固性坏死。肝癌的RFA治疗效果与肿瘤大小相关,对于直径≤3 cm的小肝癌,其治疗效果可与外科手术媲美[1],近年来认为≤7 cm的病灶都可以经RFA完全消融。RFA具有适应证广泛、机体创伤小、手术安全性高的特点,有效性和适应证较宽、不良反应及并发症少,能最大限度地保护剩余肝功能,已广泛应用于肝癌的局部治疗[2]。肝泡状棘球蚴病(hepatic alveolar echinococcosis,HAE)是一种人兽共患寄生虫病,由多房棘球蚴绦虫感染所致,多为肝脏原发病灶,主要分布在我国西北部和西南部地区。该病发病率低,为0.3%~4.8%,某些牧区高达10%,是一种常见的地方病,新疆为该病高发区之一[3]。其生长方式类似肿瘤,呈浸润性生长,侵犯周围组织,同时可向远处转移,故又称“虫癌”[4]。确诊该病时大部分患者已失去根治性切除机会,手术切除率仅为20%~40%[5]。目前该病多为手术切除联合阿苯达唑治疗,研究表明在患者生存概率和并发症发生率方面姑息性手术联合药物组与单纯药物组无差异,且姑息性手术联合药物治疗患者的病情更容易恶化,甚至死亡[6]。本实验在直视下行RFA治疗HAE,探讨RFA治疗HAE的安全性和有效性,通过天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)评估肝功能受损程度,探讨RFA对残余病灶组织泡球蚴存活的影响,对早期微小和难治性HAE治疗提供新的选择。
1 材料与方法
1.1 实验动物
选择2月龄清洁级雄性Wistar大鼠 50只,体重(0.20±0.05)kg(新疆医科大学实验动物中心供给),大鼠饲养在清洁环境中。参照文献制作大鼠HAE的疾病模型[7]。并于接种6个月后用B超筛查HAE种植情况[8],选择无钙化型HAE模型动物。
1.2 实验方法
1.2.1 动物分组及处理 取30只病灶直径(0.75±0.25)cm的HAE模型大鼠,分成对照组(假手术组)10只和实验组20只。对照组开腹暴露HAE病灶后缝合;实验组大鼠麻醉后,背部脱毛、分离和暴露HAE病灶,直视下将射频电极插入肝脏病灶中心,调节功率为50 W,时间2 min。两组动物分别于术前及术后3、5、7 d剪尾取血,检测AST和ALT水平。第7天处死全部大鼠,取HAE组织标本,部分置于4%甲醛溶液中固定48 h,石蜡包埋,连续5 μm切片(每份标本5片)、脱蜡、染色后行病理检测,与肝功能测定结果一并进行综合分析。
1.2.2 HAE分级 根据泡球蚴的角质层、生发层在光镜下的病理形态学改变和育囊发育情况分为3级[9]。 0级(基本正常):泡状棘球蚴结构基本正常,多数见育囊或芽生结构,育囊内有数量不等的原头节,钙颗粒形态正常。Ⅰ级(变性改变):泡状棘球蚴结构存在,角质层和生发层可辨认,组织普遍变性肿胀,很少见育囊和原头节。Ⅱ级(坏死):泡状棘球蚴结构失常,生发层细胞核固缩、溶解或消失,育囊与原头节少见;偶见钙颗粒,形态模糊;重者有纤维组织增生和炎性细胞浸润。
1.3 统计学处理
采用SPSS17.0软件进行统计学分析。组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 RFA对肝功能的影响
实验组AST和ALT在术后第3天达最高值,分别为(193.89±9.31)u/L 和(60.07±2.68)u/L,与对照组相比差异有统计学意义(P<0.05);第5天AST和ALT值逐渐下降,分别为(169.04±7.76)u/L和(41.31±2.18)u/L,与对照组相比差异有统计学意义(P<0.05);第7天两者均恢复至正常水平,分别为(106.73±5.15)u/L 和(31.57±3.44)u/L,与对照组相比差异均无统计学意义(P>0.05)。
2.2 HAE模型大鼠的病理改变
实验组大鼠在实验过程中意外死亡1只。RFA术后7 d,实验组病理变化以Ⅱ级为主(17/19),光镜下角质层、生发层模糊,部分生发层细胞空泡变、核溶解;Ⅰ级2只,光镜下可见泡状棘球蚴结构失常,角质层、生发层普遍变性、分离或断裂、脱落,皮层变薄,部分结构被破坏(图1)。
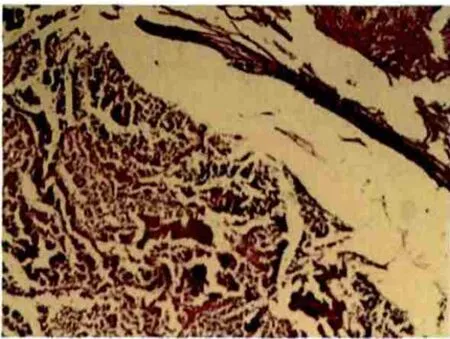
图1 实验组病理变化以Ⅱ级(坏死)为主(HE,×200)
2.3 组织病理学改变
肝HAE模型病灶呈浸润性生长,无包膜,泡球蚴病灶细胞呈巢片状或假腺样分布,排列较为紧密,局部紊乱,细胞体积大,形态不规则,胞质嗜双色性,核大小不一,深染,核染色质粗,核仁明显。消融治疗后,射频毁损区呈类球形。标本毁损区中央呈灰白色,周边水肿出血呈暗红色,与周围正常组织分界不清(图2)。

图2 RFA后中心区为大片不定形坏死组织;周边见炎性反应带,其内较多中性粒细胞、淋巴细胞及红细胞聚集;外围为残存的泡球蚴病灶及其边缘带组织(HE,×200)
3 讨论
RFA机制是射频电磁波震动引起离子相互摩擦产生热量;电极针局部组织传至病灶周围温度可达45~50℃,引起组织脱水及蛋白质变性;局部温度超过70℃时,导致蛋白质凝固性坏死[10-11]。但是,局部温度超过100℃时,电极针周围病灶组织出现炭化与气化,此现象阻碍了热量传导。Valley公司的冷循环电极通过热传导系统带走热量,保持射频电极局部病灶周围的相对低温,减少或避免消融病灶局部组织的气化和炭化,同时可保证或扩大消融灶的范围[10,12-13]。 同时,病灶周边的微血管及组织凝固,使之不能继续向病灶供血,不仅促进残存病灶死亡还有利于防止病灶转移[14]。一直以来,手术切除是HAE仅有的治疗方法[15]。而对早期的小病灶HAE,手术治疗尚有争议,主要以姑息性药物阿苯达唑治疗,但由于该药溶解性较低,且在体内广泛分布,极大地减低了其生物利用度。近年以RFA为代表的局部治疗为肝脏等实性占位病变治疗提供了新的选择。而RFA的出现大大提高了局部治疗的疗效,有文献报道RFA治疗肝囊性包虫病的离体动物实验显示,RFA 具有良好的效果[16]。 Thanos 等[17]报道术后联合RFA治疗1例复杂肝包虫囊肿取得满意疗效。
RFA治疗HAE仅有个案报道,尚无大量有对照的研究。本实验RFA后HAE病灶完全坏死率与文献报道相似[18-19],RFA灶周边为炎性反应,细胞间通透性增大,可见大量红细胞渗出,炎性细胞聚集。术后肝功能检测表明,RFA治疗HAE安全,疗效肯定,有强大的促进组织坏死作用。RFA治疗HAE有一定优势,实验中部分HAE消融模型建立在HAE移植瘤基础上,对动物肝脏损伤很小,相应的动物耐受力则很强。我们在大鼠肝脏上同时观察RFA后残余病灶和RFA治疗后局部致热性损伤引起的良性炎症反应,模拟人原发性HAE的RFA后残余病灶,提供了仿真的临床研究模型,比较适用于原发性HAE的RFA后的病理学研究及疗效判定等相关研究。
本实验定制的灌注型RFA电极借助微量水泵将冷生理盐水泵入消融病灶组织内部,通过此方式既降低病灶组织周围区域温度,减少或避免炭化和气化的发生,又增加消融病灶组织内的离子数目,增强了离子震动及热传导,在不增加功率的情况下扩大病灶消融范围[10,12-13]。
RFA治疗因创伤小、并发症少、疗效确切等优点,已成为最有前景的热凝固消融方式。RFA治疗HAE的目的在于原位灭活泡状棘球蚴,最小限度地损伤正常肝组织;假手术组AST和ALT水平无明显变化,而实验组行RFA后第3天AST和ALT水平明显升高,第5天仍较正常稍高,可能为RFA引起病灶局部微血管及组织凝固,局部有效血流绝对灌注较少,导致病灶局部细胞缺血缺氧,高能磷酸化合物如ATP减少,Na+-K+-ATP泵的酶活性下降,Ca2+跨膜内流增加,引起ATP分解活跃,为自由基的生成提供底物。同时,内流的Ca2+还可激活蛋白酶,催化次氧嘌呤的氧化反应,最终生物膜脂质氧化损伤。但在第7天,实验组AST和ALT趋于正常,表明RFA虽对大鼠肝功能有一定的损伤,但仍可恢复。
实验组大鼠病灶经RFA后损伤主要以坏死为主(Ⅱ级),但仍有少数Ⅰ级病变,可能与泡球蚴病灶约0.8 cm有关,血供主要来自于门静脉[20-22],RFA治疗时由门静脉带走较多热量,消融不完全。此外,特殊部位如膈顶、心脏、靠近肠道等部位,也是消融不完全的原因[23-25]。本研究结果提示,开腹直视下RFA在治疗大鼠HAE方面有较大的应用潜力,短期内病灶液化坏死明显,HAE完全灭活,我们认为RFA在治疗HAE中可能有重要作用,对于治疗微小及难治性HAE,可能是一种选择,可望为临床治疗HAE提供新的治疗方法。
本实验通过制作大鼠HAE RFA治疗模型,初步观察RFA后短期内病灶的病理学改变及肝功能损害,揭示RFA后残余病灶的生物学活性改变,为进一步RFA治疗早期HAE小病灶及其临床应用提供理论依据。RFA治疗后大鼠泡球蚴病灶周边微血管的改变、远期复发转移及再次治疗等问题有待于进一步的研究。
[1]N’Kontchou G,Mahamoudi A,Aout M,et al.Radiofrequency ablation of hepatocellular carcinoma:long-term results and prognostic factors in 235 Western patients with cirrhosis [J].Hepatology,2009,50: 1475-1483.
[2]Kim JW,Shin SS,Kim JK et al.Radiofrequency Ablation combined with trans-catheter arterial chemoembolization for the treatment of single hepatocellular carcinoma of 2 to 5 cm in diameter: comparison with surgical resection [J].Korean J Radiol,2013,14: 626-35.
[3]王成伟,张 林.肝脏泡状棘球蚴病的CT MRI表现[J].中国现代医学杂志,2007,20:2536-2538.
[4]Ammann RW,Hirsbrunner R,Cotting J,et al.Recurrence rate after discontinuation of long-term mebendazole therapy in alveolar echinococcosis(preliminary results)[J].Am J Trop Med Hyg,1990,43: 506-515.
[5]Polat KY,Balik AA,Celebi F.Hepatic alveolar echinococcosis:clinical report from an endemic region [J].Can J Surg,2002,45:415-419.
[6]阿依甫汗·阿汗,张日新,张金辉,等.姑息性手术加药物和单纯性药物治疗肝泡状棘球蚴病的循证医学效果评价[J].中国现代医学杂志,2011,21:1868-1872.
[7]张金辉,温 浩,刘章锁,等.原发性肝泡球蚴动物模型的建立[J].中国局解手术学杂志,2000: 11-13.
[8]朱帝文,任伟新,顾俊鹏,等.超声在筛检大鼠肝泡状棘球蚴病模型中的应用价值[J].中国医学影像技术,2009,25:363-365.
[9]陆永绥,李清华,张伟明.临床检验自动化分析仪器标准化操作规程[M].杭州:浙江大学出版社,2006:9-15.
[10]Ni Y,Mulier S,Miao Y,et al.A review of the general aspects of radiofrequency ablation[J].Abdom Imaging,2005,30: 381-400.
[11]Dupuy DE,Goldberg SN.Image-guided radiofrequency tumor ablation: challenges and opportunities-partⅡ[J].J Vasc Interv Radiol,2001,12: 1135-1148.
[12]Mulier S,Ni Y,Miao Y,et al.Size and geometry of hepatic radiofrequency lesions [J].Eur J Surg Oncol,2003,29: 867-878.
[13]Lee JM,Han JK,Kim SH,et al.Bipolar radiofrequency ablation in ex vivo bovine liver with the open-perfused system versus the cooled-wet system[J].Eur Radiol,2005,15: 759-764.
[14]郭俊渊.现代腹部影像诊断学[M].北京:科学出版社,2001:611.
[15]Ammann RW.Improvement of liver resectional therapy by adjuvant chemotherapy in alveolar hydatid disease [J].Swiss Echinococcosis Study Group(SESG).Parasitol Res,1991,77:290-293.
[16]Lamonaca V,Virga A,Minervini MI,et al.Cystic echinococcosis of the liver and lung treated by radiofrequency thermal ablation:an ex-vivo pilot experimental study in animal models [J].World J Gastroenterol,2009,15: 3232-3239.
[17]Thanos L,Mylona S,Brontzakis P,et al.A complicated postsurgical echinococcosis cyst treated with radiofrequency ablation[J].Cardiovasc Intervent Radiol,2008,31: 215-218.
[18]封 云,佟小强,杨 敏,等.正常动物肝脏的射频消融实验[J].中国介入影像与治疗学,2005,2: 211-214.
[19]Morimoto M,Sugimori K,Shirato K,et al.Treatment of hepatocellular carcinoma with radiofrequency ablation:radiologichistologic correlation during follow-up periods [J].Hepatology,2002,35:1467-1475.
[20]任伟新,肖湘生.肝泡状棘球蚴病门脉血供的实验研究[J].中国介入影像与治疗学,2007,4:142-147.
[21]樊玉祥,任伟新,迪理木拉提·巴吾冬,等.DSA评价大鼠肝泡状棘球蚴病血供 [J].中国介入影像与治疗学,2012,09:37-40.
[22]朱帝文,穆 民,任伟新,等.经门静脉药物灌注化疗栓塞治疗大鼠肝泡状棘球蚴病的电镜观察 [J].介入放射学杂志,2013,22: 614-627.
[23]潘 杰,陈绍辉,卢 欣,等.全麻下CT引导下经穿刺射频消融治疗肝内特殊部位的恶性肿瘤 [J].介入放射学杂志,2010,06: 478-481.
[24]彭国文,李晓群.射频消融及组合方案治疗特殊/高危部位肝癌的中远期疗效[J].介入放射学杂志,2013:525-528.
[25]翟 博,李晓燕,刘 晟,等.膈顶部原发性肝癌的射频消融[J].介入放射学杂志,2009,18: 357-361.