谷胱甘肽对胰岛素淀粉样纤维化的抑制作用
2014-08-20李红红曾成鸣陕西师范大学化学与化工学院西安710062
李红红,曾成鸣(陕西师范大学化学与化工学院,西安 710062)
一些蛋白质或多肽在一定的条件下可产生错误折叠而形成淀粉样纤维。目前已知多种人类疾病与这类淀粉样纤维有关[1-2]。这些淀粉样纤维通过与细胞膜作用,直接导致细胞损害,还可以启动或者改变一系列生理生化途径,诱导细胞凋亡。研究表明,除了膜蛋白和纤维蛋白外,几乎所有的蛋白质都可以在一定的条件下形成淀粉样纤维。不同的蛋白质或者多肽形成的淀粉样纤维都具有共同的特征,包括较高含量的β折叠结构、无分枝的纤维形态、特殊的表面物理化学性质及细胞毒性等[3-4]。胰岛素是一种常用的多肽类药物,由51个氨基酸组成,在一定的条件下,同样能够形成淀粉样纤维,被认为是最具有淀粉样纤维化倾向的蛋白之一[5]。虽然目前还没有证据表明,胰岛素纤维化与任何疾病相关,但作为药物应用时,胰岛素纤维状聚集体可能具有免疫原性,在注射后可产生一定的不良反应。此外,由于胰岛素极易形成淀粉样纤维,通常将其作为研究多肽淀粉样纤维化、筛选抗纤维化药物以及研究纤维细胞毒性分子机制的模型蛋白。
谷胱甘肽 (glutathione, GSH)是一种由谷氨酸、半胱氨酸和甘氨酸组成的三肽,在生命体系的氧化-抗氧化过程中扮演着重要的角色。本文采用牛胰岛素作为研究对象,探索GSH对蛋白质纤维化的作用及其分子机制,以及GSH对淀粉样纤维细胞的毒性作用。
1 仪器与材料
1.1仪器 LS-55型荧光分光度计(美国Perkin-Elmer公司);H-600型透射电镜(日本Hitachi公司);Quanta 200型环境扫描电镜(Philips-FEI, The Netherland)。
1.2试药 牛胰岛素、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、氨基酸、硫黄素(ThT)和8-苯胺-1-萘磺酸(ANS),购自Sigma-Aldrich公司;其他化合物均为国产分析纯试剂。
1.3细胞 新鲜全血取自健康志愿者,枸橼酸抗凝。按文献方法[4]分离红细胞,制备成20%红细胞悬液,4 ℃保存,当天使用。
2 方法
2.1胰岛素淀粉样纤维的制备 将牛胰岛素溶解于10 mmol·L-1盐酸溶液(pH2.0)中,加入不同浓度的GSH,使胰岛素的终质量浓度为1 g·L-1,于37 ℃下在具有震荡功能的水浴中孵育,震荡频率设定为90 r·min-1,按一定的时间间隔取样。成熟纤维保存在4 ℃备用。
2.2纤维生长曲线的绘制 取10 μL样品,加至含有10 μmol·L-1ThT的Tris-HCl溶液(10 mmol·L-1;pH8.0)中,混匀,于激发波长440 nm、发射波长484 nm条件下进行荧光分析,按照荧光强度-孵育时间制作纤维生长曲线。
2.3ANS荧光检测 配制1 mmol·L-1的ANS溶液,加入到含有10 μL胰岛素样品的10 mmol·L-1Tris-HCl 溶液(pH8.0)中,使ANS的浓度为10 μmol·L-1,混匀后进行荧光分析,准确记录在400~600 nm范围内最大发射波长相应荧光强度数值。激发波长370 nm。
2.4纤维形态观察 取5 μL成熟胰岛素纤维,按1︰5加入重蒸水稀释,于镀膜铜网上点样,滤纸吸干后滴加10 μL双氧铀(20 g·L-1)溶液染色3 min,透射电子显微镜下观察、拍照。
2.5红细胞聚集 取新鲜配制的红细胞,加入胰岛素纤维(孵育15 h),用等渗PBS稀释,纤维终质量浓度为30 mg·L-1,红细胞终体积分数为2%,37 ℃孵育1 h,离心分离,经戊二醛(10 mL·L-1)固定、丙酮系列脱水和喷金后,扫描电镜观察并记录。
3 结果
在37 ℃、90 r·min-1震荡的条件下孵育,胰岛素可在11 h左右形成成熟的淀粉样纤维,纤维的生长过程可以采用ThT荧光法进行监测。ThT是一种能够与淀粉样纤维特异性结合的荧光探针,采用440 nm波长的光激发,可以观察到482 nm的特征荧光发射峰。当胰岛素分子单体通过聚集形成淀粉样纤维时,随着其二级结构转变,β折叠含量增高,与ThT分子结合时出现荧光增强的现象。与大多数蛋白质纤维化过程相似,胰岛素的纤维生长过程也具有成核-聚合的动力学特征[6],即纤维化主要包括成核、生长和成熟3个阶段,ThT荧光曲线表现为S型特征。
GSH可以抑制胰岛素的淀粉样纤维化,其抑制效应与浓度呈正相关,当GSH的浓度达到10 mmol·L-1时,纤维化被完全抑制,ThT荧光强度一直处于较低的范围。2和5 mmol·L-1的GSH也具有明显的抑制作用,虽然ThT荧光强度有所升高,但荧光强度增加的幅度比较小,时间也明显延后,表明较低浓度的GSH可延缓胰岛素的纤维化,并减少生成的纤维量。
为了探索淀粉样纤维的表面性质,我们采用ANS荧光检测胰岛素在纤维化过程中,聚集体表面的疏水性变化。ANS是一种常用的蛋白质分子疏水区域结构分析的荧光探针[7],以370 nm波长的光激发ANS溶液,在530 nm处可观察到一发射峰。当ANS与其他物质分子的疏水区结合时,荧光的强度增强,发射峰蓝移。随着胰岛素的纤维化,ANS荧光逐渐增强,表明胰岛素纤维具有较强的表面疏水性。与ThT荧光变化趋势相比较,在孵育过程中,ANS荧光强度上升比较快,说明胰岛素通过去折叠改变了分子的构象,分子内部的疏水结构暴露在溶剂中,从而加速了聚集体的形成。
在与GSH共存的情况下,胰岛素结合的ANS荧光强度明显降低,当GSH浓度达到5 mmol·L-1时,在整个孵育过程中,胰岛素的ANS荧光没有明显升高,与ThT荧光的趋势大致相同,说明GSH在抑制胰岛素纤维化的同时,也减少了胰岛素聚集体的表面疏水性。见图1。
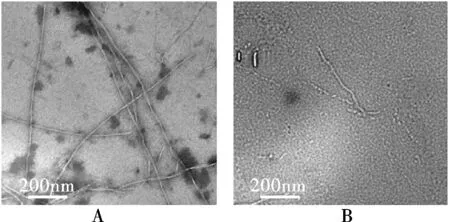
图1 胰岛素淀粉样纤维透射电镜图
本实验条件下形成的胰岛素纤维的直径在6~30 nm之间,长度分布为150~3 700 nm (图1A)。在10 mmol·L-1GSH存在的条件下,可发现短小的原纤维状的聚集体结构,无典型的淀粉样纤维特征(图1B),说明在与GSH共存孵育的情况下,胰岛素淀粉样纤维的生长受到抑制。
ANS荧光强度的变化趋势表明,胰岛素在形成淀粉样纤维后,聚集体具有较强的表面疏水性,这是淀粉样纤维具有细胞毒性的主要原因之一。具有较强表面疏水性的蛋白纤维能够插入到细胞膜的疏水层,干扰细胞膜结构,导致膜通透性增加[7]。本文利用红细胞探索不同条件下形成的胰岛素聚集体的细胞毒性作用,如图2所示。正常红细胞呈双凹面圆盘状,直径约8 μm (图2A)。经50 mg·L-1胰岛素纤维处理后,细胞产生型变和聚集,一些细胞发生破裂和缺损(图2B)。在10 mmol·L-1GSH存在的条件下,形成的胰岛素聚集体(50 mg·L-1)对细胞无明显作用(图2C),表明GSH通过抑制胰岛素的淀粉样纤维化,减小了形成的聚集体对细胞的损害作用。

图2 胰岛素纤维诱导红细胞损害的扫描电镜图
为了探索GSH抑制胰岛素淀粉样纤维化的分子机制,我们考察了与GSH结构相关的几种化合物对胰岛素淀粉样纤维化的作用,包括组成GSH的3种氨基酸即谷氨酸、半胱氨酸和甘氨酸以及氧化型谷胱甘肽(GSSG)。结果表明,只有半胱氨酸对胰岛素的纤维化有抑制作用,不含有巯基的化合物GSSG、谷氨酸和甘氨酸无作用,但半胱氨酸的抑制作用要低于GSH的抑制作用,相同浓度下只有GSH的35%左右。这些结果表明,GSH抑制胰岛素的纤维化与其巯基结构相关。
4 讨论
胰岛素在酸化、升高温度、振荡和表面吸附等条件下,容易产生聚集并形成淀粉样纤维。在振荡条件下,胰岛素形成纤维的速度大大加快,所需要的温度也随之降低。在本文所采用的条件下,胰岛素可在11 h左右完成淀粉样纤维化,生成的纤维具有其他淀粉样纤维相同的物理化学特性和细胞毒性。胰岛素纤维生成的动力学过程包括单体→成核→生长→延长→成熟等阶段,大致对应于ThT荧光曲线中的延迟期、生长期和成熟期[6]。在胰岛素形成纤维的过程中,分子中的部分二级结构由α螺旋转化为β折叠,这种构象的转变可导致内部的疏水基团暴露于分子外层,进而使形成的纤维具有较高的表面疏水性。淀粉样纤维的表面疏水性被认为是其细胞毒性的主要因素之一,纤维的表面疏水性越强,其细胞毒性越大[2,7],与本文的ANS荧光分析和细胞实验结果基本一致。
GSH是一种可以由人类细胞自然合成的三肽,在体内参与一系列的代谢过程,同时与其氧化型GSSG组成重要的氧化-还原对,参与体内氧化还原过程。所以,GSH是生命体系内的一种重要的代谢调节物质和抗氧化剂。同时,GSH还是一种临床上的常用药物,可用于多种疾病的治疗和辅助治疗。本文的实验结果表明,GSH能够有效地抑制胰岛素的淀粉样纤维化,而其氧化型GSSG不具有这种作用,表明GSH抑制胰岛素纤维化的作用可能来源于分子中的巯基结构。有研究表明,二硫键在蛋白质淀粉样纤维化过程中具有重要作用[8]。胰岛素分子中含有3个二硫键,在纤维化过程中,胰岛素分子产生构象转变,使处于内部的二硫键外露,这样GSH分子可通过巯基-二硫键的交换反应使胰岛素分子产生构象改变,从而阻断纤维化进程。虽然半胱氨酸是GSH的分子结构成分,也含有巯基,但它对胰岛素纤维化的抑制作用比较弱,这说明GSH的短肽结构在与胰岛素分子的作用中的重要性,但具体机制尚不清楚,还需要进一步探索。
综上所述,胰岛素在酸性介质和振荡的条件下,可以在37 ℃形成淀粉样纤维。GSH能够抑制胰岛素的淀粉样纤维化,并降低形成的纤维聚集体的表面疏水性,从而降低了胰岛素纤维对细胞的损害作用。GSH的抗淀粉样纤维化作用与分子中的巯基结构有关。本文的实验结果对研发蛋白质淀粉样纤维化相关疾病的治疗药物具有重要意义,同时也为寻找胰岛素稳定剂提供了新的选择。
参考文献:
[1] Pinney J H, Hawkins P N. Amyloidosis[J]. Ann Clin Biochem, 2012, 49: 229-241.
[2] Stefani M. Biochemical and biophysical features of both oligomer/fibril and cell membrane in amyloid cytotoxicity[J]. FEBS J, 2010, 277: 4602-4613.
[3] Fändrich M, Meinhardt J, Grigorieff N. Structural polymorphism of Alzheimer Abeta and other amyloid fibrils[J]. Prion, 2009, 3: 89-93.
[4] 田建庭,李文涓,曾成鸣. 槲皮素对淀粉样纤维细胞毒性的抑制作用[J]. 西北药学杂志, 2012, 27(5): 444-447.
[5] Surmacz-Chwedoruk W, Nieznanska H, Wojcik S, et al. Cross-seeding of fibrils from two types of insulin induces new amyloid strains[J]. Biochemistry, 2012, 51: 9460-9469.
[6] Fändrich M. Absolute correlation between lag time and growth rate in the spontaneous formation of several amyloid-like aggregates and fibrils[J]. J Mol Biol, 2007, 365: 1266-1270.
[7] Huang B, He J, Ren J, et al. Cellular membrane disruption by amyloid fibrils involved intermolecular disulfide cross-linking[J]. Biochemistry, 2009, 48: 5794-5800.
