活性炭对汞离子的吸附动力学研究
2014-08-17卢辛成蒋剑春谢新苹张艳萍王金表
卢辛成,蒋剑春,孙 康,谢新苹,张艳萍,王金表
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042)
煤炭是储量最为丰富的化石燃料能源,是一次能源消费的重要组成部分,约占一次能源消费30%左右,并且这种现状将会在今后相当长的时间内不会改变。汞是煤炭中最容易挥发的痕量元素之一[1],由于煤炭使用量巨大,所以汞污染已经成为了继气候变暖之后的又一全球性污染问题。汞及其化合物能够通过呼吸、消化道以及皮肤等途径进入人体,造成人体神经中毒和组织的病变,并且汞的毒性具有积累性,所以汞污染的防止已经迫在眉睫。水体汞污染常用的处理措施主要有混凝法、化学沉淀法、吸附法、膜分离法以及离子交换法等[2-3]。其中,吸附法由于工艺简单、方法成熟、能够实现深度处理以及通过吸附剂的再生可以降低应用成本等优势,逐渐的成为了水体汞污染控制的重要方法。所以,制备和选择具有良好汞吸附性能的脱汞吸附材料成为了目前汞污染控制的研究热点之一。活性炭作为一种特殊的碳质吸附材料,以其巨大的比表面积、发达的孔隙结构、良好的稳定性以及优异的吸附能力和可再生性,被广泛的应用到溶剂回收、能源存储、水处理等领域[4]。活性炭不仅是优良的吸附材料,也是良好的载体材料。通过在活性炭上进行负载改性,可以提高活性炭的化学吸附作用,充分发挥其物理吸附和化学吸附的协同作用,提高其综合吸附性能[5]。目前,活性炭用于汞污染控制方面的研究主要集中于活性炭负载硫、硫化物或者是卤素后的脱汞性能,但是对活性炭比表面性质对于汞吸附性能以及动力学影响的研究较少。本文作者对活性炭吸附Hg2+的吸附动力学进行了研究,为活性炭在汞污染治理领域的应用提供了技术支撑和理论依据。
1 实 验
1.1 材料与试剂
商用椰壳活性炭 (AC-1),购买于南京木林森活性炭有限公司。盐酸,优级纯;亚甲基蓝,指示剂;碘化钾、硫代硫酸钠、氯化汞均为分析纯。
1.2 活性炭的制备
将椰壳活性炭(AC-1)酸洗、水洗后在105 ℃下进行干燥,置于程序控温电阻箱中在氮气气氛下以10 ℃/min的速度升温到活化温度850 ℃。达到活化温度后,停止通氮气,通入水蒸气,水蒸气用量为1.20 g/min,活化60 min。取出经过水洗,在105 ℃下干燥4 h,制得微孔椰壳活性炭,标记为AC-2。
AC-1和AC-2的物性参数见表1。

表1 活性炭样品的物性参数
1.3 活性炭性能实验方法
1.3.1 亚甲基蓝吸附值、碘吸附值的测定 根据GB/T 12496—1999进行测定。
1.3.2 比表面积和孔结构表征 活性炭的比表面积和孔径结构的表征采用美国麦克公司ASAP2020自动吸附仪。比表面积采用BET方法根据氮气吸附等温线计算,孔容积由相对压力为0.99时的氮吸附总量决定,孔径分布根据BJH理论进行表征。
1.3.3 吸附试验 准确称取一定量的HgCl2,用去离子水配置成溶液,采用电感耦合等离子体发射光谱仪测定Hg2+的浓度。准确量取300 mL配置得到的不同浓度的HgCl2溶液于500 mL具塞锥形瓶中,加入1.0 g活性炭样品。混合后置于控温振荡水浴锅中,在一定温度下吸附一定时间后测定Hg2+浓度。活性炭汞吸附量可以采取下式计算:
qt=(c0-ct)×V/m
(1)
式中:qt—不同条件下活性炭对汞离子的吸附量,mg/g;c0—Hg2+的初始质量浓度,mg/L;ct—Hg2+的瞬时质量浓度, mg/L;V—HgCl2溶液的体积,L;m—活性炭样品的质量,g。
2 结果与讨论
2.1 活性炭样品比表面积和孔结构表征
2.1.1 氮气吸附-脱附等温线分析 对样品进行氮气吸附-脱附等温线分析,其结果如图1所示。从 图1可以看出,AC-1和AC-2的吸附-脱附等温线都为Ⅳ型,在较低的相对压力区内(p/p0≤0.1),吸附量随着压力的升高而快速的增加并且很快的达到吸附饱和,这主要是因为该阶段发生的是气体的单分子吸附形成单分子吸附层,表明该活性炭含有丰富的微孔结构。单分子出现吸附饱和后就开始进行多层吸附,吸附量随着相对压力的增加其升高的趋势逐渐的平缓,吸附平台不是水平的而是呈现一定的斜率。在相对压力(p/p0)较高的区域内,出现了由于吸附曲线和脱附曲线的不重合而产生的滞后回环,这主要是因为吸附质在过渡孔的内部发生毛细凝聚现象而引起的。从吸附-脱附等温线可以得知,AC-1和AC-2具有丰富的微孔结构同时也含有一定量的中孔。
2.1.2 孔径分布分析 采用密度泛函理论(DFT)计算样品的全孔分布,结果如图2 所示。密度泛函利用由于能够提供吸附的微观模型并且可以真实的反应孔中受限流体的热力学性质,所以被广泛的应用于炭材料的微孔、中孔的孔结构分析。从图2可以看出,AC-1和AC-2的孔径分布主要集中于微孔,同时含有一定量的中孔。两种活性炭其孔径分布相对集中,主要集中于0~2 nm的微孔,也有少量的2~3 nm的中孔,孔径分布呈多峰分布。AC-1和AC-2其孔径分布基本相同,二者在微孔部分的峰值主要位于0.86 nm、 1.18 nm和1.48 nm,但是AC-2的最大峰值位于0.59 nm,而AC-1的峰值位于0.68 nm。AC-1和AC-2含有大量微孔结构,所以其等温线表现为在相对压力较低的区域吸附量急剧上升,同时由于存在少量的中孔结构,所以发生多分子层的吸附并且在较高分压区域出现滞后回环,全孔分布与吸附-脱附等温线吻合。

图1 样品氮气吸附-脱附等温线
根据氮气吸附-脱附等温线,计算了样品的比表面积、孔容、平均孔径等参数,见表2。从表2中可以看出,AC-1的比表面积和总孔容为797 m2/g和0.39 cm3/g,AC-2为870 m2/g和0.42 cm3/g;两个样品都有较高的微孔率,AC-2为81.0%、AC-1为79.5%;AC-1的平均孔径为1.95 nm, AC-2为1.97 nm。

表2 样品的比表面参数表
1)Vmes/Vtot: 微孔容与总孔容之比Ratio of micropore volume to total pore volume
2.2 吸附实验
2.2.1 吸附动力学实验 吸附过程的动力学研究可以用来描述吸附剂吸附溶质的吸附速率,并且通过动力学模型的拟合,对其吸附机理进行探讨研究。在水浴温度为283 K,Hg2+质量浓度为7.212 mg/L时AC-1和AC-2对Hg2+吸附性能随时间的变化关系如图3所示。
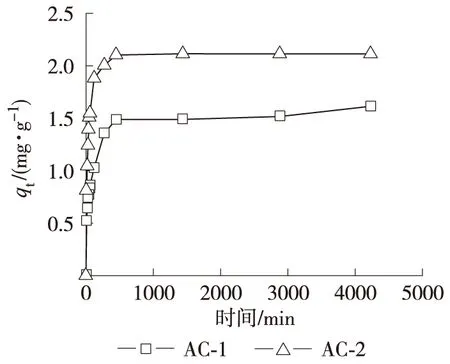
图3 活性炭样品对Hg2+的吸附量随时间的变化
从图3可以看出,样品对于Hg2+的吸附趋势相似,均为动力学相对较快的过程,在120 min内,吸附量随着时间的增加而迅速增加,吸附速度快;之后,随着时间的增加吸附速度减慢,在500 min基本达到吸附平衡,AC-1和AC-2对于Hg2+的饱和吸附量分别为1.614 mg/g和2.112 mg/g。AC-2相比于AC-1,具有较高的Hg2+吸附量。这主要是因为活性炭吸附性能与其比表面积和孔结构息息相关。大孔通常作为吸附的通道,中孔和微孔的含量会直接影响到吸附性能的好坏,同时比表面积大会提供更多的吸附活性位,有利于提高其吸附性能。
吸附动力学实验看出,在吸附开始的阶段,活性炭表面的剩余力和活性位较多,所以可以更快的从周围捕捉其他物质离子从而使活性炭/溶液界面的平衡立场得到补偿,有降低表面吉布斯函数的趋势。而且,溶液中的汞离子可以容易的进入到活性炭的大孔中,所以此阶段吸附速度很快。随着吸附的进行,活性炭表面被吸附质分子占据,表面剩余力也减小,吸附过程发生的推动力也逐渐的减小,并且吸附质分子从大孔进入到中孔和微孔时由于孔结构的不同,使得吸附速度下降并且吸附趋于平衡。因此,从上述实验分析可知,活性炭对汞离子的吸附过程是一个由快速吸附和缓慢吸附构成的双速过程,并且吸附与解吸同时存在。
2.2.2 吸附动力学拟合 在研究活性炭对于Hg2+的吸附动力学时主要采用Lagergren一级速率方程、二级速率方程以及伪二级速率方程进行拟合,研究活性炭吸附的作用机理、吸附进程的吸附速度以及吸附速率控制步骤。Lagergren一级速率方程动力学模型是基于假定吸附受扩散步骤的控制,吸附速率正比于平衡吸附量与t时刻吸附量的差值,其速率方程如(2)所示;Lagergren二级速率方程以及伪二级速率方程模式是基于假定吸附速率受到化学反应控制,机理涉及到吸附剂与吸附质之间的电子共用或是电子转移[6],其方程式如(3)和(4):
lg(qe-qt)=lgqec-(k1/2.303)t
(2)
1/(qe-qt)=1/qec+k2t
(3)
t/qt=(1/k2′)qe2+t/qec
(4)
式中:qe—平衡吸附量实验值,mg/g;qt—t时刻吸附量,mg/g;qec—平衡吸附量计算值,mg/g;k1—一级吸附速率常数,min-1;t—时间,min;k2—二级吸附速率常数,g/(mg ·min);k2′ —伪二级吸附速率常数,g/(mg ·min)。
对获得实验数据,分别采用Lagergren一级速率方程、二级速率方程、伪二级速率方程进行拟合,拟合结果如图4~图6所示,相关参数见表3。
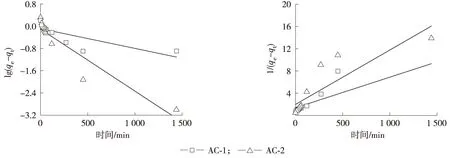
图4 Lagergren一级速率方程拟合结果

图6 Lagergren伪二级速率方程拟合结果


表3 活性炭吸附Hg2+的拟合反应速率方程式参数
2.2.3 吸附等温线实验 吸附等温线用来描述固相吸附剂与液相中金属离子之间吸附平衡的关系的模型,通过对吸附等温线分析可以获得吸附剂最大吸附容量以及相关的动力学和热力学参数,从而对吸附机理进行研究。在不同吸附温度下,AC-1和AC-2对Hg2+吸附性能如图7所示。
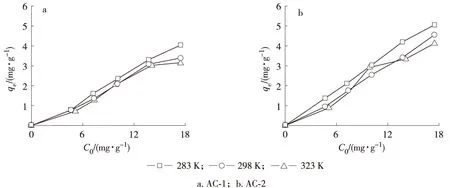
图7 活性炭样品对Hg2+的吸附等温线
从图7可以看出,温度对于活性炭吸附Hg2+有一定的影响。AC-1和AC-2都表现为随温度的升高其对Hg2+的饱和吸附量是减小的,这表明在较低温度时样品对Hg2+有较好的吸附性能,但是温度升高吸附性能下降。吸附等温线所表现出来的这种汞吸附量与温度的负相关的关系,说明Hg2+在活性炭上的吸附属于放热反应。对比两图可以看出,AC-2对Hg2+的饱和吸附量要高于AC-1,这与上面的动力学研究结果相吻合。
2.2.4 吸附等温线拟合 采用Langmuir吸附等温式和Freundlich吸附等温式进行拟合研究,二者方程式见式(5)和(6)。Langmuir公式描述的是吸附质分子在吸附剂表面的吸附形式是以单分子层进行的,Freundlich描述的是吸附质在异质吸附剂上的表面吸附行为[7]。
ce/qe=ce/q0+(1/q0)KL
(5)
lnqe=lnKF+(1/n)lnce
(6)
式中:qe—平衡吸附量实验值,mg/g;q0—分子层饱和的吸附容量,mg/g;KL—常数,L/mg;KF—常数,g-1·L1/n·mg(1-1/n),表征吸附容量;n—指数,表征偏离线性吸附的程度。
对实验获得结果采用Langmuir吸附等温式和Freundlich吸附等温式进行拟合,拟合结果如图8~图9所示,相关参数见表4。

图8 Langmuir吸附等温式拟合结果

图9 Freundlich吸附等温式结果

表4 活性炭吸附Hg2+的吸附等温线拟合参数表
从图中拟合结果可以看出,用Langmuir吸附等温式能够很好的拟合活性炭对Hg2+的吸附等温线,R2都在0.95以上,这说明活性炭吸附Hg2+是属于单分子层吸附,吸附分子之间没有作用力。用Freundlich吸附等温式对数据进行拟合,R2在0.92以上。n能够反映活性炭表面异质化程度以及吸附质与其结合的强度,从表4可以看出,283 K下的n值大于其他温度下,表明在283 K下活性炭对Hg2+的吸附强度大于在其他温度下的吸附强度。综合比较,Langmuir吸附等温式拟合更适合于描述活性炭对Hg2+的吸附行为。
3 结 论
3.1 以椰壳活性炭为原料,采用水蒸气法二次活化制备得到了微孔含量丰富的椰壳活性炭,其亚甲基蓝吸附值165 mg/g,碘吸附值1 090 mg/g。
3.2 活性炭比表面性质对Hg2+的吸附有显著的影响。比表面积大、孔容积大、微孔结构丰富,能够提供更多的吸附活性位,这些吸附活性位的增加有利于增强活性炭对Hg2+的吸附性能。
3.3 活性炭对Hg2+的吸附动力学研究表明,吸附过程是一个吸附与解析并存的由快速吸附和缓慢吸附构成的双速过程。Lagergren伪二级速率方程可以很好的拟合吸附动力学,说明整个过程由两部控制,首先是Hg2+在溶液中向活性表面扩散并且在活性炭表面活性位吸附的过程,此阶段吸附速度较快;之后是Hg2+经由活性炭大孔进入中孔和微孔与内部吸附活性位结合的过程,此阶段吸附速度缓慢。
3.4 活性炭对Hg2+的饱和吸附量随温度的升高而降低,表明活性炭对Hg2+的吸附是一个放热反应。活性炭对Hg2+的吸附等温线符合Langmuir吸附等温式,说明活性炭吸附Hg2+,吸附分子之间没有作用力,属于单分子层吸附。
参考文献:
[1]郑楚光,徐明厚.燃煤痕量元素的排放与控制[M].湖北:科学技术出版社,2002,10-11.
[2]张明泉,朱元成,邓汝温.中国煤大气排放汞量的估算与评述[J].人类环境杂志,2002,31(6):482-484.
[3]HUANG Y J,JIN B S,ZHONG Z P,et al.Characteristic and mercury adsorption of activated carbon produced by CO2of chicken waste[J].Journal of Environmental Sciences,2008,20(3):291-296.
[4]LU X C,JIANG J C,SUN K,et al.Surface modification,characterization and adsorptive properties of a coconut activated carbon[J].Applied Surface Science,2012,258(20):8247-8252.
[5]TAN Z Q,QIU J R,ZENG H C,et al.Removal of elemental mercury by bamboo charcoal impreganted with H2O2[J].Fuel,2011,90(4):1471-1475.
[6]MOHAN D,GUPTA V K,SRIVASTAVA S K,et al.Kinetics of mercury adsorption from wasterwater using activated carbon derived from fertilizer waste[J].Collid and Surfaces(A):Physicochemical and Engineering Aspects,2003,52(2/3):835-841.
[7]DI NATALE F,ERTO A,LANCIA A,et al.Mercury adsorption on granular activated carbon in aqueous solutions containing nitrates and chlorides[J].Journal of Hazardous Materials,2011,192(3):1842-1850.
