我国部分水果产区铃木氏果蝇与其他果蝇形态特征比较研究
2014-08-15任路明
任路明, 王 磊, 于 毅, 褚 栋*
1青岛农业大学农学与植物保护学院,山东省植物病虫害综合防控重点实验室,山东 青岛 266109;2山东省农业科学院植物保护研究所,山东 济南 250100
铃木氏果蝇DrosophilasuzukiiMatsumura(又称斑翅果蝇)隶属双翅目Diptera环列亚目Cyclorrhapha果蝇科Drosophilidae果蝇属Drosophila水果果蝇亚属Sophophora,是一种重要水果害虫。其寄主范围广,繁殖速度快,传播迅速,对水果生产造成严重的经济损失(马聪慧等,2014; 吴军等,2013; Cinietal.,2012; Hauser,2011)。铃木氏果蝇最早于1916年在日本山梨县草莓园中发现(孙鹏等,2011; 于毅等,2013)。近年来入侵南北美洲、欧洲等许多国家并造成严重危害(Cinietal.,2012; Hauser,2011),因此备受世界各国的广泛关注。在北美洲,该虫自2008年在美国本土加利福尼亚沃森维尔地区首次发现以来,俄勒冈州、华盛顿州、佛罗里达州、路易斯安那州、北卡罗来纳州、南卡罗来纳州以及犹他州等州也相继发现其危害,呈现迅速扩散蔓延之势(EPPO,2010)。在南美洲,1998年厄尔瓜多国家零星出现了铃木氏果蝇(Calabriaetal.,2012)。2013年,在南美洲巴西的新韦内扎发现铃木氏果蝇,随后又在巴西的埃雷欣、维拉玛丽亚等地相继发现该虫(Depraetal.,2014)。在欧洲,自2008年秋季首次在西班牙发现铃木氏果蝇后,在欧洲各地不断扩散蔓延(Calabriaetal.,2012; Grassietal.,2009; Kissetal.,2013; Rossi Stacconietal.,2013)。
在中国,铃木氏果蝇是黑腹果蝇复合种中分布最广的物种之一,目前至少在黑龙江、山东、浙江、广西、贵州、西藏、台湾等22个省(自治区)发现了该虫(钱远槐等,2006; Linetal.,1977),近年来其危害也呈现不断加重的趋势(代侃韧,2013)。铃木氏果蝇寄主植物广泛,已知寄主涉及18个科60多种水果(孙鹏等,2011; Boldaetal.,2010; Leeetal.,2011; Richardetal.,2010)。我国于1997年首次在甘肃省天水市发现果蝇危害甜樱桃。经调查,危害甜樱桃的果蝇除铃木氏果蝇之外,还有黑腹果蝇DrosophilamelanogasterMeigen、海德氏果蝇Drosophilahydei(Sturtevant)、伊米果蝇Drosophilaimmigrans(Sturtevant)(郭建明,2007; 刘坤,2014)。在樱桃上也发现了铃木氏果蝇与黑腹果蝇、海德氏果蝇混合发生的情况(郭丽娜等,2014)。因此,不同果蝇的种类鉴定对于果蝇监控具有重要的指导价值。
前人对铃木氏果蝇不同发育阶段的形态特征进行了具体的描述(林清彩等,2013; 孙鹏等,2011; Kikkawa & Peng,1938)。刘坤(2014)详细描述了黑腹果蝇、伊米果蝇、铃木氏果蝇、海德氏果蝇4种果蝇成虫的形态特征。为了能够快速鉴别这4种重要水果果蝇,本文在综合前人形态学研究的基础上,对其成虫形态进行比较研究,并进一步利用线粒体COⅠ(mtCOⅠ)基因对果蝇物种进行鉴定。
1 材料与方法
1.1 供试虫源
试验所用的黑腹果蝇、铃木氏果蝇、海德氏果蝇、伊米果蝇分别采自云南昆明、山东威海、山东淄博和山东临沂。采集方式为诱捕法(伍苏然等,2007; 熊伟等,2014; Chaetal.,2012; Kleiberetal.,2014)。样品保存在无水乙醇中,在实验室于-20 ℃保存备用。
1.2 成虫形态特征观察与比较
将供试果蝇放在培养皿或载玻片上,置于Nikon显微镜下,使用电源光(冷光源XD-301)或在自然光较亮的环境下,调整成虫的前翅、前足、腹部、产卵器的角度,观察比较种间雄虫前翅和前足以及雌虫腹部和产卵器形态结构的差异,以确定果蝇种类(郭迪金等,2007; 林清彩等,2013)。同时,利用TOUPCAM显微镜摄影装置对果蝇的鉴别特征进行拍摄,以便更加系统直观地识别与区分不同种类的果蝇。
1.3 mtCOⅠ基因扩增
在果蝇种类形态学鉴定结果的基础上,利用以mtCOⅠ基因作为分子标记的分子鉴定法(张开春等,2014)进一步验证形态学鉴定结果。以果蝇的部分肌肉组织作为DNA提取材料,每个果蝇种群提取2头,提取方法参照禇栋等(2005)。所用引物为LCO1490(5′-GGTCAACAAATCATAAAGATATTGG-3′)/HCO2198(5′-TAAACTTCAGGGTGACC-AAAAAATCA-3′)(Folmeretal.,1994),其扩增产物大小为700 bp左右。PCR扩增体系:基因组DNA溶液3 μL,20 μmol·L-1引物0.5 μL,5 U·μL-1Taq酶0.25 μL,10×TaqBuffer(缓冲液)2.5 μL,10 mmol·L-1dNTP 0.5 μL,ddH20补至25 μL。PCR扩增参数:94 ℃ 4 min;94 ℃ 45 s,49~55 ℃ 45 s,72 ℃ 90 s,32个循环;72 ℃延伸7 min。取5 μL PCR扩增产物与2 μL loading buffer混匀,然后用1%琼脂糖凝胶电泳分离,EB染色后在凝胶成像系统上观察拍照。将扩增的PCR产物送上海生工生物工程有限公司测序。利用BLASTX对测序结果进行序列比对,比较其结果是否与形态学鉴定结果一致。
1.4 序列分析
测序成功后,从GenBank中选择铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇各2条序列,登录号:铃木氏果蝇KJ671622、KJ671621,黑腹果蝇FJ190110、FJ190109,海德氏果蝇KJ671603、KJ671602,伊米果蝇EF570021、JQ679115。以烟粉虱Bemisiatabaci(Gennadius)mtCOⅠ序列(登录号为JQ906700)为外群,通过Clustal W软件(Thompsonetal.,1994)比对本研究中获得的序列与上述序列,利用MEGA 5.0软件(Tamuraetal.,2007)根据Kimura 2-Paramter模型计算出不同种类果蝇的进化分歧矩阵,采用非加权配对算数平均法(UPGMA)构建系统树,分别将系统树各分支置信度(bootstrap)进行1000次重复检验。
2 结果与分析
2.1 不同果蝇成虫鉴别特征
对铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇雄性成虫主要观察前翅、前足的特征;对雌虫则主要观察其腹部、产卵器的特征(表1)。
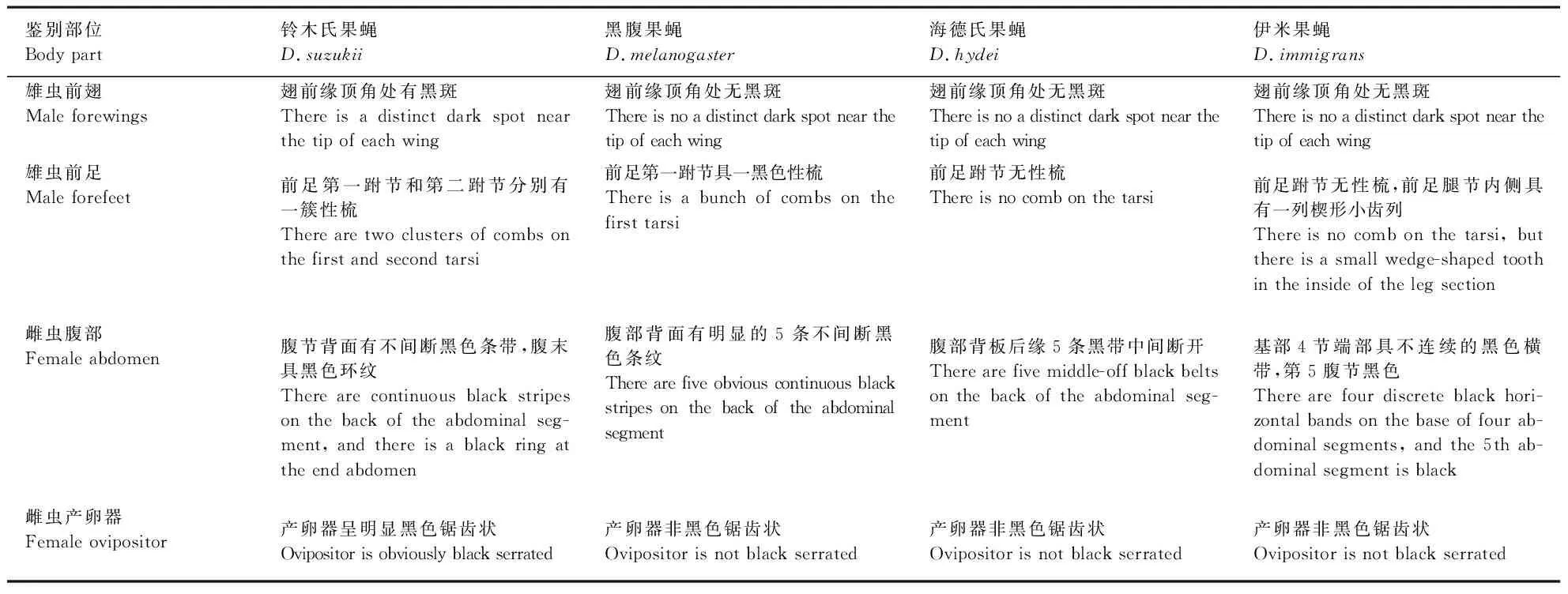
表1 4种果蝇的鉴别特征信息Table 1 Information of the identification features of four Drosophila species
铃木氏果蝇雄虫翅前缘顶角处有黑斑,而其他3种果蝇无黑斑(图1);铃木氏果蝇雄虫前足第一跗节和第二跗节分别有一簇性梳,黑腹果蝇雄虫前足第一跗节具一黑色性梳,海德氏果蝇雄虫前足跗节无性梳,而伊米果蝇雄虫前足腿节内侧具有一列楔形小齿列(图2)。
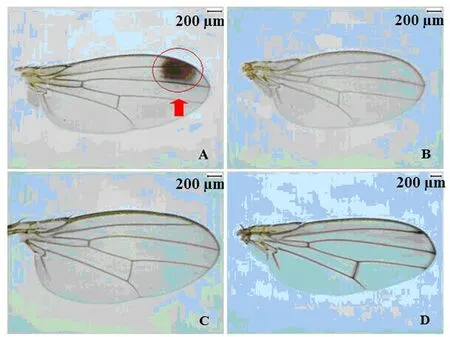
图1 4种果蝇雄虫前翅的鉴别特征Fig.1 Comparison of identification features of the male forewing in four Drosophila speciesA~D:分别为铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇雄虫前翅。A~D: Forewing of male D.suzukii, D.melanogaster, D.hydei, and D.immigrans, respectively.
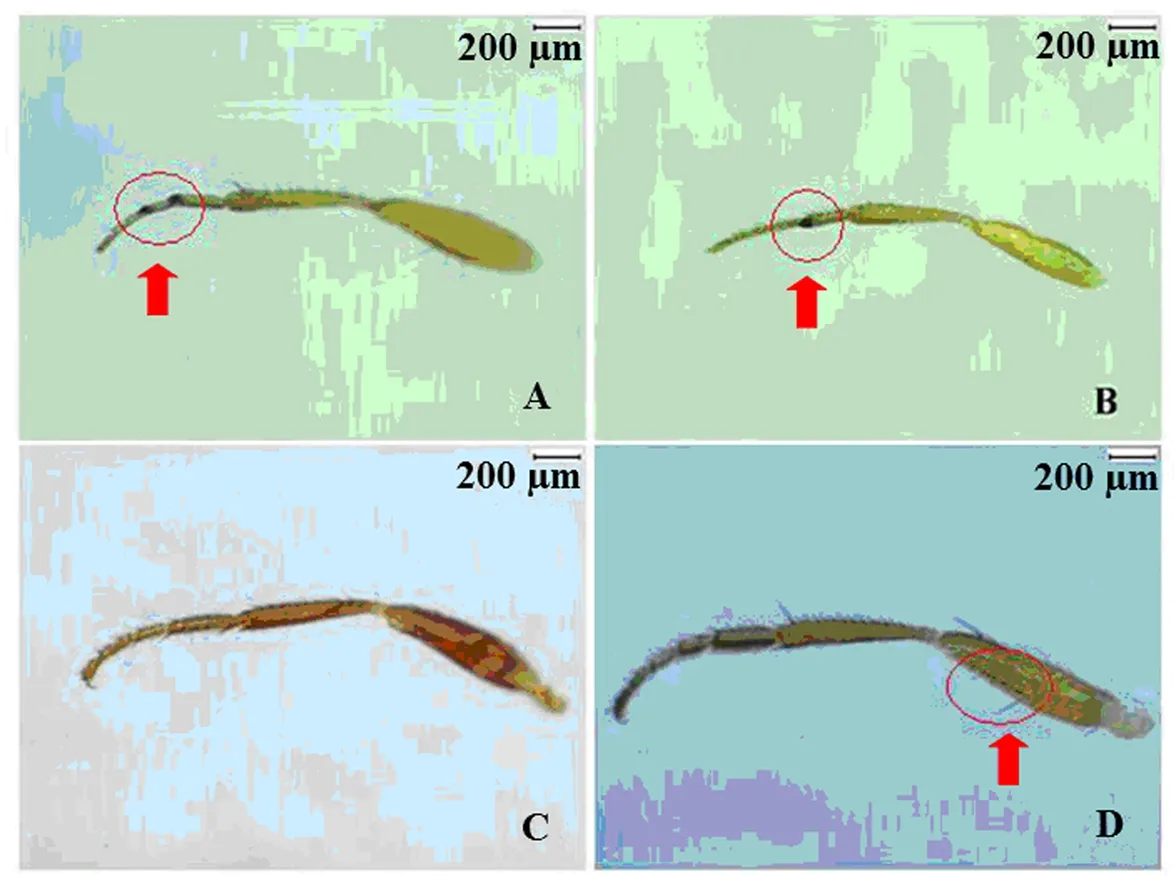
图2 4种果蝇雄虫前足的鉴别特征Fig.2 Comparison of identification features of the male forefeet in four Drosophila speciesA~D:分别为铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇雄虫前足。A~D: Forefeet of male D.suzukii, D.melanogaster, D.hydei, and D.immigrans, respectively.
铃木氏果蝇雌虫腹部腹节背面有不间断黑色条带,腹末具黑色环纹,黑腹果蝇雌虫腹部背面有明显的5条不间断黑色条纹,海德氏果蝇雌虫腹部背板后缘5条黑带中间断开,伊米果蝇雌虫腹部基部4节端部具不连续的黑色横带,第五腹节黑色(图3);铃木氏果蝇雌虫产卵器呈明显黑色锯齿状,而其他3种果蝇雌虫产卵器非黑色锯齿状(图4)。

图3 4种果蝇雌虫腹部的鉴别特征Fig.3 Comparison of identification features of the female abdomen in four Drosophila speciesA~D:分别为铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇雌虫腹部。A~D: Abdomen of female D.suzukii, D.melanogaster, D.hydei, and D.immigrans, respectively.
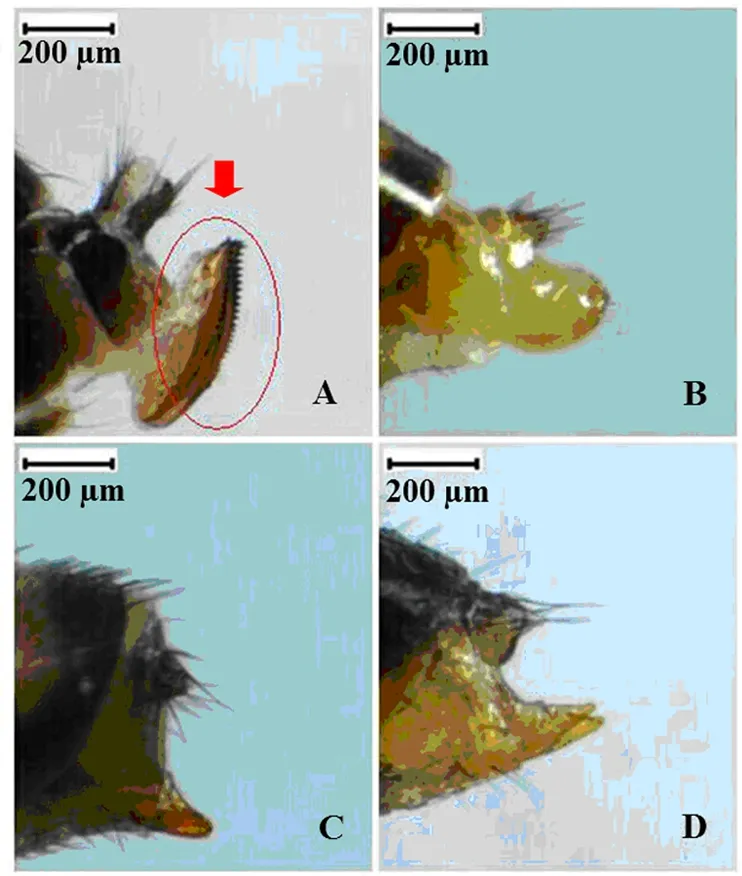
图4 4种果蝇雌虫产卵器的鉴别特征Fig.4 Comparison of identification features of the female ovipositor in four Drosophila speciesA~D:分别为铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇雌虫产卵器。A~D: Ovipositor of female D.suzukii, D.melanogaster, D.hydei, and D.immigrans, respectively.
2.2 基于mtCOⅠ基因对果蝇的分子鉴定
结果表明,4种果蝇样品DNA均扩增成功,扩增片段长度均在700 bp左右,片段长度与预期结果相同(图5)。
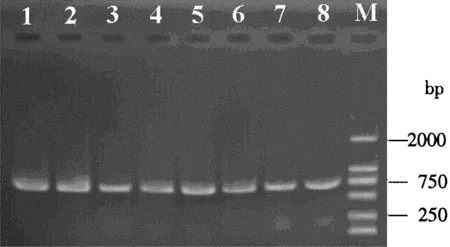
图5 4种果蝇的mtCOⅠ片段扩增图Fig.5 PCR amplification of mtCOⅠ fragments of four Drosophila species1~2: 威海铃木氏果蝇; 3~4: 云南黑腹果蝇; 5~6: 淄博海德氏果蝇;7~8: 临沂伊米果蝇; M: DL2000 DNA标准分子质量。1~2: D.suzukii; 3~4: D.melanogaster; 5~6: D.hydei; 7~8: D.immigrans; M: DL2000 DNA Marker.
从进化分歧矩阵(表2)可以看出,威海铃木氏果蝇与GenBank中铃木氏果蝇遗传距离小于0.3%;云南黑腹果蝇与GenBank中黑腹果蝇遗传
距离为0.0%;淄博海德氏果蝇与GenBank中海德氏果蝇遗传距离为0.0%;临沂伊米果蝇与GenBank中伊米果蝇遗传距离为0.5%;威海铃木氏果蝇与云南黑腹果蝇遗传距离小于9.3%;威海铃木氏果蝇与淄博海德氏果蝇遗传距离为15.1%;威海铃木氏果蝇与临沂伊米果蝇的遗传距离为11.5%。由系统树(图6)可见,威海铃木氏果蝇2条序列与GenBank中2条铃木氏果蝇序列聚在一起;云南黑腹果蝇2条序列与GenBank中2条黑腹果蝇序列聚在一起;临沂伊米果蝇2条序列与GenBank中2条伊米果蝇序列聚在一起;淄博海德氏果蝇1条序列与GenBank中2条海德氏果蝇序列聚在一起。建树结果与形态观察结果完全一致。
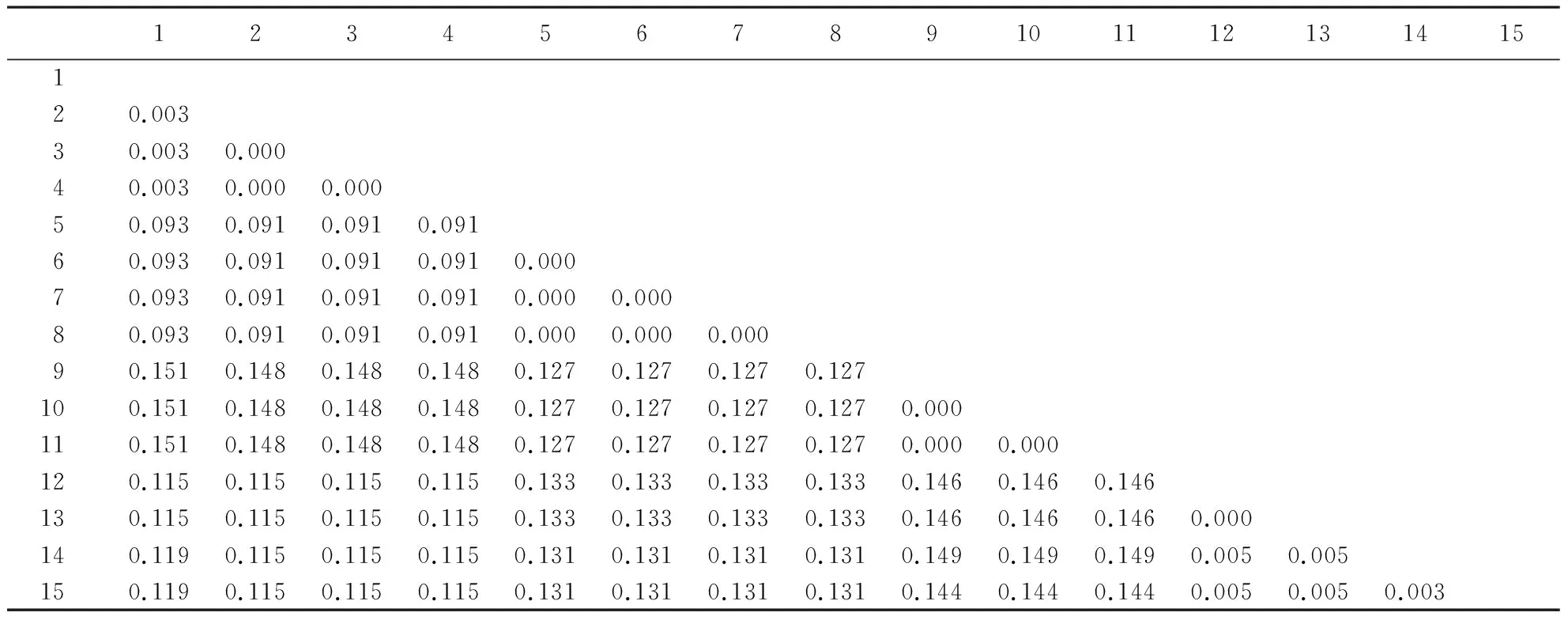
表2 基于mtCOⅠ基因的4种果蝇的遗传距离Table 2 Genetic distance of the four Drosophila species based on mtCOⅠ
1~2:威海铃木氏果蝇2条线粒体COⅠ基因序列(WHGY1, WHGY2); 3~4: GenBank中2条铃木氏果蝇线粒体COⅠ基因序列(KJ671622-Dsuz, KJ671621-Dsuz); 5~6:云南黑腹果蝇2条线粒体COⅠ基因序列(YNGY1, YNGY2); 7~8: GenBank中2条黑腹果蝇线粒体COⅠ基因序列(FJ190110-Dmel, FJ190109-Dmel); 9:淄博海德氏果蝇1条线粒体COⅠ基因序列(ZBGY1); 10~11: GenBank中2条海德氏果蝇线粒体COⅠ基因序列(KJ671603-Dhyd, KJ671602-Dhyd); 12~13:临沂伊米果蝇2条线粒体COⅠ基因序列(LYGY1, LYGY2); 14~15: GenBank中2条伊米果蝇线粒体COⅠ基因序列(EF570021-Dimm, JQ679115-Dimm)。
1~2: Two mitochondrialCOⅠ gene sequences of WeihaiD.suzukii(WHGY1, WHGY2); 3~4: TwoD.suzukiimitochondrialCOⅠ gene sequences in GenBank (KJ671622-Dsuz, KJ671621-Dsuz); 5~6: Two mitochondrialCOⅠ gene sequences of YunnanD.melanogaster(YNGY1, YNGY2); 7~8: TwoD.melanogastermitochondrialCOⅠ gene sequences in GenBank (FJ190110-Dmel, FJ190109-Dmel); 9: Two mitochondrialCOⅠ gene sequences of ZiboD.hydei(ZBGY1); 10~11: TwoD.hydeimitochondrialCOⅠ gene sequences in GenBank (KJ671603-Dhyd, KJ671602-Dhyd); 12~13: Two mitochondrialCOⅠ gene sequences of LinyiD.immigrans(LYGY1, LYGY2); 14~15: TwoD.immigransmitochondrialCOⅠ gene sequences in GenBank(EF570021-Dimm, JQ679115-Dimm).
3 讨论
由于铃木氏果蝇、黑腹果蝇、海德氏果蝇、伊米果蝇4种果蝇常在水果产区混合发生(郭丽娜等,2014),研究这4种果蝇的形态特征有利于对其快速鉴别。本研究表明,铃木氏果蝇雄虫翅前缘顶角处有黑斑,且其前足第一和第二跗节有一簇性梳;雌虫腹节背面有不间断黑色条带,产卵器呈黑色锯齿状。这些是区分铃木氏果蝇与其他3种果蝇的重要形态特征。此外,刚羽化的铃木氏果蝇雄虫黑斑不明显或未显现(林清彩等,2013; 刘坤,2014; 张开春等,2014),可通过其他特征进行鉴别。
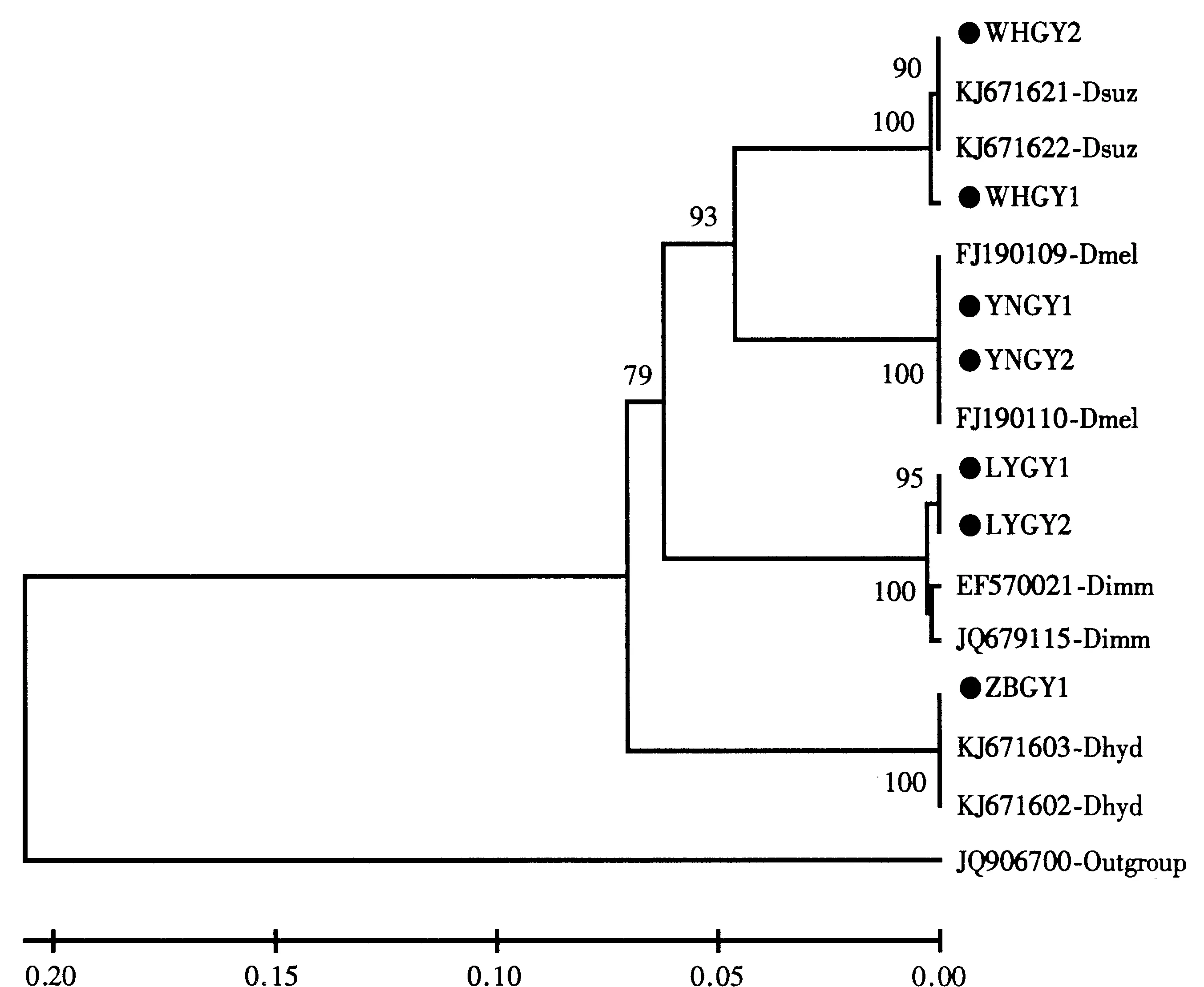
图6基于mtCOⅠ基因构建的系统树(利用UPGMA方法)
Fig.6 Phylogenetic tree constructed usingmtCOⅠ gene based on the UPGMA method
WHGY1, WHGY2: 威海铃木氏果蝇2条线粒体COⅠ基因序列; KJ671622-Dsuz, KJ671621-Dsuz: GenBank中2条铃木氏果蝇线粒体
COⅠ基因序列; YNGY1, YNGY2: 云南黑腹果蝇2条线粒体COⅠ基因序列; FJ190110-Dmel, FJ190109-Dmel: GenBank中2条黑腹
果蝇线粒体COⅠ基因序列; ZBGY1: 淄博海德氏果蝇线粒体COⅠ基因序列; KJ671603-Dhyd, KJ671602-Dhyd: GenBank中2条
海德氏果蝇线粒体COⅠ基因序列; LYGY1, LYGY2: 临沂伊米果蝇2条线粒体COⅠ基因序列; EF570021-Dimm,
JQ679115-Dimm: GenBank中2条伊米果蝇线粒体COⅠ基因序列; Outgroup: 烟粉虱线粒体COⅠ基因序列。
WHGY1, WHGY2: WeihaiD.suzukii; KJ671622-Dsuz, KJ671621-Dsuz:D.suzukiimitochondrial COⅠ gene sequences in GenBank;
YNGY1, YNGY2: YunnanD.melanogaster; FJ190110-Dmel, FJ190109-Dmel:D.melanogastermitochondrial COⅠ gene
sequences in GenBank; ZBGY1: ZiboD.hydei; KJ671603-Dhyd, KJ671602-Dhyd:D.hydeimitochondrial COⅠ gene
sequences in GenBank; LYGY1, LYGY2: LinyiD.immigrans; EF570021-Dimm, JQ679115-Dimm:D.immigrans
mitochondrial COⅠ gene sequences in GenBank. Outgroup:Bemisiatabacimitochondrial COⅠ gene sequences in GenBank.
对于果蝇的幼虫或蛹,应用形态学难以快速区分,尚需进一步开展分子鉴定技术研究。在水果产区往往是几种果蝇混合发生,然而并不是所有发生的果蝇都会对水果生产造成影响,因此,在对果区发生的果蝇种类进行鉴定后应进一步研究确定其主要危害种,从而更经济有效地防控果蝇危害。
褚栋, 张友军, 丛斌, 徐宝云, 吴青君, 朱国仁. 2005. 烟粉虱不同地理种群的mtDNACOⅠ基因序列分析及其系统发育. 中国农业科学, 38(1): 76-85.
代侃韧. 2013. 长安区樱桃果蝇发生规律及防控技术. 陕西林业科技, (5): 88-90.
郭迪金, 蒋辉, 张永华, 张成林, 杨彬洪. 2007. 黑腹果蝇和伊米果蝇在四川阿坝州发生初报. 植物保护, 33(1): 134-135.
郭建明. 2007. 樱桃新害虫黑腹果蝇的生物学特性. 昆虫知识, 44(5): 743-745.
郭丽娜, 李伯辽, 董蓝蔓, 仵均祥. 2014. 樱桃果蝇发生与诱捕技术比较研究. 西北农业学报, 23(2): 55-60.
林清彩, 王圣印, 周成刚, 于毅. 2013. 铃木氏果蝇研究进展. 江西农业学报, 25(10): 75-78.
刘坤. 2014. 甜樱桃果蝇发生与防治的研究进展. 北方果树, (3): 1-3.
马聪慧, 温俊宝, 何善勇. 2014. 樱桃果蝇(Drosophilasuzukii) 对新疆的风险分析. 中国农学通报, 30(16): 286-294.
钱远槐, 刘艳玲, 李守涛, 杨勇, 曾庆韬. 2006. 中国黑腹果蝇种组的组成与分布. 湖北大学学报, 28(4): 397-402.
孙鹏, 廖太林, 袁克, 师振华, 纪睿, 陈集翰, 吴军. 2011. 水果害虫——斑翅果蝇. 植物检疫, 25(6): 45-47.
吴军, 廖太林, 孙鹏, 师振华, 陈集翰. 2013. 斑翅果蝇生物学特性研究. 植物检疫, 27(5): 36-40.
伍苏然, 太红坤, 李正跃, 王旭, 杨仕生, 孙文, 肖春. 2007. 铃木氏果蝇田间诱捕方法比较. 云南农业大学学报: 自然科学, 22(5): 776-778.
熊伟, 寇琳羚, 向波, 伍加勇, 李文杰, 杨灿芳, 熊静丹, 杨家茂. 2014. 糖醋液与不同颜色粘虫板组合诱杀樱桃果蝇实验. 中国南方果树, 43(1): 67-69.
于毅, 王静, 陶云荔, 国栋, 褚栋. 2013. 铃木氏果蝇不同地理种群中Wolbachia的检测和系统发育分析. 昆虫学报, 56(3): 323-328.
张开春, 闫国华, 郭晓军, 王晶, 张晓明, 周宇. 2014. 斑翅果蝇(DrosophilasuzukiiMatsumura) 研究现状. 果树学报, 31(4): 717-721.
Bolda M P, Goodhue R E and Zalom F G. 2010. Spotted wing drosophila: potential economic impact of a newly established pest.AgriculturalResourceEconomics, 13(3): 5-8.
Calabria G, Máca J, Bächli G, Serra L and Pascual M. 2012. First records of the potential pest speciesDrosophilasuzukii(Diptera: Drosophilidae) in Europe.JournalofAppliedEntomology, 136(1-2): 139-147.
Cha D H, Adams T, Rogg H and Landolt P J. 2012. Identification and field evaluation of fermentation volatiles from wine and vinegar that mediate attraction of spotted wing drosophila,Drosophilasuzukii.JournalofChemicalEcology, 38: 1419-1431.
Cini A, Ioriatti C and Anfora G. 2012. A review of the invasion ofDrosophilasuzukiiin Europe and a draft research agenda for integrated pest management.BulletinofInsectology, 65(1): 149-160.
Depra M, Poppe J L, Schmitz H J, De Toni D C and Valente V L S. 2014. The first records of the invasive pestDrosophilasuzukiiin the South American continent.JournalofPestScience, 87: 379-383.
EPPO. 2010.Drosophilasuzukii(Diptera:Drosophilidae). https:∥www.eppo.int/QUARANTINE/Alert_List/insects/drosophila_suzukii.htm.
Folmer O, Black M, Hoeh W, Lutz R and Vrijenhoek R. 1994. DNA primers for amplification of mitochondrial cytochrome coxidase subunit Ⅰ from diverse metazoan invertebrates.MolecularMarineBiologyandBiotechnology, 3: 294-299.
Grassi A, Palmieri L and Giongo L. 2009. Nuovo fitofago per i piccoli frutti in Trentino.TerraTrentina, 55(10): 19-23.
Hauser M. 2011. A historic account of the invasion ofDrosophilasuzukii(Matsumura) (Diptera: Drosophilidae) in the continental United States, with remarks on their identification.PestManagementScience, 67: 1352-1357.
Kikkawa H and Peng F T. 1938.Drosophilaspecies of Japan and adjacent localities.JapaneseJournalofZoology, 7: 507-552.
Kiss B, Lengyel G, Nagy Z and Kárpáti Z. 2013. First record of spotted wing drosophila [Drosophilasuzukii(Matsumura, 1931)] in Hungary.Novenyvedelem, 49(3): 97-99.
Kleiber J R, Unelius C R, Lee J C, Suckling D M, Qian M C and Bruck D J. 2014. Attractiveness of fermentation and related products to spotted wing drosophila (Diptera: Drosophilidae).EnvironmentalEntomology, 43: 439-447.
Lee J C, Bruck D J, Dreves A J, Loriatti C, Vogt H and Baufeld P. 2011. In focus: spotted wing drosophila,Drosophilasuzukii, across perspectives.PestManagementScience, 67: 1349-1351.
Lin F J, Tseng H C and Lee W Y. 1977. A catalogue of the family Drosophilidae in Taiwan (Diptera).QuarterlyJournaloftheTaiwanMuseum, 30: 345-372.
Richard B, Peter B, Alberto G, Jose Maria G C, Martin H, Tracy H, Jonathan K, Philippe R and EPPO. 2010. Pest risk analysis for:Drosophilasuzukii. http:∥capra.eppo.org/files/examples/1/Drosophila_suzukii.pdf#search='Pest+risk+analysis+for%3A+Drosophila+suzukii.+Pratique'.
Rossi Stacconi M V, Grassi A, Dalton D T, Miller B, Ouantar M, Loni A, Ioriatti C, Walton V M and Anfora G. 2013. First field records ofPachycrepoideusvindemiaeas a parasitoid ofDrosophilasuzukiiin European and Oregon small fruit production areas.Entomologia, 1(e3): 11-16.
Tamura K, Dudley J, Nei M and Kumar S. 2007. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0.MolecularBiologyandEvolution, 24: 1596-1599.
Thompson J D, Higgins D G and Gibson T J. 1994. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice.NucleicAcidsResearch, 22: 4673-4680.
猜你喜欢
杂志排行
生物安全学报的其它文章
- Soil microbes enhance competition ability of the exotic Ageratina adenophora Sprengel against native plant species
- The use of the Rényi scalable diversity index to assess diversity trends in comparative and monitoring studies of effects of transgenic crops
- 我国西花蓟马线粒体DNA-COⅠ基因变异及群体遗传结构分析
- 杀虫剂对烟蚜茧蜂不同发育阶段的毒性
- 褐拟谷盗传入我国的风险分析及管理对策
- 实蝇类害虫分子鉴定研究进展
