西格列汀联合缬沙坦治疗早期糖尿病肾病疗效观察
2014-08-15赵春云郭洪涛代红沙田敬荣赵玉芹
赵春云,郭洪涛,代红沙,田敬荣,赵玉芹
0 引言
肠促胰素类药物是目前用于治疗2型糖尿病较新的一类药物,肠促胰素类药物有两类:一类是GLP-1(胰高血糖素样肽-1)类似物,一类是DPP-4(二肽基肽酶)抑制剂,它能通过抑制DPP-4的活性,减少DPP-4对GLP-1和GIP(葡萄糖依赖促胰岛素多肽)的降解,提高循环中的GLP-1和GIP 水平,而GLP-1具有葡萄糖浓度依赖的促胰岛素分泌的特点,能大大降低发生低血糖的风险,并可抑制胰岛β细胞凋亡,改善β细胞功能,因此,肠促胰素类药物在临床上得到了越来越广泛的应用。而在动物模型和临床研究中发现,DPP-4抑制剂联合ARB,能够通过大幅度减少糖尿病肾病的氧化损伤起到更强的肾保护效应[1-2]。本研究采用DPP-4抑制剂西格列汀联合缬沙坦治疗早期2型糖尿病肾病,效果较好,现报道如下。
1 资料与方法
1.1 临床资料 选取2012年3月至2013年6月初诊为糖尿病肾病患者48例,均符合1999年WHO糖尿病的诊断标准。其中男33例,女15例,年龄48~65岁。均无心功能不全、高血压及原发性肾疾病,血尿素、肌酐水平处于正常范围,并据早期糖尿病肾病的诊断标准,尿白蛋白排泄率(UAER)为20~200 μg/min或30~300 mg/24 h。入选患者糖尿病病史7~10年,原均采用口服降糖药物及皮下注射胰岛素治疗,其中双胍类+胰岛素27例,α糖苷酶+胰岛素21例。对入选患者随机分组,其中对照组13例,观察组35例。
1.2 治疗方法 对照组适当运动,控制饮食,在饮食方面限盐,6~9 g/d;采用注射胰岛素降糖,并用缬沙坦80 mg 1次/d控制尿蛋白。观察组适当运动,控制饮食,在饮食方面限盐,6~9 g/d;口服捷诺维(西格列汀)100 mg 1次/d,并用缬沙坦80 mg 1次/d控制尿蛋白治疗。两组共治疗6个月。
1.3 检测指标 治疗6个月后所有受试者均过夜禁食12 h,次晨空腹抽取静脉血3 mL两管,一管在1 h内分离血清,随即采用免疫比浊法检测测定血清胱抑素(CysC);另一管采用离子层析法测定糖化血红蛋白(HbA1c)。留取24 h尿液标本,采用免疫胶体金斑点渗滤试验检测尿微量白蛋白(mAlb),尿白蛋白排泄率正常为<30 mg/24 h。平均动脉压(MAP)=(收缩压+2×舒张压)/3,BMI=体重(kg)/身高(m)2。
1.4 不良反应 观察组在治疗期间偶有一过性的胃肠道不良反应,包括恶心、呕吐、腹痛和腹泻。无其他不良反应。

2 结果
两组治疗前后HbA1c、BMI、MAP、CysC、mAlb比较见表1。由表1可见,治疗前后BMI、MAP差异无统计学意义,两组治疗后HbA1c、CysC、mAlb较治疗前下降,且观察组的HbA1c、CysC、mAlb较对照组下降更显著。
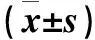
表1 两组治疗前后BMI、MAP、CysC、HbA1c、mAlb比较
3 讨论
糖尿病肾病的损伤机制在于高血糖状态下代谢紊乱、血流动力学异常和蛋白非酶糖化造成的氧化应激损伤、局部炎症改变、肾素血管紧张素系统与蛋白激酶的相互作用[3]。而减轻炎性反应和减少氧化损伤可以有效地保护肾功能[4]。DPP-4抑制剂对肾脏的保护作用主要来自于两个方面。
首先,DPP-4抑制剂减少DPP-4对GLP-1的降解,提高循环中的GLP-1水平,这一作用与GLP-1受体激动剂具有相似的作用。研究表明,GLP-1受体激动剂艾塞那肽和利拉鲁肽有助于通过以下途径减轻糖尿病肾病[5]。①抑制细胞间黏附分子-1(ICAM-1)。ICAM-1及单核细胞趋化蛋白-1(MCP-1)是单核-巨噬细胞从血管进入目标组织的趋化及黏附关键因子[6]。高血糖、糖化终产物可以诱导上述细胞因子在肾脏中的表达,导致巨噬细胞在肾脏的聚集[7],GLP-1受体激动剂通过抑制肾小球内皮细胞中ICAM-1的产生和直接抑制巨噬细胞细胞活素的释放,削除了巨噬细胞和肾小球内皮细胞之间的恶性循环,而这种恶性循环是造成炎症的原因之一[8]。②减少巨噬细胞的滤过性。在体外的研究中,巨噬细胞的上层清液部分能够刺激肾小球系膜细胞产生纤维连接蛋白,而巨噬细胞直接产生TGF-β,两者都在糖尿病肾病的肾小球细胞外基质中起到了关键作用[9]。研究表明,GLP-1受体激动剂能够抑制巨噬细胞的滤过性。③抑制NF-κB活动。活化的NF-κB不仅可以自身激活转化生长因子-α(Transforming growth factor-α,TGF-α)、白细胞介素-1(Interleukin-1,TL-1)、单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP-1)等,活化的NF-κB还可通过诱导骨桥蛋白(OPN)、TGF-β1等炎症因子的产生引起炎症的级联反应,将炎症扩大化[10]。在糖尿病状态下,许多因子能够使NF-κB活动增强,NF-κB也是调控ICAM-1产生的最重要的转录因子。研究表明,艾塞那肽能够抑制脂多糖引起的巨噬细胞的NF-κB活动,NF-κB活动的减少导致ICAM-1水平的降低,从而抑制来源于巨噬细胞的促炎性细胞活素的表达[11]。④减少氧化压力。研究表明,在长期肾脏高血糖的情况下,GLP-1能使NAD(P)H氧化酶抵制因子通过cAMP-PKA途径降低NAD(P)H氧化酶的活性,减少肾脏的氧化应激损伤,从而对肾脏起到重要的保护作用,其中,NAD(P)H氧化酶为产生活性氧的主要来源,参与氧化应激,从而对肾脏造成损伤,同时,GLP-1受体通过激活cAMP直接作用于肾系膜细胞,减轻肾小球膜的扩张,从而起到抗炎作用[12],减少AGEs受体的表达。晚期糖基化终产物(AGEs)及其受体(RAGE)在糖尿病肾病中也起到了一定的作用,非对称的二甲基精氨酸(ADMA)是内生的一氧化氮合酶抑制剂,也是造成糖尿病肾病的因素。GLP-1能够抑制AGE所导致的RAGE和蛋白精氨酸甲基转移酶1(PRMT-1)的基因表达,ROS和ADMA在管状细胞中的产生,从而能够抑制AGE在内皮细胞中导致的炎性反应[13]。艾塞那肽能够降低Rage、Prmt-1、Icam-1、Mcp-1和ADMA水平,通过抑制PRMT-1的表达减少经AGE-RAG调整的ADMA的产生,从而抑制活性氧所产生的过氧化损害[14]。另外,也有研究证实,GLP-1受体激动剂艾塞那肽能够减少尿液中氧化压力标记物8-羟基脱氧鸟苷水平和蛋白的排泄,能够改善糖尿病小鼠的组织病理学改变[15],减少TGF-β1 mRNA在肾脏的表达。TGF-β1是最重要的致纤维化因子之一,可从多方面促进细胞外基质(Extracelluarmatrix,ECM)生成,同时抑制其降解,导致其过度集聚,最终引起相关组织的纤维化[16]。GLP-1受体激动剂能够通过腺苷酸环化酶的作用,减少TGF-β1的mRNA和蛋白表达,因而有助于改善肾脏间质的纤维化程度[17]。
GLP-1受体激动剂对肾脏的保护作用在DPP4抑制剂中也得到了证实,如在T1DM小鼠中,经DPP4抑制剂治疗后,能够减少蛋白尿和改善肾脏组织学改变[1]。在T2DM小鼠中,DPP4抑制剂西格列汀表现出了相似的肾保护效应[18]。阿格列汀联合ARB也能够显著减少尿蛋白。在人体研究中发现,T2DM患者应用DPP4抑制剂阿格列汀治疗24周后,尿蛋白的排泄显著减少[2]。
其次,与GLP-1受体激动剂不同的是,DPP-4抑制剂还可以提高循环中的基质衍生因子SDF-1a的水平。基质衍生因子SDF-1a最初是从骨髓衍生的基质细胞中发现的一种趋化因子,现在发现其在多种组织中都有表达,它通过调节循环中的干细胞或骨髓衍生的祖细胞到达组织受损处来帮助组织修复[19]。SDF-1a对于受损细胞具有直接的抗细胞凋亡的效应,并且作为CXCR4的强趋化因子,能够动员CD34+ CXCR4+干细胞到达组织受损区域,在与细胞因子(如GSF-EPO)的协同作用下,起到抗细胞凋亡和组织修复的作用,减少器官损伤,提高器官功能。这样,SDF-1a对多种器官包括肾脏具有重要的保护作用,多项研究已经证实其具有抗胰岛β细胞凋亡的效应[20]。有活性的SDF-1α是DPP-4生理酶作用物,在DPP-4酶的作用下能被迅速地灭活成失活的SDF-1α。临床研究表明,DPP-4抑制剂通过抑制DPP-4酶的活性,能够提高T2DM患者血清中的SDF-1α水平[21],而SDF-1α水平的升高可以减少肾脏氧化应激及缺血、再灌注等事件造成的损伤,对肾脏起到保护作用。另外,也有研究证实,DPP-4抑制剂能够降低氧化压力标志物8羟基脱氧鸟苷(8-OHdG)水平,增加尿液中的cAMP水平,并提高血液中的SDF-1α水平[2]。此外,接受西格列汀治疗的患者EPCs和SDF-1α显著增高,而MCP-1显著降低[21],表明西格列汀能够减少促炎性趋化因子MCP-1的水平,有助于恢复循环中的祖细胞水平。另一方面,最近的研究表明,SDF-1α还能够提高细胞cAMP的产生并激活cAMP调节信号通路[22-23],cAMP在多种信号传导通路上起着重要的第二信使的作用,同时它也是胰岛β细胞在GLP-1诱导下胰岛素分泌的基本效应器。研究表明,cAMP能够减少氧自由基,包括超氧阴离子,通过抑制超氧阴离子的主要来源-NAD(P)H氧化酶而达到抗氧化效应。
此外,DPP-4抑制剂对DPP-4抑制作用的本身能够减轻脂多糖导致的巨噬细胞释放的细胞活素和NF-κB活动,从而起到一定的抗炎作用,能在一定程度上保护肾功能[24]。
由于高血糖导致的代谢障碍会对肾脏造成持续的损伤,所以,尽管严格控制血糖及控制血压治疗,许多患者仍表现出持续的肾脏损害。大量的DN临床治疗结果显示,通过严格控制血糖、血脂、阻断肾素-血管紧张素系统,仅对部分患者的DN有延缓作用,大部分患者蛋白尿仍进行性加重,最终进展到终末期肾病[7]。DPP-4抑制剂对肾脏有较好的抗炎和抗氧化作用,缬沙坦对DN的肾功能也有明显的保护作用[25],DPP-4抑制剂联合ARB治疗DN,可以获得更好的治疗效果,值得在临床推广应用。
参考文献:
[1] Alter ML,Ott IM,Von Websky,et al.DPP-4 inhibition on top of angiotensin receptor blockade offers a new therapeutic approach for diabetic nephropathy[J].Kidney Blood Press Res,2012,36(1):119-130.
[2] Fujita H,Taniai H,Murayama H,et al.DPP-4 inhibition with alogliptin on top of angiotensin II type 1 receptor blockade ameliorates albuminuria via up-regulation of SDF-1α in type 2 diabetic patients with incipient nephropathy[J].Endocr J,2014,61(2):159-166.
[3] 刘新民.实用内分泌学[M].第3版,人民军医出版社,2004:1462-1463.
[4] Canacankatan N,Sucu N,Aytacoglu B,et al.Affirmative effects of iloprost on apoptosis duringischemia-reperfusion injury in kidney as a distant organ[J].Ren Fail,2012,34(1):111-118.
[5] Kodera R,Shikata K,Kataoka HU,et al.Glucagon-like peptide-1 receptor agonist ameliorates renal injury through its anti-inflammatory action without lowering blood glucose level in a rat model of type 1 diabetes[J].Diabetologia,2011,54(4):965-978.
[6] Sasaki M,Shikata K,Okada S,et al.The macrophage is a key factor in renal injuries caused by glomerular hyperfiltration[J].Acta Med Okayama,2011,65(2):81-89.
[7] 李江,钟玲.巨噬细胞在糖尿病肾病发生发展过程中的作用[J].医学信息,2013,9:619-620.
[8] Okada S,Shikata K,Matsuda M,et al.Intercellular adhesion molecule-1-deficient mice are resistant against renal injury after induction of diabetes[J].Diabetes,2003,52(10):2586-2593.
[9] Ziyadeh FN,Hoffman BB,Han DC,et al.Long-term prevention of renal insufficiency,excess matrix gene expression,and glomerular mesangial matrix expansion by treatment with monoclonal antitransforming growth factor-beta antibody in db/db diabetic mice[J].Proc Natl Acad Sci USA,2000,97(14):8015-8020.
[10]刘晔.α1-受体抗体介导的糖尿病鼠肾基质重构免疫机制[D].南方医科大学硕士学位论文,2012:24.
[11]Arakawa M,Mita T,Azuma K,et al.Inhibition of monocyte adhesion to endothelial cells and attenuation of atherosclerotic lesion by a glucagon-like peptide-1 receptor agonist,exendin-4[J].Diabetes,2010,59(4):1030-1037.
[12]Fujita H,Morii T,Fujishima H,et al.The protective roles of GLP-1R signaling in diabetic nephropathy:possible mechanism and therapeutic potential[J].Kidney Int,2014,85(3):579-589.
[13]Ishibashi Y,Nishino Y,Matsui T,et al.Glucagon-like peptide-1 suppresses advanced glycation end product-induced monocyte chemoattractant protein-1expression in mesangial cells by reducing advanced glycation end product receptor level[J].Metabolism,2011,60(9):1271-1277.
[14]Ojima A,Ishibashi Y,Matsui T,et al.Glucagon-like peptide-1 receptor agonist inhibits asymmetric dimethylarginine generation in the kidney of streptozotocin-induced diabetic rats by blocking advanced glycation end product-induced protein arginine methyltranferase-1 expression[J].Am J Pathol,2013,182(1):132-141.
[15]Park CW,Kim HW,Ko SH,et al.Long-term treatment of glucagon-like peptide-1 analog exendin-4 ameliorates diabetic nephropathy through improving metabolic anomalies in db/db mice[J].J Am Soc Nephrol,2007,18(4):1227-1238.
[16]Veerasamy M,Nguyen TQ,Motazed R,et al.Differential regulation of E-cadherin and alpha-smooth muscle actin by BMP 7 in human renal proximal tubule epithelial cells and its implication in renal fibrosis[J].Am J Physiol Renal Physiol,2009,297(5):1238-1248.
[17]Li W,Cui M,Wei Y.Inhibition of the expression of TGF-β1 and CTGF in human mesangial cells by exendin-4,a glucagon-like peptide-1 receptor agonist[J].Cell Physiol Biochem,2012,30(3):749-757.
[18]Abd E,Motteleb DM,Elshazly SM.Renoprotective effect of sitagliptin against hypertensive nephropathy induced by chronic administration of L-NAME in rats:role of GLP-1 and GLP-1 receptor[J].Eur J Pharmacol,2013,720(1-3):158-165.
[19]Askari AT,Unzek S,Popovic ZB,et al.Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy[J].Lancet,2003,362(9385):697-703.
[20]Proost P,Struyf S,Schols D,et al.Processing by CD26/dipeptidyl-peptidase IV reduces the chemotactic and anti-HIV-1 activity of stromal-cell-derived factor-1alpha[J].FEBS Lett,1998,432(1-2):73-76.
[21]Fadini GP,Boscaro E,Albiero M,et al.The oral dipeptidyl peptidase-4 inhibitor sitagliptin increases circulating endothelial progenitor cells in patients with type 2 diabetes:possible role of stromal-derived factor-1alpha[J].Diabetes Care,2010,33(7):1607-1609.
[22]Twery EN,Raper JA.SDF1-induced antagonism of axonal repulsion requires multiple G-protein coupled signaling components that work in parallel[J].PLoS One,2011,6(4):e18896.
[23]Xu H,Leinwand SG,Dell AL,et al.The calmodulin-stimulated adenylate cyclase ADCY8 sets the sensitivity of zebrafish retinal axons to midline repellents and is required for normal midline crossing[J].J Neurosci,2010,30(21):7423-7433.
[24]Ervinna N,Mita T,Yasunari E,et al.A DPP-4 inhibitor,suppresses proliferation of vascular smooth muscles and monocyte inflammatory reaction and attenuates atherosclerosis in male apo E-deficient mice[J].Endocrinology,2013,154(3):1260-1270.
[25]吴泽成,刘慎微.缬沙坦对2型糖尿病模型大鼠肾组织巨噬细胞浸润的影响[J].医药导报,2008,27(3):268-271.
