噻托溴铵对重症哮喘患者肺功能及预后的影响
2014-08-15张添威毛立群
张添威,毛立群
0 引言
支气管哮喘是由多种细胞及细胞组分参与的慢性气道炎症,此种炎症常伴随引起气道反应性增高,导致反复发作的喘息、气促,胸闷和(或)咳嗽等症状,多在夜间和(或)凌晨发生,此类症状常伴有广泛而多变的气流阻塞,可以自行或通过治疗而逆转。β2受体激动剂、激素、茶碱等可以迅速扩张支气管、控制气道炎症反应,是治疗支气管哮喘的一线用药[1]。然而,即使上述药物同时大剂量使用,部分哮喘仍难以控制,是困扰临床医生的难题。噻托溴铵粉吸入剂是抗胆碱能类药物,通过与支气管平滑肌上的毒蕈碱受体结合,可抑制副交感神经末端所释放的乙酰胆碱的胆碱能作用,从而达到扩张支气管的目的[2],在临床中用于治疗慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)[3]。近年来,动物实验提示,噻托溴铵可改善哮喘大鼠的气道炎症反应,有利于气道重构[4]。Slats等[5]研究提示,噻托溴铵在哮喘患者中有扩张支气管、降低气道高反应性的作用。肖永营等[6]研究发现,噻托溴铵可延长β2受体激动剂的治疗效果。然而,噻托溴铵在重症哮喘患者中的疗效及能否改善哮喘患者预后尚不清楚。本研究以重症哮喘患者为研究对象,探讨噻托溴铵粉吸入剂对重症哮喘患者肺功能及预后的影响,为临床用药提供参考。
1 资料与方法
1.1 一般资料 选择2010年5月至2011年5月在我院呼吸内科就诊的重症哮喘患者为研究对象。重症哮喘的诊断标准参照2006年全球哮喘防治指南[7]。纳入标准:①符合重症哮喘诊断标准;②年龄>18岁;③意识清楚,能够配合检查;④签署知情同意书。排除标准:①近1周曾使用抗胆碱能类药物;②年龄<18岁;③中重度肾功能不全(肌酐清除率≤50 mL/min)、窄角型青光眼、前列腺增生、膀胱颈梗阻者;④妊娠、哺乳期妇女;⑤吸入噻托溴铵可能发生过敏反应;⑥依从性差,不签署知情同意书者。试验组52例,男23例,女29例;年龄38~72岁,平均(55.41±5.34)岁;哮喘病程(3.58±0.36)年。对照组52例,男20例,女32例;年龄39~74岁,平均(55.34±5.28)岁;哮喘病程(3.52±0.31)年。两组的性别、年龄及病程方面比较差异无统计学意义(P>0.05)。本试验经过我院伦理委员会批准,所有患者均签署知情同意书。
1.2 分组及治疗方法 采用随机数字表法将104例患者随机分为试验组和对照组。试验组在常规治疗的基础上给予噻托溴铵粉吸入剂(江苏正大天晴药业股份有限公司生产;批号:H20060454)治疗,用法:1粒(18 μg)/d,加入干粉吸入器Handi Haler装置一次性给药。对照组仅给予常规治疗。常规治疗包括糖皮质激素、β2受体激动剂及控制感染等治疗。
1.3 观察指标 观察两组患者治疗前及治疗后半年肺功能(FEV1%、PEF%)、动脉血气(PaO2和PaCO2)及预后(住院次数、住院时间及机械通气次数)。肺功能包括采用6200型体积描记仪(美国,Sensor Medics)测定。动脉血气采用血气分析仪(瑞士,AVL公司)自动检测。并记录药物不良反应。
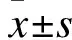
2 结果
2.1 两组治疗前后肺功能及动脉血气指标比较 治疗前,两组FEV1%、PEF%、PaO2和PaCO2比较,差异无统计学意义(P>0.05);治疗后,两组FEV1%、PEF%和PaO2均显著升高,PaCO2显著降低,差异均有统计学意义(P<0.05);治疗后,试验组FEV1%、PEF%和PaO2显著高于对照组,PaCO2显著低于对照组,差异均有统计学意义(P<0.05)。见表1。
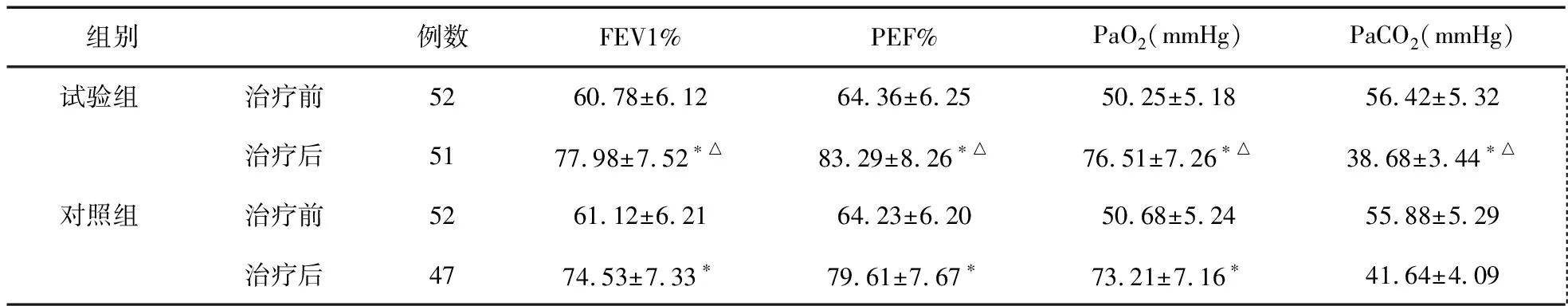
表1 两组哮喘发作时严重程度比较
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05
2.2 两组随访期间住院及死亡情况比较 试验组平均住院次数、住院时间、机械通气次数及死亡患者比例均显著低于对照组,差异有统计学意义(P<0.05)。见表2。
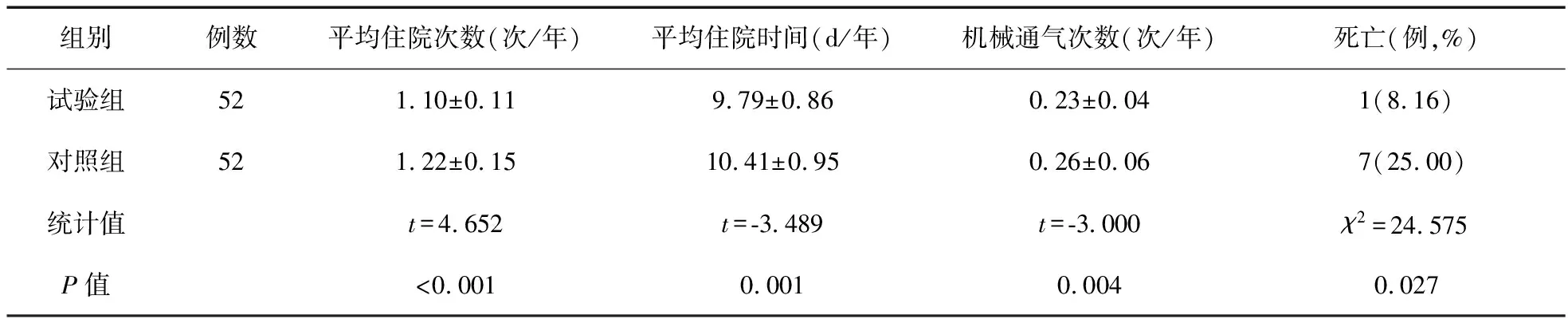
表2 两组随访期间住院及死亡情况比较
2.3 两组药物不良反应比较 试验组排尿困难1例,口干2例,心慌2例,烦躁2例,头晕2例,恶心3例;对照组心慌1例,烦躁2例,头晕2例,恶心2例。试验组总不良反应发生率(30.95%)与对照组(19.05%)比较,差异无统计学意义(χ2=0.222,P=1.492)。见表3。
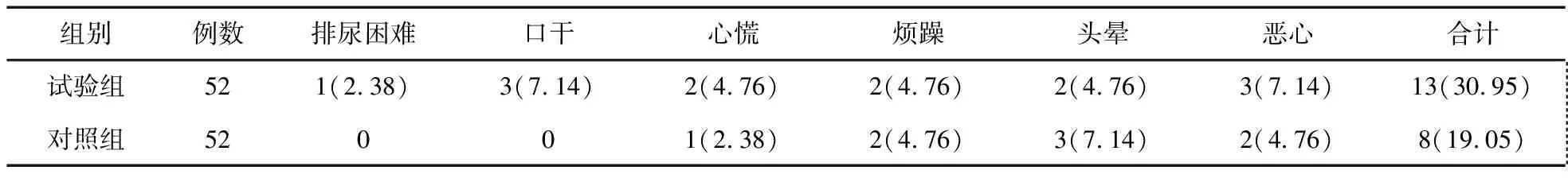
表3 两组药物不良反应比较(例,%)
3 讨论
支气管哮喘急性发作的治疗目的在于尽快缓解症状、解除气流受限和低氧血症,治疗哮喘的药物包括需要长期每天使用的控制药物和按需使用的缓解药物[8]。控制药物包括吸入糖皮质激素(简称激素)、全身用激素、白三烯调节剂、长效β2受体激动剂、缓释茶碱、抗IgE抗体及其他有助于减少全身激素剂量的药物等;缓解药物包括速效吸入β2受体激动剂、全身用激素、吸入性抗胆碱能药物、短效茶碱及短效口服β2受体激动剂等[9]。虽然上述药物均在临床上成为常规用药,但在临床实践中,仍有部分重度以上发作病例经常规治疗不能达到完全缓解[10]。
噻托溴铵为长效(持续作用时间大于24 h)、特异性、选择性抗胆碱能类药物,它选择性对M1、M2受体起作用,并且解离半衰期较异丙托溴铵长100倍,与β2受体激动剂相比,其作用缓和而持久[11]。既往噻托溴铵用于慢性阻塞性肺疾病患者伴有的支气管痉挛的长期维持治疗[12-14],而未应用于哮喘的治疗。动物试验[15]已经发现噻托溴铵对于哮喘模型具有较好的抗炎作用,可提高哮喘治疗效果,近年来,逐渐开始在临床中探讨塞托溴铵治疗支气管哮喘的疗效。Slats等[5]对12例慢性阻塞性肺疾病合并轻度哮喘患者使用噻托溴铵治疗,20 min后发现,可有效控制气道炎症反应,提示噻托溴铵可能通过改善哮喘患者气道炎症反应而提高临床疗效。唐红梅等[16]将42例重度持续性哮喘患者随机分成噻托溴铵联合舒利迭组(试验组)和单用舒利迭组(对照组),经过4周治疗,发现试验组的临床症状和肺功能改善程度显著优于对照组,提示噻托溴铵可改善重度哮喘患者临床症状和肺功能。沈宁等[17]对210例未控制的哮喘患者进行研究发现,噻托溴铵优于糖皮质激素剂量加倍,提示噻托溴铵对未控制的哮喘具有一定疗效。然而,临床中噻托溴铵治疗哮喘的报道仍不多,缺乏长期随访,对重症哮喘治疗尚未见报道。
本研究以重症哮喘患者为研究对象,探讨噻托溴铵对重症哮喘患者肺功能和预后的影响。经过半年治疗后发现,两组FEV1%、PEF%、PaO2和PaCO2均显著改善,但试验组改善更明显,表明噻托溴铵可改善重症哮喘患者肺功能。肺功能检查帮助确诊哮喘,是评价疾病严重程度的重要指标,同时也是评价疗效的重要指标[18]。哮喘患者应定期复查肺功能检查。日常监测PEF有助于评估哮喘控制程度。Peters等[19]对轻中度难以控制的哮喘患者进行临床研究发现,噻托溴铵可改善其肺功能。Nogami等[20]对24例哮喘伴有持续性阻塞性通气功能障碍的患者使用噻托溴铵、高剂量的类固醇和长效β2激动剂治疗1年时间,与不使用噻托溴铵患者进行对照,发现噻托溴铵可显著改善哮喘患者的呼气流量限制的持续性阻塞性通气功能障碍。本研究与上述结果相似,但本次研究的研究对象为重症哮喘患者,本文研究结果显示,哮喘患者的住院次数、住院时间、机械通气次数及死亡率为评价其预后的重要指标。本研究发现,试验组上述指标显著优于对照组,表明噻托溴铵可改善重症哮喘患者的预后。研究发现,噻托溴铵可延长β2受体激动剂的治疗效果[6],同时,改善气道炎症反应,有利于气道重构[4]。众所周知,气道炎症几乎是所有类型哮喘的共同特征,也是临床症状和气道高反应性的基础。郭玉曼等[21]研究发现,哮喘患者血清IL-10和TNF-α增高,这些炎症反应越高,其预后越差,提示改善气道炎症反应可有利于改善重症哮喘患者的预后。本研究主要观察噻托溴铵对肺功能及预后的影响,未进行炎症指标监测,存在不足。Iwamoto等[22]研究发现,噻托溴铵对于嗜酸性粒细胞不增高的重症哮喘患者亦有效,提示噻托溴铵的作用不仅仅是针对嗜酸性粒细胞增高所致的炎症反应,可能还有其他未阐述的机制,但本研究未进行更深入探讨,尚存在不足。
从药物不良反应方面看,使用噻托溴铵的试验组患者出现了少量排尿困难和口干等药物不良反应,这是因为噻托溴铵具有毒蕈碱受体亚型MI~M5类似的亲和力,它通过抑制平滑肌M3受体而影响排尿,通过抑制腺体分泌而引起口干。但试验组总药物不良反应发生率(30.95%)与对照组(19.05%)比较差异无统计学意义,提示加用噻托溴铵并未明显增加药物不良反应,但鉴于噻托溴铵的药理作用,对于中重度肾功能不全(肌酐清除率≤50 mL/min)、窄角型青光眼、前列腺增生、膀胱颈梗阻者临床中应禁止使用,以免引起严重药物不良反应。
综上所述,噻托溴铵可改善重症哮喘患者肺功能,并可改善其短期预后,且不增加药物不良反应。本研究观察时间较短,且为单中心研究,病例数不多,尚需大样本、多中心、长期随访的前瞻性研究进一步探讨。
参考文献:
[1] 童维佳.糖皮质激素和长效和β受体激动剂联合吸入治疗哮喘的疗效分析[J].实用药物与临床,2010,13(1):67-68.
[2] Williamson PA,Short PM,Clearie KL,et al.Paradoxical trough effects of triple therapy with budesonide/formoterol and tiotropium bromide on pulmonary function outcomes in COPD[J].Chest,2010,138(3):595-604.
[3] 童皖宁,卓安山,曹玉书,等.BiPAP联合噻托溴铵治疗Ⅳ级老年COPD稳定期患者的临床观察[J].重庆医学,2012,41(21):2199-2200.
[4] Ohta S,Oda N,Yokoe T,et al.Effect of tiotropium bromide on airway inflammation and remodelling in a mouse model of asthma[J].Clin Exp Allergy,2010,40(8):1266-1275.
[5] Slats AM,Janssen K,van Schadewijk A,et al.Bronchial inflammation and airway responses to deep inspiration in asthma and chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2011,176(2):121-128.
[6] 肖永营,宋勇,吴红明,等.噻托溴铵吸人剂治疗稳定期D组慢性阻塞性肺疾病的疗效评价[J].中国呼吸与危重监护杂志,2012,11(2):125-128.
[7] 王雯.如何达到并维持指南定义的支气管哮喘控制[J].中国医师进修杂志,2011,34(25):72-75.
[8] 方丽萍,辛晓峰.支气管哮喘药物治疗对气道重塑的影响[J].中华结核和呼吸杂志,2012,35(12):927-929.
[9] 林江涛.我国支气管哮喘防治指南解读[J].中国药物应用与监测,2011,8(3):131-135.
[10]Boskabady MH,Rezaeitalab F,Rahimi N,et al.Improvement in symptoms and pulmonary function of asthmatic patients due to their treatment according to the Global Strategy for Asthma Management(GINA)[J].BMC Pulm Med,2012,22(1):8-26.
[11]姜锋,李晓明,张庆.噻托溴铵对稳定期COPD患者夜间睡眠低氧的临床疗效[J].中国老年学杂志,2012,32(6):1128-1130.
[12]周甲东,赵芝焕,万崇华,等.慢性阻塞性肺疾病急性加重期患者的生存质量、客观指标及其关系的研究[J].实用医学杂志,2012,28(20):3362-3364.
[13]陈瑞祥.噻托溴铵联合沙美特罗/丙酸氟替卡松治疗慢性阻塞性肺病的疗效分析[J].实用医学杂志,2012,28(5):816-817.
[14]饶理强,蔡博,肖坚怀,等.噻托溴铵治疗中重度慢性阻塞性肺疾病稳定期的疗效观察[J].实用医学杂志,2012,28(10):1713-1714.
[15]Bos ST,Gosens R,Zuidhof AB,et al.Inhibition of allergen-induced airway remodelling by tiotropium and budesonide:a comparison[J].Eur Respir J,2010,30(4):653-661.
[16]唐红梅.噻托溴铵联合舒利迭治疗老年重度持续支气管哮喘的临床观察[J].临床肺科杂志,2012,17(12):2166-2168.
[17]沈宁,贺蓓.应用噻托溴铵治疗成人未控制哮喘[J].中华医学杂志,2010,90(42):2955-2956.
[18]武晓兰,唐伟,王聪慧,等.咳嗽变异性哮喘患者Eotaxin的表达及其与肺功能的关系[J].实用医学杂志,2013,29(2):199-201.
[19]Peters SP,Kunselman SJ,Icitovic N,et al.Tiotropium bromide step-up therapy for adults with uncontrolled asthma[J].N Engl J Med,2010,363(1):1715-1726.
[20]Nogami H,Honjo S,Iwanaga T.The effect of inhaled anticholinergic drugs(tiotropium bromide)on asthma patients with persistent obstructive ventilatory impairment[J].Arerugi,2012,61(11):1675-1682.
[21]郭玉曼,迟俊玲.血清IL-10和TNF-α水平与哮喘治疗预后的相关性分析[J].临床肺科杂志,2012,17(9):1614-1616.
[22]Iwamoto H,Yokoyama A,Shiota N,et al.Tiotropium bromide is effective for severe asthma with noneosinophilic phenotype[J].Eur Respir J,2010,31(6):1379-1380.
