诺迪康胶囊抗小鼠运动性疲劳的实验研究
2014-08-14朱淦芳
朱淦芳
(浙江中医药大学,浙江 杭州 310053)
随着健康知识的普及和推广,参与体育运动、运动塑身、运动保健、运动康复的群体越来越多,出现运动性疲劳的几率也越来越大[1]。运动引起的疲劳能否及时消除,关系到运动效率及运动持久性,甚至关系到运动群体的健康。而疲劳主要是大量消耗机体能源,使血糖降低;造成乳酸和蛋白质分解物存留在体内,破坏机体酸碱平衡、离子分布、渗透压平衡等所引起,是机体代谢失去平衡的表现[2]。
在西医药方面,由于西药在提高运动能力、延缓疲劳产生的同时也给人体带来了危害,且很多药物均为国际奥委会所禁用;而中医药因其作用多靶点、几乎不含违禁成分等特点已引起了国内外学者的广泛关注[3]。中医认为运动性疲劳是机体因“劳倦”引起“虚损”。心主血脉,只有精血充足,血液才能在脉内正常地运行,营养全身,当心血亏虚时则易导致失眠多梦、眩晕和健忘等症,当长时间力竭性运动则引起严重的平衡紊乱,可能会造成心血管调控功能失常,甚至局部缺血,导致心血管损伤,进而影响机体的运动能力[4]。
诺迪康胶囊由产自西藏高原的药用植物(圣地红景天)提取精制而成,主要成分为红景天苷、黄酮、红景天素等,具有益气活血、通脉止痛的作用,临床常用于治疗气虚血瘀所致胸痹[5]、椎基底动脉供血不足[6]、冠状动脉临界病变[7]和慢性心力衰竭[8]等病症,其在治疗心血管疾病方面具有较好疗效[9-11]。同时,临床也发现诺迪康胶囊对慢性疲劳方面也具有较好治疗效果[12-13],但其在抗运动性疲劳方面的研究尚未见报道。据报道,红景天苷具有提高组织脂质抗氧化水平、清除自由基等作用[14]。故本文采用小鼠游泳运动性疲劳模型,以力竭时间及其LDH、MDA、BUN和SOD及肝糖原的含量为检测指标,首次研究诺迪康胶囊在抗运动性疲劳和提高耐受力方面的作用,为扩大诺迪康胶囊的进一步临床应用提供科学依据。
1 试验材料与仪器
1.1 试验材料
1.1.1 试剂:诺迪康胶囊(西藏诺迪康药业股份有限公司,批号:120101);维生素C(湖北华中药业有限公司,批号:20081012);0.9%生理盐水;SOD试剂盒(南京建成生物工程研究所,批号:20120820);MDA试剂盒(南京建成生物工程研究所,批号:20120817);肝糖原试剂盒(南京建成生物工程研究所,批号:20120620)。
1.1.2 动物:ICR小鼠,年龄4周龄,体重20±2g,雌雄各半,由上海西普尔-必凯实验动物有限公司(合格证号:SYXK(2008-0058)提供。
1.2 实验仪器
日立自动生化分析仪(H7020,日本日立公司);匀浆机(T10,德国IKA公司);电子分析天平(JJ300,江苏常熟双杰测试仪器厂)。
2 实验方法
2.1 小鼠适应性培养 将小鼠进行3d的适应性培养,使小鼠适应实验室生活环境和饲养条件,达到实验所需要求。
2.2 小鼠筛选及分组 将小鼠置于直径40 cm的水槽中,水深30 cm,水温控制在25℃±1℃,淘汰不会游泳的小鼠(游泳时间小于300 s)。将符合条件的小鼠随机分成正常对照组、模型组和3个实验组(高剂量组500mg·kg -1、中剂量组250mg·kg -1和低剂量组100mg·kg -1),每组10只,共50只。其中3个实验组每天灌胃对应浓度的诺迪康混悬液,正常对照组和模型组小鼠每天灌胃等体积的蒸馏水。
2.3 小鼠运动疲劳模型制备 每天上午将模型组和3个实验组和进行游泳训练,在小鼠尾根部负相当于体重5%的铅丝,置于水温25℃±1℃、水深30cm、大小50cm×50cm×40cm的游泳箱中游泳30min,正常对照组不进行训练。持续14d,即为运动性疲劳模型。
2.4 力竭时间测定。上述小鼠连续灌胃14d,末次灌胃30min后,将所有小鼠进行一次力竭性游泳试验(连续3次沉入水底,每次持续10 s)。观察并记录各小鼠游泳状况,以入水至力竭的时间作为小鼠力竭时间。
2.5 LDH和BUN含量测定 将力竭小鼠立即进行眼球采血,迅速采集0.5 ml全血,静置30min,3 000r/min的转速离心15min。吸取血清,利用全自动生化分析仪测定血清中乳酸脱氢酶(LDH)和尿素氮(BUN)的含量。
2.6 SOD和MDA含量测定 将“2.5”中小鼠迅速解剖,取出心脏,用生理盐水漂洗后用滤纸吸干,加入9倍重量的生理盐水,在冰水浴下用玻璃组织匀浆器研磨,3 000r/min离心15min,吸取上清液,按试剂盒操作,测定SOD和MDA的含量。
2.7 小鼠肝糖原含量测定 将“2.6”中小鼠迅速取出肝脏,用生理盐水漂洗后用滤纸吸干,精确称取肝脏1g,加入9倍重量的生理盐水,在冰水浴下用玻璃组织匀浆器研磨,3 000r/min离心15min,吸取上清液,按试剂盒说明书操作,测定小鼠肝糖原的含量。
3 统计学处理
使用SPSS13.0软件进行统计学处理,组间差异采用方差分析,两两比较采用q检验。取P<0.05作为显著性差异水平。
4 结果与分析
4.1 各组小鼠游泳力竭时间变化
结果表明:小鼠游泳力竭时间模型组与正常对照组之间有显著性差异(P<0.05),其力竭游泳时间明显缩短;低剂量组与模型组之间无显著差异;中剂量组与模型组之间有显著性差异(P<0.05);高剂量组与模型组之间有非常显著性差异(P<0.01);且中剂量组与高、低剂量组小鼠的游泳时间存在非常显著性差异(P<0.01)。说明诺迪康胶囊能延长小鼠力竭游泳时间。见表1
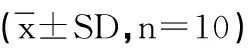
表1 各组小鼠游泳力竭时间变化
注:☆与正常对照组比较 P<0.05;☆☆与正常对照组比较 P<0.01;○与模型组比较 P<0.05;○○与模型组比较 P<0.01;表2-4同
4.2 各组小鼠血清BUN和LDH变化
结果表明:小鼠血清BUN和LDH含量模型组与正常对照组相比,其LDH含量明显降低,BUN含量明显升高,LDH、BUN均有显著差异(P<0.05)。三组剂量组组与模型组之间低剂量组无显著差异;高剂量组与模型组之间存在非常显著性差异(P<0.01);中剂量组与模型组之间有显著差异(P<0.05)。表明诺迪康能提高小鼠运动后血清中LDH的含量,减少血清中BUN含量的产生。小鼠运动后血清LDH含量升高、BUN的含量降低,反映诺迪康胶囊可增强血清中乳酸分解,加强BUN的清除,延缓小鼠的运动疲劳,见表2。
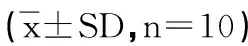
表2 各组小鼠BUN和LDH变化
4.3 各组小鼠心脏MDA和SOD变化
结果表明:小鼠模型组与正常对照组相比,其SOD含量有显著差异(P<0.05),MDA含量呈非常显著性差异(P< 0.01)。高剂量组与模型组比,其SOD含量有显著差异(P<0.05),中剂量组MDA含量有显著差异(P<0.05),而高剂量组MDA含量呈非常显著性差异(P<0.01)。说明中高剂量的诺迪康胶囊具有降低机体过氧化脂质水平,具有延缓疲劳作用,见表3。
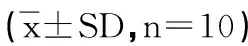
表3 各组小鼠MDA和SOD变化
4.4 各组小鼠肝糖原变化
结果表明:小鼠肝糖原模型组与正常对照组之间肝糖原的含量存在非常显著性差异(P< 0.01)。高、中剂量组小鼠的肝糖原含量与模型组比较存在非常显著性差异(P< 0.01);低剂量组小鼠肝糖原含量与模型组比,有显著差异(P< 0.05)。这表明低、中、高剂量的诺迪康胶囊具有增加机体糖原储备的功效,延缓运动疲劳的作用,见表4。
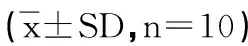
表4 各组小鼠肝糖原变化
5 讨 论
5.1 诺迪康胶囊的作用机制
诺迪康胶囊是从高原人参圣地红景天中提取有效成分研制的中成药,具有扶正固本、益气活血、通脉止痛之功,它的主要药味是红景天,具有益气活血、通脉平喘的功效[12],能减轻因缺血引起的细胞内酸中毒、减少自由基的释放,从而改善心肺功能。红景天中的红景天苷能有效地扩张冠状动脉,使动脉血管内血压下降,减小心脏的负荷,降低心肌耗氧量,调节血流变性,有效改善心力衰竭症状,增强心肌收缩,促进心肺功能恢复,具有耐缺氧和抗心肌缺血的作用。
5.2 诺迪康胶囊对小鼠游泳力竭时间的影响
运动疲劳为机体生理过程不能继续将机体维持在特定水平工作或不能维持预定的运动强度。这是因为体内能源物质大量消耗而不能及时补充,体内糖原消耗过大所致,运动时一些代谢产物在体内堆积且又不能及时清除,从而影响体内的代谢平衡,造成协调机能失调和运动能力下降的现象,实际是一种机体自我保护的正常表现。而力竭则是运动疲劳的极端形式,在长时间运动过程中,机体内产生的自由基增多,而自由基与机体组织细胞损伤有关,是诱发运动疲劳和运动损伤的原因之一。运动员常会因大强度训练导致体内系统平衡失调,尤其是代谢系统,受神经、免疫内分泌系统的调节,与运动供能直接相关,一旦失衡又不能及时调整,会造成疲劳继而导致运动能力下降[15]。在运动性疲劳试验研究中,国内外的造模方法多采用游泳试验和跑台试验[16]。本文选择小鼠游泳试验的方法进行造模,研究中发现,与正常对照组小鼠相比,随着训练时间的延长,模型组小鼠逐渐出现精神萎靡、毛发蓬乱枯燥、毛色灰暗、食欲明显下降、易受惊吓和反应迟钝等一系列运动性疲劳现象,且在游泳过程中,模型组出现力竭小鼠的数量增多、休息时间延长,说明运动性疲劳模型造模成功。实验结果证明:经灌胃诺迪康胶囊混悬液后,可以抑制缺氧时血清中LDH的活性,使小鼠力竭游泳时间明显较模型组延长。说明诺迪康胶囊具有改善心肌功能,使小鼠心肌收缩力增强,提高氧的运输能力,保持供养充足,提高耐氧能力减少自由基生成,降低过氧化损伤,保证高能有效生成,提高机体运动能力,延缓疲劳出现。
5.3 诺迪康胶囊对小鼠血清中LDH、BUN影响
LDH在存在于机体的所有细胞中,是无氧代谢的重要酶。大运动量运动时,心肌细胞缺氧,糖酵解增加,能量利用降低及产生不足,导致细胞内LDH含量增加及机体乳酸供能系统发生障碍,肾脏、肝脏及心肌的有氧氧化能力大大减弱。而中等运动量运动时,LDH大量释放,使血清中LDH含量升高,能量的利用率提高,促进机体快速恢复。因此,血清LDH是反映过度训练对机体组织的损伤情况[17]。BUN是蛋白质代谢的终末产物,运动能力和运动疲劳有着密切的关系,BUN又是评价运动负荷和运动量的重要指标。机理是:在长时间运动时,机体内的蛋白质和氨基酸才会分解供能,BUN的含量升高,身体的机能下降,各组织出现疲劳状态。在运动过程中血清尿素氮含量通常是随着运动负荷增加而升高,身体对负荷适应性越差,产生尿素氮越多。蛋白质又是参与能量代谢的储备之一,利用的程度高低是反映机体适应力大小[18]。在长时间运动过程中,当机体不能通过糖、脂肪代谢获取足够的能量时,蛋白质与氨基酸就会参与分解代谢,导致血尿素氮增加。游泳小鼠血清尿素氮比安静基础血清尿素氮明显升高,所以,血清中BUN含量可间接反映机体的疲劳程度[19]。诺迪康中的成分可降低小鼠运动中血清BUN含量,血清BUN含量的降低表明蛋白质参与供能的比例相对减少,在运动时糖原、脂肪的供能得到不断加强。实验结果表明:灌胃诺迪康混悬液后,模型组与正常对照组相比,其LDH含量明显降低,BUN含量明显升高;高、中剂量组小鼠的LDH和BUN含量与模型组比,LDH的含量明显上高,UBN含量明显降低。说明诺迪康混悬液对小鼠力竭运动后所造成LDH、BUN的含量水平异常起到良好的调节作用,促进机体在运动时维持正常的身体机能。更说明诺迪康混悬液对UBN水平有调节作用,能加强糖原、脂肪在运动中的供能,相对减少了肌肉中蛋白质参与供能的比例,维持肌肉中能量平衡,抑制肌肉中过氧化物酶的老化分解。反映诺迪康胶囊可增强血清中乳酸分解,加强BUN的清除,延缓小鼠的运动疲劳。所以,实验各剂量组小鼠血清BUN含量低于模型组这一结果说明,小鼠运动时动用的蛋白质低于模型组,从而证实诺迪康胶囊具有提高机体适应力、延缓疲劳的作用。
5.4 诺迪康对小鼠心脏中SOD和MDA含量的影响
运动中机体需要大量的氧量增加,导致血红蛋白自氧化和自由基升高,使体内的抗自由基酶活性也相应增加,从而致使细胞氧化损伤加剧[15]。SOD是体内消除自由基的抗氧化酶。MDA是机体内质过氧化反应的重要代谢产物,对细胞具有严重的毒性作用,MDA的含量在一定程度上反应了机体内自由基产生和消除的情况。力竭游泳后的小鼠,SOD的含量降低,MDA的含量上升,其机理是力竭运动后的小鼠机体产生大量的自由基,超过了机体本身抗氧化系统的清除能力,导致大量的自由基对组织细胞膜上的酶的合成受到抑制。本实验小鼠灌入一定剂量的诺迪康混悬液后,小鼠血清酶的活性明显降低,同时小鼠SOD含量提高,机体抗氧化酶活性的提高有利于小鼠快速清除运动时产生的过量自由基,避免了自由基各组织的损伤。结果显示:模型组小鼠SOD含量明显低于中、高剂量组,而MDA含量高于中、高剂量组。说明诺迪康可通过降低MDA含量,提升SOD抗氧化酶活性,清除氧自由基,减轻氧自由基及其引发的脂质过氧化对细胞组织的损伤,从而达到延缓运动疲劳的目的。
5.5 诺迪康对小鼠肝糖原含量的影响
糖原的储存量是直接影响机体的运动能力,同时储量大小与疲劳的延缓也有直接关系。长时间运动时,为机体内的血糖维持平衡水平,肝糖原储备量下降[12]。糖原含量的高低是反应疲劳发生的快慢。肌糖原消耗的同时,为维持血糖水平,肝糖原储备量减少[18]。实验结果表明:诺迪康各剂量组小鼠的肝糖原水平均高于模型组,且有显著性差异,低、中、高剂量组的游泳小鼠的力竭时间也有不同程度的延长,其具有增加机体糖原储备的功效。所以,服用不同诺迪康混悬液的量能够使肝糖原缓慢分解,从而使血糖值水平保持相对平稳。通过增加肝糖原储备为机体提供更多的能量,可以延长小鼠力竭时间,从而达到抗疲劳的目的。
6 小 结
诺迪康胶囊可通过延长其游泳力竭时间、提高LDH、SOD和肝糖原储备、降低BUN和MDA含量等方式来提高抗氧化酶活性、减少自由基生成而降低心肌脂质过氧化损伤,对心肌细胞起到了良好的保护作用,延缓小鼠的运动性疲劳,说明该药物具有改善小鼠心肌相对缺氧、提高运动能力、降低运动损伤、加速疲劳后物质、能量代谢的恢复及疲劳消除的作用。本实验证明诺迪康胶囊具有抗运动疲劳的作用,为运动训练提供较高的利用价值,也为扩大诺迪康胶囊的进一步应用范围提供了科学依据。
[1] 潘燕,彭彦铭.蜂胶黄酮抗小鼠运动性疲劳的实验研究[J].辽宁体育科技,2011,33(1):38-43.
[2] 郝志明,范玲,吕玉珍.鸡胚对小鼠抗衰老和抗疲劳的作用[J].西安联合大学学报,2002,5(4):24-26.
[3] 包怡敏,许家佗.中药抗运动性疲劳的现代研究进展[J].中国中医基础医学杂志,2008,14(10):800-802.
[4] Torricelli C, Capurro E, Santucci A, et a1. Multiple plasma proteins control atrial natriuretic peptide (ANP) aggregation. J Mol Endocrinol, 2004,33(2):335-341.
[5] 桂丽.诺迪康胶囊临床应用进展[J].首都医药,2008(8):41.
[6] 白玛央金.诺迪康胶囊在椎基底动脉供血不足患者中的应用[J].西藏科技,2011(3):47-51.
[7] 李晓磊,杨海波.诺迪康胶囊治疗冠状动脉临界病变20例[J].中医研究,2010,23(12):35-36.
[8] 黄桢.诺迪康胶囊治疗慢性心力衰竭疗效观察[J].现代中西医结合杂志,2010,19(2):176-177.
[9] 李德剑,鲁波,莫书荣.诺迪康对急性心肌缺血和心衰大鼠血流动力学的影响[J].中国应用生理学杂志,2006,22(3):291-297.
[10] 林忠文.诺迪康对心肌缺血再灌注损伤的保护作用及机制研究[J].广西医科大学学报,2009,26(5):705-707.
[11] 莫书荣,连芳.诺迪康对心脏活动的药理学作用[J].广西医科大学学报,2002,19(1):52-53.
[12] 李向辉.诺迪康胶囊配合中药治疗慢性疲劳综合征50例[J].四川中医,2007,25(3):57-58.
[13] 金杰,古春青,陈海燕.诺迪康胶囊治疗慢性疲劳综合征55例临床研究[J].河南中医学院学报,2009,24(1):38-39.
[14] 吴新正,何迎春,刘红萍,等.红景天复方制剂对小鼠抗运动性疲劳的作用及机制研究[J].现代检验医学杂志,2008,23(2):73-75.
[15] 耿欣,汲晨锋,季宇彬.红景天苷对运动疲劳大鼠红细胞膜的影响[J].中药药理与临床,2008,24(1):49-51.
[16] 仇宏涛.运动性疲劳模型建立的分类研究[J].福建体育科技,2010,29(3):39-40.
[17] 曹犇.木枣多糖抗小鼠运动疲劳的实验研究[J].食品科学,2008,29(9):571-574.
[18] 赵春,张雪辉.红雪茶混合物对小鼠抗疲劳作用的研究[J].云南中医中药杂志,2005,26(4):27-30.
[19] 高丽杰,杨丽君,黄志强.丹参总提物抗运动性疲劳作用研究[J].中国中医基础医学杂志,2011,17(9):966-970.
