Walker256胫骨癌痛模型大鼠的脾脏T淋巴细胞功能评价
2014-08-14杜俊英陈宜恬吴赛飞房军帆方剑乔
杜俊英,梁 宜,陈宜恬,吴赛飞,王 虎,房军帆,方剑乔
(浙江中医药大学第三临床医学院针灸神经生物学实验室,杭州 310053)
机体的免疫功能与肿瘤的发生发展有密切关系,已有研究认为人体免疫功能低下或被抑制时,肿瘤发病率增高,而在肿瘤进行性生长中,肿瘤患者的免疫功能受抑制,两者互为因果,双方各因素的消长对肿瘤的发展起着重要的作用[1]。Walker-256胫骨癌痛模型是一种国内外比较公认的研究癌症镇痛药物的实验模型[2]。有关此模型的免疫功能变化目前未见有报道,本文观察Walker256胫骨癌痛大鼠模型,观察其T淋巴细胞增殖功能、T淋巴细胞及其亚群占脾脏淋巴细胞的含量变化,致力于明确Walker256肿瘤细胞是否适合免疫调节药物抗肿瘤作用的研究。
1 材料和方法
1.1 实验动物及实验环境
选用清洁级雌性健康SD大鼠41只(实验动物生产许可证号:SCXK(沪)2013-0016),体重(160±20)g,购自中国科学院上海实验动物中心,由浙江中医药大学实验动物中心饲养。饲养期间给予啮齿类动物标准颗粒饲料(由实验动物中心提供),及自由饮水,12 h循环灯光,恒定湿度,室温23℃±2℃。实验动物使用许可证号:SYXK(浙)2013-0184。本实验所有操作均符合中华人民共和国《实验动物管理条例》。
1.2 仪器与试剂
RPMI 1640(11875-119,美国Gibco);特级胎牛血清(30044184,美国Gibco);Walker-256肿瘤细胞(3111C0001CCC000316,北京北纳创联生物技术研究院);青霉素-链霉素溶液(100X)(C0222,碧云天生物技术研究所);青霉素(国药准字H36020261,江西东风药业股份有限公司);CCK-8试剂盒(C0038,碧云天生物技术研究所);流式细胞术所用试剂均采购自美国eBioscience公司;盐酸吗啡注射液(C81004-2,东北制药集团公司沈阳第一制药厂),其余试剂均为市售分析纯级。动态足底测量仪(意大利UgoBasile)、足底热辐射仪(意大利UgoBasile)、全波长酶标仪(美国Molecular Devices公司)、BD FACS Canto ll流式细胞仪(美国BD公司)、洗板机(美国Bio-Rad公司、韩氏穴位暨神经刺激仪(北京华卫产业开发公司)。
1.3 骨癌痛模型制备
胫骨癌痛大鼠模型制备参造Medhurst等[3]的实验方法,大鼠10%水合氯醛(0.35 mL/100g)腹腔麻醉,仰卧位,左后肢备皮、皮肤消毒,胫骨上段切1 cm口,暴露胫骨头,9号针头于胫骨结节下外5 mm处与胫骨呈30℃~45℃角朝尾侧进针钻洞,微量注射器抽取Walker-256肿瘤细胞悬液10 μL(1×107cells/mL)注入胫骨骨髓腔,保持2 min拔出针头,无菌骨蜡快速封闭针孔,无菌生理盐水冲洗,皮肤缝合,肌内注射20万单位青霉素防感染。
1.4 分组与处理
本次实验分两批进行,第一批实验大鼠(共16只)完全随机分为PBS组和模型组,用于观察实验动物造模前(基础)、造模后4、6、8、10、12、14、16、18、20 d十个时间点的机械缩腿阈、热辐射刺激潜伏期和自发性疼痛的变化情况。第二批实验大鼠(共25只)完全随机分为空白对照组、PBS组和模型组,用于观察造模后20 d大鼠脾脏细胞T淋巴细胞增殖功能,T淋巴细胞及其亚群占脾脏淋巴细胞的含量。
1.5 指标检测
1.5.1 行为学观察:我们动态观察了各组大鼠造模前(基础)、造模后4、6、8、10、12、14、16、18、20 d十个时间点机械缩腿阈、热辐射刺激潜伏期和自发性疼痛。
1.5.1.1 机械缩腿阈:测量前,将实验大鼠置于塑料盒内,待大鼠安静后(停止梳理毛发和探索性活动),将类似Von Frey丝的金属丝(φ0.5mm)置于大鼠患侧足中央,避开足垫,启动“START”按钮,金属丝即自动上抬,刺激力量以2.5 g/sec的速率递增(Ramp=20 sec),直至大鼠缩腿,仪器自动记录当时的刺激力量。连续测量4次,取其平均值,每次间隔3 min。50 g为最大刺激力量,以免大鼠足爪受损。
1.5.1.2 热辐射刺激潜伏期:操作方法与测量机械缩腿阈相似。测量前,将大鼠置于透明塑料盒中。待大鼠安静后(停止梳理毛发和探索性活动),将聚焦的红外热源置于大鼠患侧足中央,避开足垫,启动“START”按钮对足底进行热刺激,仪器自动记录大鼠缩足反应时的潜伏期。连续测量3次,每次间隔5 min。20 s是热辐射刺激时间最上限,30 s为最大热辐射强度。
1.5.1.3 自发性疼痛评价:根据大鼠自由活动时后肢使用以及跛行程度,分别给予0-3级评分。0分:正常行走;1分:后肢跛行,但不是很显著,使用正常;2分:介于1和2分之间;3分:后肢行走时不着地。
1.5.2 生化指标:
1.5.2.1 脾脏淋巴细胞提取:造模后20 d,各组实验大鼠10%水合氯醛腹腔麻醉(0.35 mL/100g),75%酒精擦拭腹部皮肤,取出脾脏,称重后置于抗生素生理盐水(青霉素G 10000 U/mL、链霉素10000 μg/mL)中浸泡20 min,将脾脏置于200目不锈钢网筛上,剪碎脾脏后进行研磨,期间加PBS(灭菌)湿润。获得的细胞悬液加入3~5倍细胞体积的红细胞裂解液(碧云天),轻轻吹打混匀,裂解1~2 min,1 000 r/min离心5 min,去上清液。获得的细胞悬液加5倍体积RPMI 1640(10%胎牛血清、100 U/mL青霉素,100 U /mL霉素),轻轻混合,1 000 r/min离心3 min,弃去上清液,重复两次。清洗后的细胞加RPMI 1640(10%胎牛血清、100 U/mL青霉素,100 U /mL链霉素)完全培养基重悬,调整浓度为1×106/mL的细胞悬液待用。
1.5.2.2 Cell Counting Kit-8(CCK-8)法检测大鼠脾脏T淋巴细胞的增值能力:取96孔细胞培养板,四周加200 μL PBS(灭菌)以防液体挥发,各孔加入180 μL细胞悬液(大约2×105个),并给予20 μL ConA刺激(终浓度10 μg/mL)作为反应孔,以相同体积不加ConA刺激的细胞悬液为空白孔,以200 μL细胞培养液为control,分别做3个复孔,细胞培养箱内培养72 h。各孔加入20 μL 2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐(WST-8)溶液,在细胞培养箱内孵育1 h,用全波长酶标仪在450 nm、650nm波长下检测其A值。细胞活性%=反应孔 A值/空白孔A值*100。
1.5.2.3 流式细胞术检测大鼠脾脏CD3+、CD4+、CD8+的含量:收集、洗涤细胞调整细胞悬液浓度为1~5×106cell/mL,取100 μL细胞加入标记的一抗(1 μL CD3 FITC,1.25 μL CD4 APC,0.625 μL CD8 PE),4℃孵育30 min(避光)。加100 μL 1%多聚甲醛,4℃孵育15 min(避光)。1 mL冰冷PBS重悬细胞,1 200 r/min离心5 min,弃上清液,重复3次。加500 μL冰冷PBS重悬细胞,进行流式检测。control管:细胞+同等剂量PBS,不加一抗,其余步骤相同。同型对照管:细胞+荧光标记的同型IgG,其余步骤相同。单阳对照管:细胞+一种荧光标记的抗体,其余步骤相同。BD FACS Canto ll流式细胞仪检测和分析。
1.6 统计学方法
2 结果
2.1 骨癌痛大鼠机械缩腿阈变化情况
我们采用足底动态测量仪检测各组大鼠患侧足跖造模前(基础)、造模后4、6、8、10、12、14、16、18、20 d的机械缩腿阈。从表1中可以看到,造模前,PBS组和模型组大鼠基础机械缩腿阈比较差异无显著(P>0.05)。造模后4、6、8、10、12、14、16、18、20 d各时间点,模型组大鼠机械缩腿阈明显小于PBS组大鼠(P<0.05或P<0.01)。
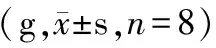
表1 各组大鼠机械缩腿阈变化情况

表2 各组大鼠热辐射刺激潜伏期变化情况

表3 各组大鼠自发性疼痛变化情况
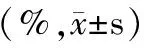
表4 各组大鼠脾脏T淋巴细胞及其亚群含量变化情况
2.2 骨癌痛大鼠热辐射刺激潜伏期变化情况
我们还采用热辐射法检测了各组大鼠患侧足跖造模前(基础),造模后4、6、8、10、12、14、16、18、20 d的热辐射刺激潜伏期,结果如表2 所示。造模前,PBS组和模型组大鼠的基础热辐射刺激潜伏期比较差异无显著意义(P>0.05)。造模后4 d和6 d,模型组大鼠热辐射刺激潜伏期有一定的下降,但与PBS组大鼠比较无统计学意义(P>0.05)。至造模后8 d和10 d,模型组大鼠热辐射刺激潜伏期明显小于PBS组大鼠(P<0.05)。到造模后12 d至整个实验结束(造模后20 d),模型组大鼠热辐射刺激潜伏期和PBS组比较均差异无显著性(P>0.05)。
2.3 骨癌痛大鼠自发性疼痛变化情况
另外,我们还观察了造模前(基础)、造模后4、6、8、10、12、14、16、18 d和20 d十个时间点,各组大鼠患侧足跖自发性疼痛的变化。如表3所示,造模前,PBS组和模型组大鼠患侧足跖无自发性疼痛。造模后4 d至14 d,PBS组和模型组大鼠患侧足跖出现自发性疼痛,模型组大鼠的自发性疼痛明显高于PBS组(P<0.01)。造模后16 d,PBS组大鼠患侧足跖已恢复正常,无自发性疼痛行为;模型组大鼠患侧足跖仍具有自发性疼痛,明显高于PBS组大鼠(P<0.01)。
2.4 骨癌痛大鼠脾脏T淋巴细胞增殖能力变化情况
模型组大鼠脾脏T淋巴细胞的增殖能力(104.03±7.47)明显低于空白对照组(124.87±10.74)和PBS组(125.57±7.07)大鼠(P<0.05)。
2.5 骨癌痛大鼠脾脏T淋巴细胞及其亚群含量变化情况
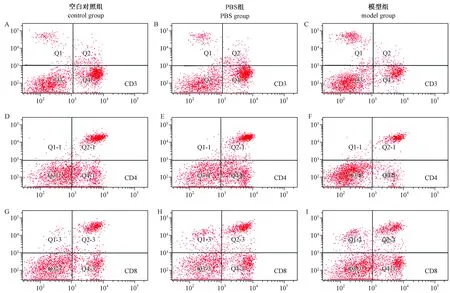
注:图A-I分别是空白对组CD3含量、PBS组CD3含量、模型组CD3含量、空白对组CD4含量、PBS组CD4含量、模型组CD4含量、空白对组CD8含量、PBS组CD8含量、模型组CD8含量
如表4,图1所示,模型组大鼠脾脏T淋巴细胞(CD3)、及其亚群(CD4和CD8)的含量均少于空白对照组和PBS组大鼠,但仅CD8的含量明显少于空白对照组大鼠(P<0.05)。
3 讨论
本实验所采用的胫骨内注射Walker-256肿瘤细胞建立的胫骨癌痛模型是国内外的用于研究骨癌痛机制的常见模型之一[4, 5]。Mao-Ying等[4]比较两种浓度(4×105和4×103)的Walker-256肿瘤细胞胫骨内注射制备的骨癌痛中观察到,不同浓度的Walker-256肿瘤细胞胫骨内注射均能导致模型大鼠双侧足跖机械痛觉异常和自发性疼痛的产生,但未观察到明显的热痛觉异常;同时4×105组比4×103组先出现机械痛觉异常,于造模后4 d即观察到双侧机械痛阈明显下降。我们的结果与Mao-Yin相似,造模后4 d,模型组大鼠患侧机械痛阈明显下降、出现显著的自发疼痛现象;并且在整个实验的各个时间点,模型组大鼠的机械痛阈和自发性疼痛评分均显著低于空白对照组和PBS组。有关热痛觉异常方面,我们的结果与Mao-Yin不一致,我们观察到,模型组在造模后8、10、12 d这三个时间点时,其热辐射刺激潜伏期明显低于空白对照组和PBS组;其他各个时间点的热辐射刺激潜伏期与空白对照组和PBS组比较无显著差异。另有学者[5]采用胫骨内注射4×104个Walker-256肿瘤细胞观察期热痛阈变化情况中发现,骨癌痛模型的热痛阈于造模后12 d显著下降,并且在于造模后15 d、18 d和21 d时模型组的热痛阈均显著小于PBS组。
T淋巴细胞简称T细胞,来源于骨髓中的淋巴样前祖细胞,在胸腺中发育成熟。成熟的T细胞只能表达CD4或CD8分子,即CD4+T细胞或CD8+T细胞。CD4和CD8分子的主要功能是辅助TCR识别抗原和参与T细胞活化信号的转导。CD4+T细胞和CD8+T细胞的功能彼此不同。CD4+T细胞细胞识别由13~17个残基组成的外源性抗原肽,受自身MHC II类分子的限制。活化后,分化的效应细胞主要为Th细胞,但也有少数CD4+效应T细胞具有细胞毒作用和免疫抑制作用。而CD8+T细胞识别8~10个残基组成的内源性抗原肽,受自身MHC I类分子的限制。活化后,分化的效应细胞为Tc(CTL)细胞,具有细胞毒作用,可特异性杀伤靶细胞。尽管仍有争议,但是越来越多的研究表明免疫系统能够识别和消除初期肿瘤, CD4+T细胞和CD8+T细胞是重要的免疫监视介质[6]。由于肿瘤细胞较少表达NHC II类分子,传统认为CD8+T细胞被认为是抗肿瘤免疫的主要T细胞,而CD4+T细胞在肿瘤免疫中的主要作用为辅助CD8+T细胞的活化[7-9]。但是,也有文献报道,CD4+T细胞可直接对肿瘤产生细胞毒作用[10, 11],且在无CD8+T细胞参与的情况下,CD4+T细胞也具有抑制肿瘤的作用的能力[12]。在CD4+T细胞缺失的情况下,CD8+细胞的抗肿瘤作用受限制[13, 14]。亦有研究报道,MHC I类限制性转基因小鼠,CD4+T细胞缺失的情况下,CD8+T细胞仍能保持抗肿瘤作用[15]。
我们本次的实验中,观察到Walker-256肿瘤细胞可以降低外周脾脏T淋巴细胞的增殖能力,减少T淋巴细胞及其亚群的含量,尤以CD8+T淋巴细胞含量的减少为甚。CD8+T细胞作为抗肿瘤的主要细胞之一,所以我们认为,Walker-256致骨癌痛模型可以抗肿瘤免疫药物研究的模型之一。
参考文献:
[1] 文亚平, 高丽华, 黎明.肿瘤与免疫系统的相互作用及肿瘤免疫治疗新策略[J]. 中国肿瘤, 2011, 2:103-107.
[2] 李晓青, 孙玉明, 黄章翔,等. Walker256乳腺癌细胞构建大鼠胫骨骨癌痛模型[J]. 中国肿瘤生物治疗杂志, 2008, 15: 41-45.
[3] Medhurst S, Walker K, Bowes M, et al. A rat model of bone cancer pain[J]. Pain, 2002, 96:129-140.
[4] Mao-Ying QL, Zhao J,Dong ZQ, et al.A rat model of bone cancer pain induced by intra-tibia inoculation of Walker 256 mammary gland carcinoma cells[J]. Biochem Biophys Res Commun, 2006, 345:1292-1298.
[5] 严继贵, 童晔玲,何国浓, 等.应用 walker-256 细胞建立大鼠骨癌痛模型[J]. 中华中医药学刊, 2007, 25:1128-1130.
[6] Koebel CM, Vermi W, Swann JB, et al. Adaptive immunity maintains occult cancer in an equilibrium state[J]. Nature, 2007, 450:903-907.
[7] Antony PA, Piccirillo CA, Akpinarli A, et al. CD8+T cell immunity against a tumor/self-antigen is augmented by CD4+T helper cells and hindered by naturally occurring T regulatory cells[J].J Immunol, 2005, 174:2591-2601.
[8] Fujii H, Arakawa A, Utsumi D, et al. CD8(+) tumor-infiltrating lymphocytes at primary sites as a possible prognostic factor of cutaneous angiosarcoma[J]. Int J Cancer, 2014, 134:2393-2402.
[9] Chen Y, Ayaru L, Mathew S, et al.Expansion of anti-mesothelin specific CD4+and CD8+T cell responses in patients with pancreatic carcinoma[J]. PLoS One, 2014, 9:e88133.
[10] Noyan F, Lieke T, Taubert R, et al. Naive tumor-specific CD4(+)T cells were efficiently primed in acute lymphoblastic leukemia[J]. Scand J Immunol, 2014, 80: 161-168.
[11] Snook AE, Magee MS, Schulz S, et al. Selective antigen-specific CD4(+)T-cell, but not CD8(+) T- or B-cell, tolerance corrupts cancer immunotherapy[J]. Eur J Immunol, 2014, 44:1956-1966.
[12] Segal BM, Glass DD, Shevach EM. Cutting edge: Il-10-producing CD4+T cells mediate tumor rejection[J]. J Immunol, 2002, 168:1-4.
[13] Haabeth OA, Tveita AA, Fauskanger M, et al. How do CD4(+) T cells detect and eliminate tumor cells that either lack or express MHC class Ⅱmolecules?[J]. Front Immunol, 2014, 5:174.
[14] Boon T, Coulie PG, Van den Eynde BJ, et al. Human T cell responses against melanoma[J]. Annu Rev Immunol, 2006, 24:175-208.
[15] Hanson HL, Donermeyer DL, Ikeda H, et al. Eradication of established tumors by CD8+T cell adoptive immunotherapy[J]. Immunity, 2000, 13:265-276.
