猫疱疹病毒Ⅰ型实时荧光定量PCR方法的建立及初步应用
2014-08-14李晓波王淑菁巩薇岳秉飞贺争鸣
王 吉,卫 礼,付 瑞,李晓波,王淑菁,巩薇,岳秉飞,贺争鸣
(中国食品药品检定研究院 国家实验动物微生物遗传检测中心,北京 100050)
猫疱疹病毒I型(feline herpesvirus 1,FHV-1)又叫猫鼻气管炎病毒(feline rhinotracheitis virus),属疱疹病毒科,是有囊膜的双链DNA病毒。病毒直径约为128 nm~168 nm,能在猫胚肾、肺以及睾丸细胞培养物内良好增值和传代。该病毒能致发猫鼻气管炎病,猫是本病唯一的自然宿主,病猫是主要传染源,通过直接接触传播[1-2]。主要侵害仔猫,感染猫症状严重时,出现体温升高,明显的上呼吸道感染[1-4].猫鼻气管炎发病率可达100%,死亡率可达50%。病毒在病猫的鼻、咽喉、气管和支气管以及舌、结膜等的部位增殖。该病最早从美国发现,随后在拿大、英国、荷兰、瑞士、匈牙利、越南等地发现和流行,我国已多次发现可疑病例,并分离到病毒[3-6]。
猫作为实验动物在医学、生物学等研究领域的应用越来越广泛,在某些试验中,如降压实验、作为弱视动物模型及高眼压动物模型等具有不可替代的作用[7-9],目前在实验动物国家标准及地方标准中,均没有对实验用猫的检测要求及相关规定[10]。
本实验旨在建立特异、敏感、快速、定量准确的FHV-1实时荧光定量PCR检测方法,通过分子生物学手段,开展对猫携带FHV-1核酸的检测。对今后开展实验用猫的检测工作及实验猫标准化研究具有积极的促进作用,同时通过对猫疱疹病毒携带情况的检测,为猫质量控制标准的制定提供参考依据。
1 材料和方法
1.1 病毒及样品
猫疱疹病毒I型(FHV-1)、猫细小病毒 (又称猫泛白细胞减少症)(feline panleukopenia virus, FPV):购自美国ATCC公司,编号分别为(VR-636、VR-652);单纯疱疹病毒I型(herpes simplex virus 1,HSV-1)、犬疱疹病毒(canine herpesvirus ,CHV)、猪伪狂犬病毒(porcine pseudorabies virus,PRV):由中国食品药品检定研究院 实验动物质量检测室提供;pGEM-T Easy-pol质粒标准品:委托宝生物工程(大连)有限公司合成;pGEM T Easy质粒(Promega公司):宝生物工程(大连)有限公司;33只猫的48份样品(眼分泌物、鼻分泌物、眼和鼻分泌物)来源于国内7个单位。
1.2 主要试剂
DNA快速提取试剂盒购自德国Qiagen公司;Taq HS酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、10× PCR buffer、100 bp DNA marker均购自宝生物工程(大连)有限公司;pGEM-T Easy-pol质粒标准品:委托宝生物工程(大连)有限公司合成;pGEM T Easy质粒(Promega公司):宝生物工程(大连)有限公司;10× Q-PCR MIX:美国ABI公司。PCR仪:美国Bio-Rad公司MyCycler;核酸琼脂糖凝胶电泳仪:美国Bio-Rad公司PwerPac Basic;凝胶成像分析仪:美国 Kodak公司 GL212Pro;荧光定量PCR仪:美国ABI公司7500 Fast Real-Time PCR System.。
1.3 标准阳性质控品的制备
设计1对扩增TK基因保守区域的引物:P-1F:ATACTGTCCGCATTTACATAGA;P-1R:CGGTTCTTGAGCGTCCC。扩增片段长531 bp (66442~66972 nt)。该片段包含了探针及其引物所要扩增和检测的片段。将该产物纯化后连接到pGEM-T Easy载体,并进行克隆。阳性克隆通过测序进行鉴定。培养阳性克隆菌并提取质粒,用核酸蛋白分析仪测定A260nm和A280nm,并计算提取的质粒含量,质粒置-20℃保存备用[11,12]。
1.4 TaqMan探针及引物的设计
将不同株FHV-1病毒序列进行比对,选择TK基因(序列号:FJ478159)保守区域[6、11],采用ABI PrimerExpress 3.0实时荧光定量PCR引物设计软件,设计合成TaqMan探针及引物。探针的荧光标记选择FAM(5’端)作为报告发光基团, NFQ(3’端)为淬灭基团,探针和引物由美国ABI公司合成。序列如下(表1):

表1 用于扩增TK基因的引物与TaqMan探针序列
1.5 实时荧光定量PCR扩增体系及标准曲线的建立
通过优化在荧光定量PCR反应体系中使用的探针、引物、10× Q-PCR MIX浓度,确定最佳反应体系为10× Q-PCR MIX 10 μL,探针+引物1 μL, DNA 1 μL,补水至20 μL。确定最佳反应条件为:50℃保持2 min;然后95℃预变性10 min;最后95℃ 15 s,60℃ 1 min,共40个循环,在每个循环的延伸结束时进行荧光信号检测。在96孔板中按以下体系加样,每个样品做三个重复。
用含有目的片段的质粒pGEM-T Easy-pol作为标准品,根据公式copies/μL=(6.02 × 1023)×(ng/μL × 10-9)/(DNA length × 660),算出质粒标准品拷贝数。将其稀释为109copies~100copies,作为模板进行实时荧光定量PCR反应,建立标准曲线[12,13]。

Query:测序结果;sbjct:FHV-1文献序列
1.6 实时荧光定量PCR检测方法的特异性、重复性和稳定性检测
设定FHV-1、FPV、HSV-1、CHV、PRV及CRFK阴性对照,检测FHV-1实时荧光定量PCR检测方法的特异性;用实时荧光定量PCR检测方法对105copies/μL、104copies/μL、103copies/μL 3个不同浓度阳性标准品,分3个不同时间重复检测3次,计算批间变异系数,评价本方法的重复性和稳定性。
1.7 实时荧光定量PCR检测方法灵敏性检测
取109~100copies标准品,进行实时荧光定量PCR 检测,每个浓度标准品各做3个复孔。所能检测的最小浓度梯度的循环阈值(CT)≥35,拷贝数(copies)≥10时,此浓度为方法的检测灵敏度。
1.8 实时荧光定量PCR方法的应用
实时荧光定量PCR检测,48份样品分2次检测,第1次检测b1~b15,第2次检测y1~y15、yb56、yb64、yb65、x16、x18、x19、x24、x28、x29、x38、x40、x41、x44、x46、x47、x56、x57、x63。每次设107~103copies标准品和CRFK细胞阴性对照。标准品、阴性对照及样品均做3个重复。
判断标准的制定:建立的标准曲线参数Slope在-3~-3.5之间、R2大于0.99、Eff%在90%-110%之间,实验成立可用于定量检测。
样品循环阈值(CT)≥35,同时拷贝数(copies)≥10,判定该样品检测结果为阳性;循环阈值(CT)≥35、拷贝数(copies)<10,或者循环阈值(CT) <35、拷贝数(copies)≥10,或者循环阈值(CT) <35、拷贝数(Copies)<10,此样品超出检测限,不能确定被检样品是阳性样品,结果判为阴性[12,13]。
2 实验结果
2.1 标准阳性质控品的制备
阳性克隆经测序进行鉴定,测序结果与GenBank中FHV-1标准株核苷酸序列进行比对,其同源性均为100%,见图1。说明成功制备了阳性质粒标准品,可作为荧光定量PCR检测的标准对照品。
经拷贝数计算公式copies/μL=(6.02 × 1023)×(ng/μL × 10-9)/(DNA length × 660)计算,质粒标准品原浓度为2.55× 1011copies/μL。
2.2 实时荧光定量PCR扩增体系及标准曲线的建立
对引物及探针浓度进行优化后,得到FHV-1扩增曲线结果如图2。FHV-1的循环阈值CT值为14.023,拷贝数为2.597×107copies/μL。
用含有目的片段的质粒标准品,分别设为1.0×109、1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102copies/μL,作为模板进行实时荧光定量PCR反应,扩增曲线如图3。扩增曲线各稀释梯度间距均匀,线性范围1个log(1×102~1×109拷贝),标准曲线相关系数Slope为3.23(在-3~-3.5之间),R2值为0.997(>0.99)说明相关性高,定量结果有效,扩增效率Eff为103.418%(90%~110%之间)。标准品及待测样本三个重复的标准差(CTSD值)均小于0.232,说明定量结果精密度高,具有很好的重复性。建立的标准曲线参数远优于标准的规定范围,可用于定量检测。

图2 FHV-1Q-PCR扩增曲线

图3 109~102 copies标准品扩增曲线
2.3 实时荧光定量PCR检测方法的特异性、准确性和稳定性检测结果
2.3.1 实时荧光定量PCR检测方法特异性检测:分别以FHV-1、FPV、HSV-1、CHV、PRV及CRFK细胞为模板进行检测,结果如图4所示,可以看出以FPV、HSV-1、CHV、PRV为模板,扩增曲线均为直线无扩增,阴性对照CRFK细胞也为直线无扩增,而以FHV-1为模板扩增曲线明显。说明建立的荧光定量PCR检测方法具有良好的特异性。
2.3.2 实时荧光定量PCR方法重复性和稳定性检测结果:起始浓度分别为1×105copies/μL、1×104copies/μL、1×103copies/μL的标准品的最终实测值的均值分别为0.991×103、1.060×104、1.005×105copies/μL,对应CTSD值及CV值分别为见表2。3个浓度梯度3次重复实验Ct值的变异系数(CV)均小于5%,表明方法重复性、稳定性良好。

1:FHV-1;2-6: FPV、HSV-1、CHV、PRV、CRFK
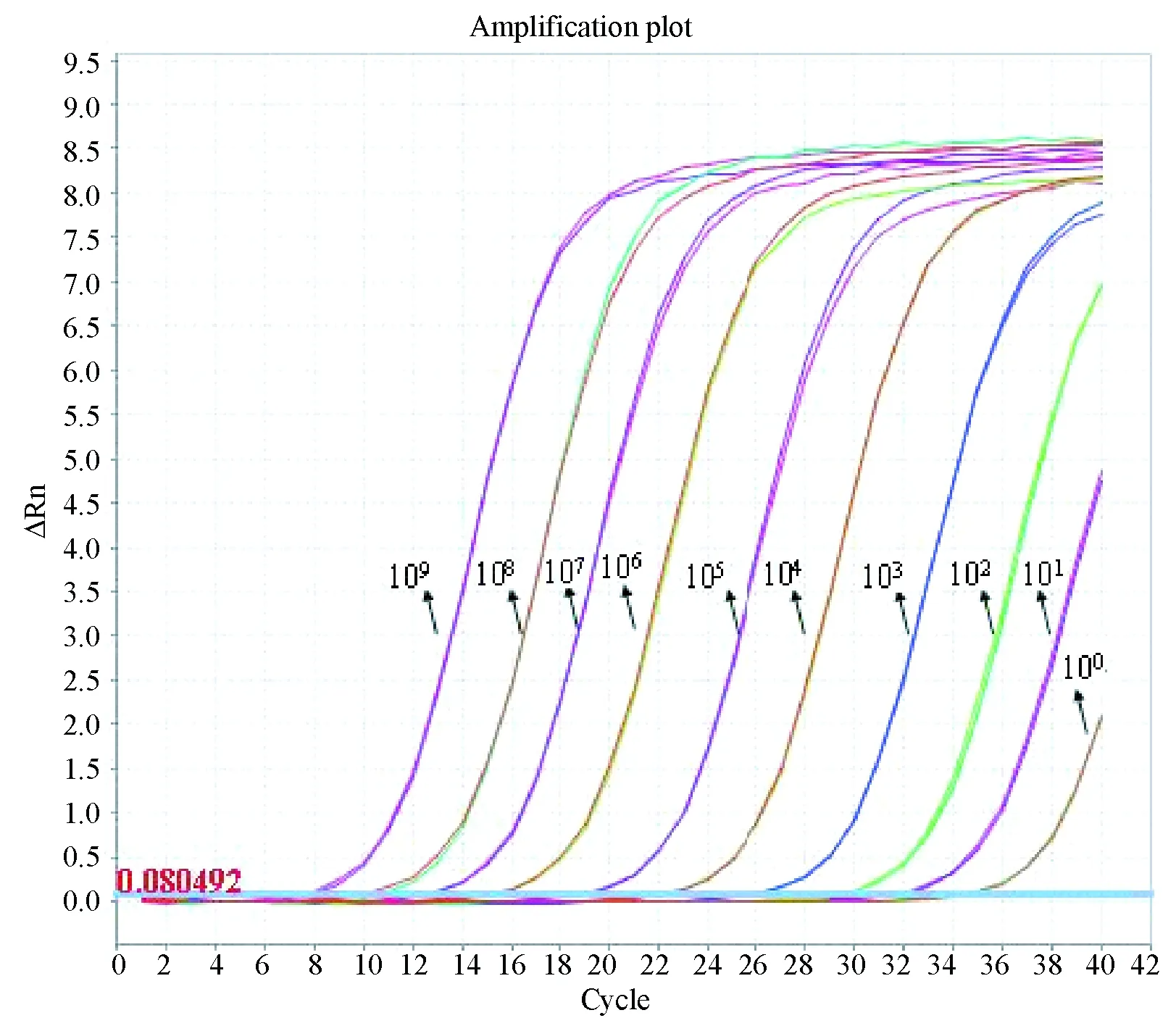
图5 109~100 copies标准品的扩增曲线
表2荧光定量PCR检测方法的重复性和稳定性试验结果
Tab.2The results of repeatability and stability test of the Q-PCR
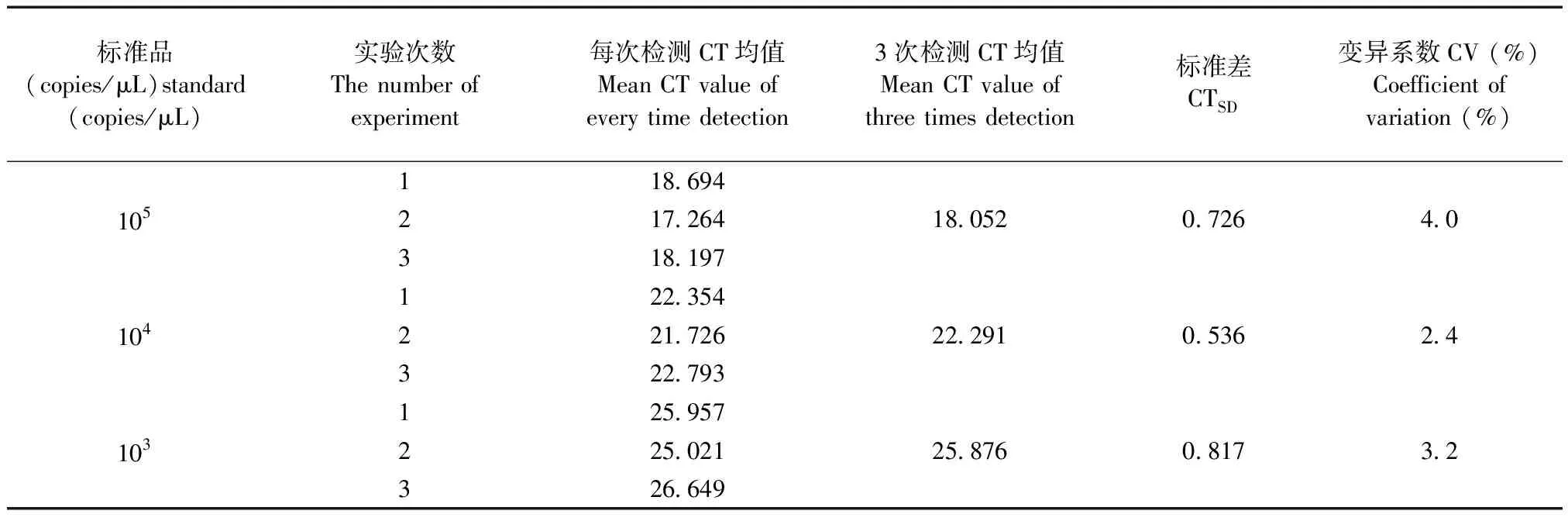
标准品(copies/μL)standard(copies/μL)实验次数The number of experiment每次检测CT均值Mean CT value of every time detection 3次检测CT均值Mean CT value of three times detection标准差CTSD变异系数CV (%)Coefficient of variation (%)118.694105217.26418.0520.7264.0318.197122.354104221.72622.2910.5362.4322.793125.957103225.02125.8760.8173.2326.649
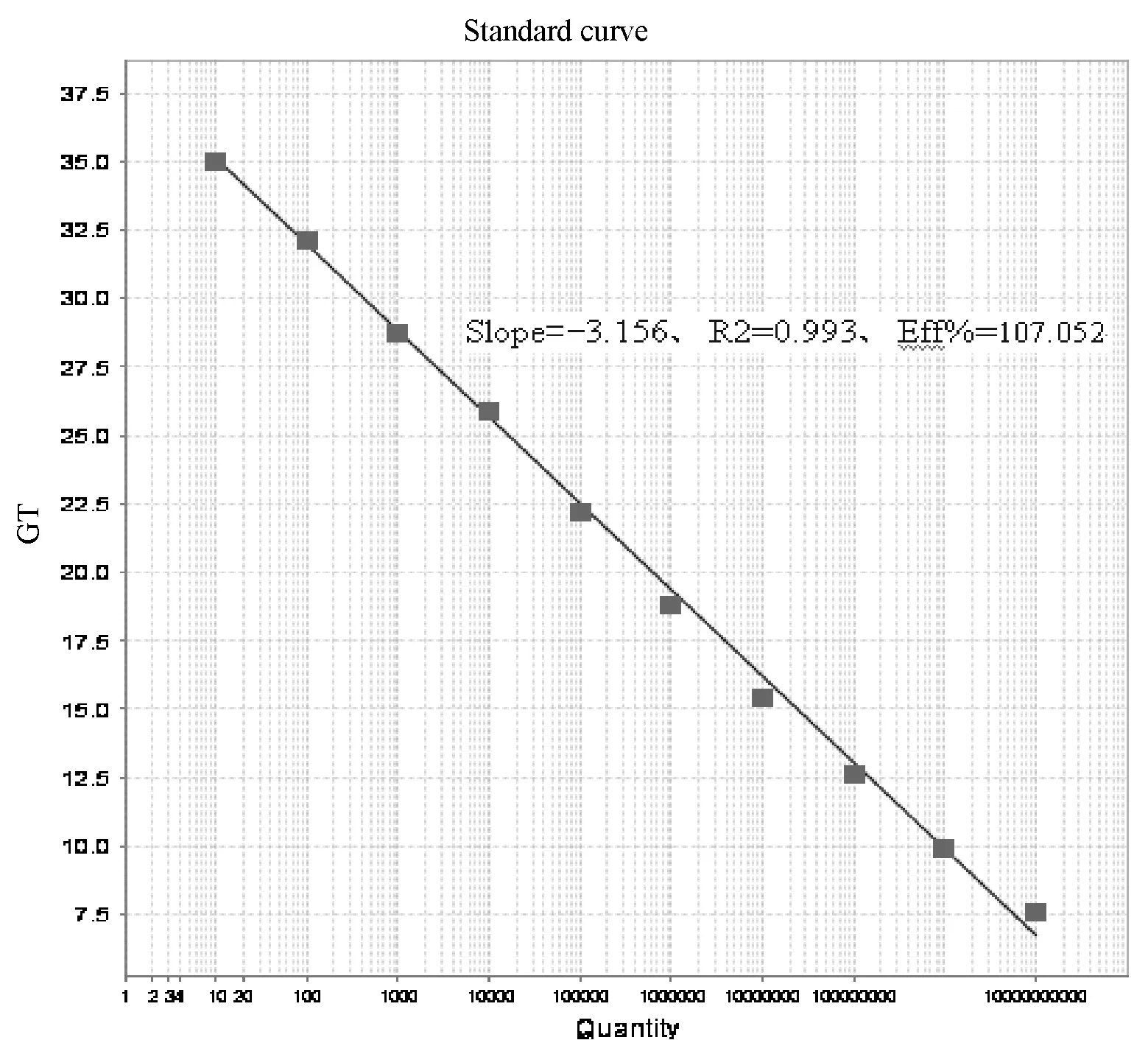
图6 109~100 copies标准品的标准曲线
2.4 荧光定量PCR检测方法灵敏度检测
如图5、图6可知,扩增曲线各稀释梯度间距均匀,线性范围 (1×100~1×109copies/μL),良好。标准曲线斜率Slope为-3.156、相关系数R2值为0.993(>0.99),扩增效率Eff%为107.052%(90%-110%之间)。标准品稀释到1.0×101copies/μL时有明显扩增曲线,CT值为31.856,拷贝数为10.23 copies,仍在可信范围之内; 1.0×100copies/μL时有扩增曲线,CT值为34.705,拷贝数为1.121 copies,已超出可信范围。所以临界稀释度为1.0×101时,其对应的拷贝数为10,因此最低检测限度为10个拷贝/μL。说明建立的荧光定量PCR方法有很高的灵敏度。

图7 1~15号猫鼻分泌物(b1~b15)扩增曲线
2.5 实时荧光定量PCR方法的应用
将所建立的实时荧光定量PCR方法用于33只猫的48份样品检测,得到扩增曲线如图3-7为b1~b15扩增曲线;图8为y1~y15扩增曲线;图9为yb56、yb64、yb65、x16、x18、x19、x24、x28、x29、x38、x40、x41、x44、x46、x47、x56、x57、x63扩增曲线。2次检测标准品扩增曲线分别为 图10、图11,标准曲线相关系数Slope分别为3.19、3.27(均在-3~-3.5之间),R2值分别为0.996、0.994(均>0.99),扩增效率Eff分别为105.127%、101.639(均在90%-110%之间)。
经过荧光定量PCR检测b3、b4、b5、b6、b7、b8、b11~b15,y4、y5、y6、y7、y11~y15,yb56、yb64、yb65、x16、x19、x24、x28、x38、x41、x47、x56、x57、x63的循环域值(Ct值均≥35)和拷贝数(copies均≥10)均在检测限之内,所以判定上述样品为荧光定量检测阳性。其他15份样品或循环域值(CT)超出检测限,或扩增拷贝数小于检测限,或同时在检测限之外,所以均判为阴性(样品检测结果见表3)。48份样品检测结果阳性率为(33/48)68.75%,33只猫经检测FHV-1阳性率为(23/33)69.70%。
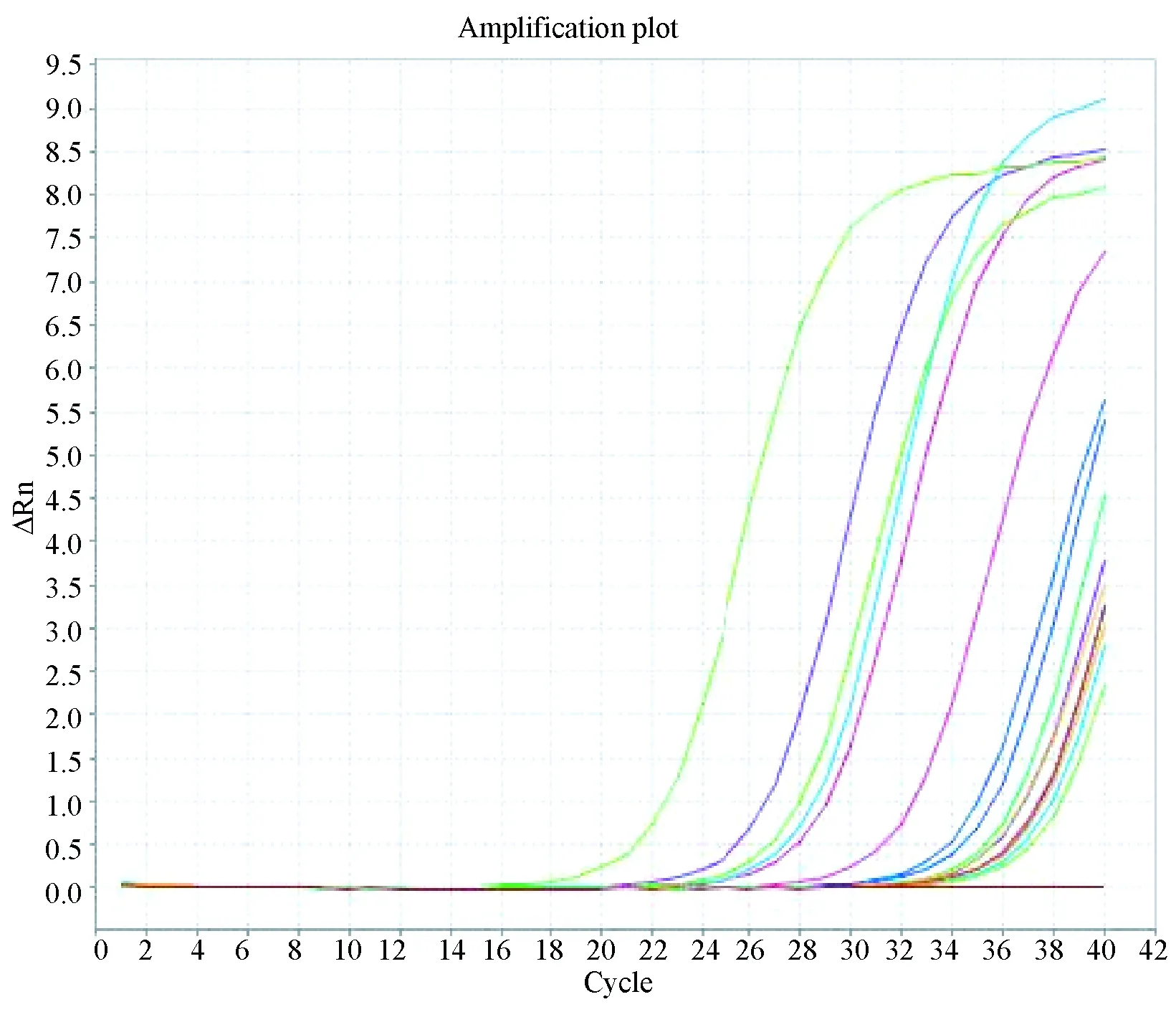
图8 1~15号猫眼分泌物(y1~y15)扩增曲线

图9 3只猫眼鼻分泌物和15份血清扩增曲线
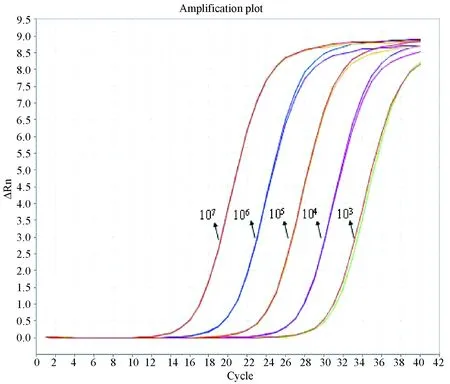
图10 第一次检测的标准品扩增曲线

图11 第二次检测的标准品扩增曲线
3 讨论
猫可较好的耐受麻醉和一般手术,手术时能保持正常血压。在药品的降压物质检查中,猫作为中国药典规定的实验动物[10,15],越来越多的被用于形觉波剥夺性弱视、食管病等研究[16,17]。猫作为实验动物,虽然应用越来越广泛[18-20],但国内目前尚未见有开展猫的检测。虽然早在1999年,蒋虹等[21]就建立过猫鼻气管炎病毒血清学检测方法,2011年前刘宝山、林颖、屈哲[22-24]先后建立了FHV-1 PCR检测方法,但都没有推广开来,实验用猫到目前为止也没有标准化规定。目前,实验用猫也多是从商贩或收购型饲养场购买,其来源混杂,遗传、年龄、微生物和寄生虫等携带情况不清,实验重现性差,结果隐存着未知因素的影响[15]。FHV-1是目前已知最重要的猫呼吸道疾病之一,其发病率和死亡率均较高,严重危害猫的健康。目前国内还没有开展猫疱疹病毒等猫易感病毒临床检测的机构,仍未见有开展实验用猫FHV-1检测的报道,国内也没有相关检测试剂盒的出售。
近年来,实时荧光定量PCR (real-time fluorescent quantitative PCR, FQ-PCR) 技术以其灵敏度高、速度快、特异性强等优点在基因表达水平分析、突变和多态性研究、病原体的定性和定量检测等方面得到广泛应用[12-14]。该方法提供了用于对FHV-1进行实时荧光定量PCR检测的引物和TaqMan探针,以实现猫FHV-1核酸的定量检测,提高检测的特异性和准确性。

表3 荧光定量PCR方法检测48份样品结果
实验所建立的TaqMan探针实时荧光定量PCR方法,以重组质粒为标准品,扩增曲线各稀释梯度间距均匀,线性范围8个log(102~109拷贝)定量范围宽,标准曲线相关系数R2值均为>0.99,说明相关性高定量结果准确。建立的标准曲线参数(Slope均在-3~-3.5之间、R2均大于099、Eff%均在90%~110%之间)均在规定范围之内,优于标准。经特异性检测与猫细小病毒、单纯疱疹病毒1型、犬疱疹病毒及猪伪狂犬病毒均无交叉反应,证明方法特异性良好。经灵敏度检测,标准品稀释到101时仍有扩增曲线,最低可检测到10拷贝/μL。对起始浓度分别为1×103、1×104、1×105拷贝/μL的标准品进行重复测定, CT值变异系数均小于5%。说明此方法具有较好的准确性和重复性[12-14]。
用荧光定量PCR技术检测FHV-1,目前在国内尚未有报道。本研究对引物和探针的浓度及反应条件进行优化,建立了特异、敏感的FHV-1快速定量检测方法。对猫的检测结果显示,该方法检测的33只猫,阳性率为69.70%(23/33),明显高于本室建立的常规PCR(阳性率63.64(21/33))检出率。但从检测成本考虑,荧光定量PCR检测成本稍高于常规PCR。实验建立的FHV-1荧光定量PCR方法为进一步研究FHV-1在猫群中的流行情况及对猫的感染机制及其致病机制奠定了基础。为实验用猫的质量控制及标准的制定提供了科学参考依据。
参考文献:
[1] 殷震, 刘景华. 动物病毒学(第2版)[M]. 北京: 科学出版社, 1997: 1048-1051.
[2] 田克恭. 实验动物病毒性疾病 [M]. 北京: 中国农业出版社, 1992: 232-237.
[3] Henzel A, Brum MC, Lautert C, et al. Isolation and identification of feline calicivirus and feline herpesvirus in Southern Brazil [J]. Braz J Microbiol, 2012 ,43(2): 560-568.
[4] Nakamura K, Ikeda Y, Miyazawa T, et al. Comparison of prevalence of feline herpesvirus type 1, calicivirus and parvovirus infections in and leopard cats in Vietnam [J]. J Vet Med Sci, 1999, 61(12): 1313-1315.
[5] 黄明. 猫传染性鼻气管炎研究进展 [J]. 山东畜牧兽医, 2013, 34(9): 80-82.
[6] 张硕, 李纯玲, 汪葆月, 等. 猫疱疹病毒I型的分离与鉴定 [J].实验动物科学, 2010, 27 (2):21-25.
[7] 刘继峰, 谷昱, 白玉, 等. 虎皮猫用于MZR降压物质的检查 [J]. 实验动物科学, 2009, 26(2): 33-35.
[8] 化志鹃, 江春光. 左旋多巴对形觉剥夺性弱视幼猫图形视觉诱发电位的影响 [J]. 昆明医学院学报, 2010, 31(5): 12-16.
[9] 刘文舟, 罗向霞, 段俊国, 等. 家猫高眼压模型的建立及特征分析 [J]. 国际眼科杂志, 2009, 9(10): 1881-1884.
[10] 国家药典委员会. 中华人民共和国药典(2010年版二部)[M]. 北京: 中国医药科技出版社, 2010:附录ⅪG: 103.
[11] Jack HN, Deann KW, Georgette EC ,et al. Identification of the thymidine kinase gene of feline herpesvirus: use of degenerate oligonucleotides in the polymerase chain reaction to isolate herpesvirus gene homologs [J]. J Virol. 1989, 63(8): 3240-3249.
[12] 张荣建. 猴腺病毒检测方法的建立与初步应用 [D]. 北京: 中国食品药品检定研究院, 2012.
[13] 栗景蕊. 猴泡沫病毒(SFV)检测方法的建立与初步应用 [D]. 北京: 中国食品药品检定研究院, 2010.
[14] 冯育芳, 李晓波, 邢进, 等. 猴副流感病毒5型实时荧光定量PCR方法的建立与初步应用 [J]. 中国比较医学杂志, 2013, 23(10): 40-43.
[15] 刘继峰, 刘军须, 曾振山, 等. 虎皮猫在降压物质检查中的应用 [J]. 医学动物防制, 2012, 28(6): 597-599.
[16] 化志鹃、江春光. 左旋多巴对形觉剥夺性弱视幼猫图形视觉诱发电位的影响 [J]. 昆明医学院学报, 2010, 31(5): 12-16.
[17] 刘文舟, 罗向霞, 段俊国, 等. 家猫高眼压模型的建立及特征分析 [J]. 国际眼科杂志, 2009, 9(10):1881-1884.
[18] 张晓艳, 谢鹏雁, 王化虹, 等. 电针酸灌注食管炎猫足三里穴对下食管括约肌调节功能的研究 [J].现代中西医结合杂志, 2011, 20(20): 2490-2492.
[19] 罗勋, 王云, 王春花, 等. 猫下丘中央核52HT、P物质和星形胶质细胞年龄相关变化 [J]. 中国组织化学与细胞化学杂志, 2011, 20(3): 207-211.
[20] 华田苗, 王振华, 徐金旺, 等. 对比度检测学习提高猫的视觉对比敏感度 [J]. 动物学研究, 2010, 31(2): 155-162.
[21] 蔣虹, 时建东, 吴小闲. 猫病毒血清学检测方法的建立及初步应用 [J]. 中国实验动物学杂志, 1999, 9(1): 39-41.
[22] 刘宝山, 林颖, 尹荣焕, 等. 猫疱疹病毒1型PCR检测方法的建立 [J]. 畜牧与兽医, 2010, 42(1): 74-76.
[23] 林颖, 刘宝山, 任会军, 等. 猫传染性鼻气管炎PCR检测方法的建立 [J]. 现代畜牧兽医, 2010. 8:71-73.
[24] 屈哲, 徐镔蕊, 雎艳平, 等. 猫病毒性鼻气管炎PCR检测方法的建立与应用 [J]. 中国兽医杂志,2011, 47(5): 25-26.
