D-氨基半乳糖联合脂多糖诱导小鼠慢性肝损伤模型的建立
2014-08-14翟亚南王晶晶池亚菲彭博雅
翟亚南,王晶晶,李 梦,池亚菲,孟 霞,彭博雅,焦 昆,卢 静
(首都医科大学,北京 100069)
肝脏疾病是人类最常见的疾病之一, 严重威胁着人类健康。为此,研发抗肝脏疾病的有效药物显得尤为重要。动物实验是药物进入临床的必经之路,在研发抗肝脏疾病药物过程中,选择有科学性、实用性、重现性的肝损伤动物模型的意义十分重要[1]。目前,有很多药物诱导肝损伤模型,但是重复性和模拟性好的药物毒性大,或建模结果不够稳定。D-氨基半乳糖毒性小,使用方便,但用于诱导大鼠肝损伤模型,有研究认为用于小鼠模型不稳定[2]。为此,本实验就以D-氨基半乳糖联合脂多糖(以下简称D+L)致小鼠慢性肝损伤模型的制备进行探讨。
1 材料和方法
1.1 实验动物
SPF级健康雄性BALB/ c小鼠22只,体重18~22 g,购于北京维通利华实验动物科学技术有限公司【SCXK(京)2012-0001】。在首都医科大学实验动物部屏障环境开展实验【SYXK(京)2010-0020】。室温20℃~25℃, 相对湿度40%~70%。小鼠分笼饲养, 每笼饲养3~4只,给予自由进食和饮水,饲料和饮水均经灭菌处理。
1.2 试剂与仪器
D-氨基半乳糖(Nanjing Boyuan Pharmatech Co.,Ltd,20100521)、脂多糖(美国Sigma公司,L2880,10 mg)、Masson染色试剂盒(南京建成科技有限公司,20100318)D+L注射液:1800 mgD-氨基半乳糖加入54 mL生理盐水后,加入6 mL浓度为20 μg/mL脂多糖,配置成30 mg/mL lD-氨基半乳糖和2 μg/mL脂多糖的混合溶液、4%甲醛固定液:10 mL40%甲醛溶液加入90 mL蒸馏水10倍稀释。石蜡包埋机(LeicaEG1160)、旋转切片机(LEICA,RW2235)、烘片机(LEICAHI1220)、自动染色仪(LEICA,AUTOSTAINERXL)、电热恒温鼓风干燥箱(天津市泰斯特仪器有限公司,WG-7)、光学显微镜(Nikon)、Nikon数字显微照相机(日本Nikon公司,Eccipse8oi)、图像采集分析系统(NIS-ElementsBasicResearch)、水浴锅(江苏省金坛市荣华仪器制造有限公司,HH-W600)、脱水机(Leica,ASP300S)。
1.3 实验方法
1.3.1 动物模型制备和实验组分组:22只BALB/ c小鼠随机分成三组,空白对照组6只,LPS对照组8只,D+L组8 只,D+L组30 mg/mL gD-氨基半乳糖为+2 μg/mL脂多糖(LPS)混合液,空白对照组组同体重无菌生理盐水,LPS对照组2 μg/mL脂多糖(LPS)溶液,1次/2天,连续注射8周,给予途径均为腹腔。
1.3.2 取材: 10%水合氯醛麻醉后,用眼球动静脉采血法取血1 mL,离心3000 r/min 10 min,取上清- 80℃冻存待测。用脱颈椎方法使小鼠安乐死,解剖取肝脏,观察肝脏变化;取肝左叶于4%甲醛溶液固定,石蜡包埋,制备组织切片, 其余肝组织放置-80℃冰箱保存。
1.3.3 肝功能指标测定:采用日立7180全自动生化分析仪测定大鼠血清ALT、AST水平。
1.3.4 病理学及细胞凋亡变化:以石蜡包埋的肝组织标本制备4 μm切片, HE染色,镜下观察病理组织变化,包括肝细胞的变性坏死、炎性细胞浸润、纤维间隔及假小叶的形成等病理变化。
1.3.5 肝组织切片水化脱蜡,使用Masson染色试剂盒染色,蓝紫色表达为胶原纤维。
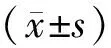
2 结果
2.1 一般情况
空白对照组小鼠毛发有光泽,活动正常,精神状态良好,饮食量正常;LPS对照组小鼠毛发有光泽,活动较多,精神状态良好,饮食量正常;实验组小鼠毛发逐步凌乱无光泽,精神萎靡,活动渐少,饮食量少,对外界刺激反应迟钝。
2.2 肝功能指标
如表1示,第8周D+L慢性肝损伤BALB/c小鼠血清ALT水平与空白对照组、LPS对照组比较,D+L组极显著性增加(P< 0.01);D+L组AST水平与空白对照组、LPS对照组比较,无明显变化(P> 0.05);AST/ALT比值,与空白对照组比较,D+L组显著性降低(P< 0.05),LPS组显著性增加(P< 0.05),与LPS对照组比较,D+L组极显著性降低(P< 0.01)。
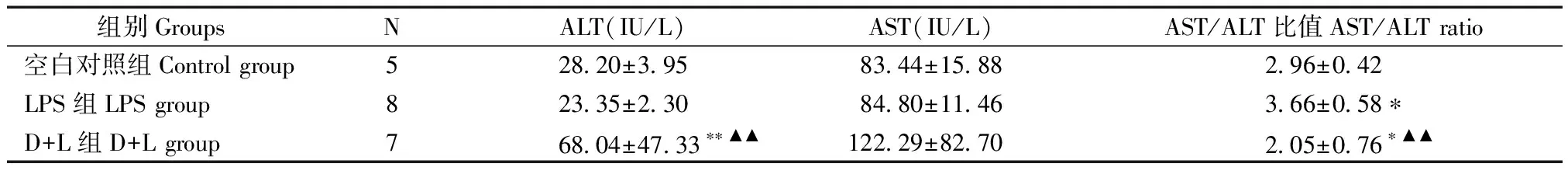
表1 第8周D+L肝损伤BALB/c小鼠血清ALT、AST水平组间比较
2.3 小鼠D+L慢性肝损伤过程中肝脏大体形态学、病理学变化
实验第8周时,空白对照组肝脏呈鲜红色,表面光滑、边缘整齐,病理切片显示肝细胞、汇管区、胆管上皮细胞等形态结构完整,未见变性、坏死等;LPS对照组与空白对照组比较,小叶结构,细胞形态排列等,未见明显差异;D+L组肝脏体积缩小,边缘变薄, HE染色可见(封底图1),肝小叶结构破坏,网状纤维等支架组织发生明显变化。10倍镜下D+L组小鼠肝小叶结构紊乱,有结节性增生,40倍镜下可见结节性增生区域,肝上皮细胞细胞核初相浓缩、溶解、坏死等现象,坏死灶密集分布,枯否氏细胞显著增多。Masson染色(封底图2),空白对照组肝组织10倍镜下可见均匀的淡蓝色细条索状染色,40倍镜下可见蓝染部位为肝上皮细胞间质;LPS组与正常对照组比较,染色性状与部位未见明显改变;D+L组肝组织出现大量结节样蓝色深染,特别是在肝上皮细胞大量变性坏死区域,蓝色深染充斥整个区域,细碎偏淡的条状蓝染已经融合成粗大、深蓝的结节样改变。
3 讨论
慢性肝损伤是一种多因素介导的复杂生物学过程,损伤的结果是肝细胞发生凋亡和坏死,损伤的诱因是多方面的[3]。ConA诱导(免疫性损伤)、对氨基酚药物(药物性损伤)和D-氨基半乳糖联合脂多糖诱导(炎症性损伤)等方法均可建立肝损伤动物模型[4]。本实验采用D-氨基半乳糖联合脂多糖诱导方法建立。D-氨基半乳糖诱发的动物肝损伤在形态学和功能上被认为与人的急性重症肝炎类似。外源性脂多糖可增加氨基半乳糖的肝毒性, 同时氨基半乳糖也可导致脂多糖的感受性亢进。氨基半乳糖和脂多糖可导致广泛性肝坏死,较常用于肝炎药物的研发[1]。但是两种药物联合诱导的慢性肝损伤动物模型,纵观目前国内外文献,较少,但是在临床上,慢性肝损伤远多于急性肝损伤病人。因此,慢性肝损伤动物模型的制备具有重要的研究意义。
脂多糖(LPS)是一种内毒素,可活化单核巨噬细胞,在体内主要通过脂多糖(LPS)结合蛋白、CD14等介导,与单核巨噬细胞、内皮细胞等靶细胞上的跨膜受体Toll样受体4相结合,在淋巴细胞抗原96辅助下将信号转入胞内,通过胞内复杂的信号途径,导致TNF-α、IL-1、IL-6等炎性细胞因子及肿瘤坏死因子的产生,从而引起肝细胞损伤[5-6]。肝细胞内许多物质代谢过程与磷酸尿嘧啶核苷密切相关,足量的磷酸尿嘧啶核苷是维持肝细胞正常代谢及生物转化功能的必要物质,如果发生耗竭,可以引起肝细胞损伤甚至坏死。D-氨基半乳糖(D-GalN)是一种肝细胞磷酸尿嘧啶核苷干扰剂,通过竞争生成二磷酸尿苷半乳糖使磷酸尿苷耗竭, 限制了细胞器的再生及酶的生成和补充,从而使细胞器受损,促使肝细胞的结构和功能均出现异常,导致物质代谢障碍,引起肝细胞变性、坏死[7],并且D-氨基半乳糖(D-GalN)还可能与脂多糖(LPS)协同作用,通过导致内毒素血症的途径造成肝细胞损伤,促使聚集在受损肝细胞周围的中性粒细胞产生暴发呼吸和脱颗粒,释放氧自由基和导致脂质过氧化,作用于肝脏实质细胞和血管内皮细胞,导致细胞严重损伤或死亡[8]。因此,本实验选用这两种药物联合的方法诱导慢性肝损伤的发生。
肝损伤动物模型的建立是筛选保肝药物的关键步骤之一。由于小鼠价格便宜,目前较多的文献报道选用小鼠作为实验动物[2]。有关慢性肝损伤模型的研究结果不尽相同,原因在于慢性损伤过程需较长的给药时间,动物个体差异大,在长时间给药过程中动物对药物的反应差异越来越大,导致实验系统的不稳定性。
根据预实验,在保证极低死亡率情况下,本实验采用30 mg/mL D-氨基半乳糖联合2 μg/mL脂多糖混合溶液,采用连续腹腔注射法造模,每2天1次。研究报道,慢性肝损伤标准至少要求肝损伤状态维持6 周以上,并伴有肝组织学的结构病变,如肝纤维化和肝硬化结节等[9];常用的肝纤维化动物模型复制方法中,介绍给药时间为9周[10],综上及预实验结果,本实验采取连续8周给药的方法。
实验结果显示:在8周时,虽然D+L组与正常对照组比较,ALT、AST水平均有明显的上升趋势,但AST/ALT显著性降低,依然提示此时虽然有明显的细胞膜和细胞器损伤,但该损伤以细胞膜变性改变为主(表1、封底图2)。
生理状态下ALT与AST主要分布在肝脏的肝上皮细胞内,血清含量极少。在肝细胞中,ALT主要存在于非线粒体中。只要肝上皮细胞细胞膜稍有损坏,就可以使血清中ALT水平特异性升高。因此,ALT被世界卫生组织推荐为肝功能损害最敏感的检测指标。而大约80%的AST存在于线粒体内, 只有当肝上皮细胞坏死时,血清中AST水平才会明显升高[11]。
从组织形态学上,该模型也呈现出肝损伤的特征,坏死灶密集分布,枯否氏细胞显著增多,小叶分界颇不清晰,结构紊乱,结节状增多,40倍镜下可见结节性增生区域肝上皮细胞细胞核浓缩、溶解、坏死,坏死细胞处出现枯否氏细胞聚集。而在相同部位Masson染色可见大量结节样蓝色深染,特别是在肝上皮细胞大量变性坏死区域,蓝色深染充斥整个区域,细碎偏淡的条状蓝染已经融合成粗大、深蓝的结节样改变。
综上本实验建立的慢性肝损伤小鼠模型不仅具有较好的稳定性,而且具有明显的生化、形态学、病理学特征。该模型的建立为研究慢性肝损伤的发病机制,探索慢性肝损伤治疗新措施,筛选治疗新药物提供了新的选择,具有重要意义。
参考文献:
[1] 王福根,孙静霞. 肝损伤动物模型的建立和应用[J].中国药房,2006,17(9):702-703.
[2] 李梅,谷淑玲,马腾飞. D-氨基半乳糖致小鼠、大鼠肝损伤模型的实验性研究[J].徐州医学院学报,2007,27(2):86-88.
[3] 张海燕,侯维. 大鼠慢加急性肝衰竭模型建立的方法探讨[J]. 胃肠病学和肝病学杂,2009,18(4):348-351.
[4] 张锦雀,黄丽英. 肝损伤动物模型研究进展[J]. 福建医科大学学报,2009,43(1):86-88.
[5] 陈恩强,王丽春,唐红,等. 脂多糖联合D-氨基半乳糖诱导急性重症肝炎小鼠模型的建立[J]. 华西医学,2009,24(1):129-131.
[6] 李劲,张健,刘光泽,等. D-氨基半乳糖与脂多糖对小鼠肝脏损伤后再生修复的影响[J].南方医科大学学报,2012,32(1):50-54.
[7] Abou-Elella AM,Siendones E,Padillo J,etal. Tumour necrosis factor-αand nitric oxide mediate apoptosis by D-galactosamine in a primary culture of rat hepatocytes :exacerbation of cell death by cocultured Kupffer cells[J]. Can J Gastroenterol,2002,16(11):791-799.
[8] 潘庆军,朱学芝,刘渊. LPS /D-GalN 诱发NF-κB 转基因小鼠急性致死性肝损伤模型的建立[J].中国实验动物学报,2013,21(4):1-5.
[9] 张海燕,温韬. 四氯化碳诱导大鼠慢性肝损伤模型方法的探讨[J]. 实用肝脏病杂志,,2009,12(3):161-163.
[10] 周光兴,高诚,徐平,等. 人类疾病动物模型复制方法学[M].上海科学技术文献出版社,2008:87-88.
[11] 张丽杰.血清转氨酶的测定及临床意义[J].中国医药指南,2012,10(9):298-299.
