BALB/cA-nu小鼠主要脏器参数、血生理生化指标和免疫细胞的测定
2014-08-14吴旭颖田玉书吴金峰郑伟斌王飞飞张文明杨志伟
吴旭颖,田玉书,吴金峰,郑伟斌,王 宇,王飞飞,张文明,杨志伟
(北京华阜康生物科技股份有限公司,北京 102200)
BALB/cA-nu小鼠是Charles River Japan(CRJ)公司通过对BALB/cABon-nu和BALB/cAnNCrj-nu进行交配和回交得到的品系,1985年CRJ得到了来源明晰的BALB/cAnNCrj-nu孕鼠,并在同年进行剖腹产,此小鼠为近交系,遗传监测证实是BALB/c裸鼠,此小鼠胸腺缺失,为第11对染色体隐性遗传。由于无胸腺,仅有胸腺残迹或异常上皮,不能使T细胞正常分化,故造成T细胞缺陷。B淋巴细胞正常,但功能缺陷,抗体主要为IgM,只有少量IgG,无接触敏感性,无移植排斥反应[1]。BALB/cA-nu小鼠作为免疫缺陷动物,目前已被广泛应用到肿瘤学、免疫学和药品与生物制品的安全性方面的评价以及有效药品的筛选等实验方面的研究[2]。BALB/cA-nu小鼠自从国外引进后已经超过20代,随着饲养环境、营养、繁殖育种以及管理等诸多方面的差异,对于此小鼠的遗传、生理生化以及免疫功能等生物学特性是否发生改变,尚缺乏了解,还需进一步验证和探讨,故我们对本单位5、10周龄的BALB/cA-nu小鼠的主要脏器重量、血液生理生化指标进行了测定;同时为验证其免疫缺陷特性,我们采用流式细胞仪对6周龄的BALB/cA-nu小鼠的免疫细胞做了相关检测,为我国利用该品系动物从事生物医药研究的科研人员提供基础生物学数据。
1 材料和方法
1.1 动物来源
取SPF级BALB/cA-nu小鼠5、10周龄各24只,雌、雄比例1∶1,共计48只,用于脏器重量和血生理生化指标检测;取6周龄的BALB/cA-nu小鼠4只,雌、雄比例1:1,用于免疫细胞测定。所有动物均由北京华阜康生物科技股份有限公司提供,生产许可证号为:SCXK(京)2009-0004。该动物实验于中国医学科学院实验动物研究所解剖实验室进行,实验动物使用许可证号为:SYXK(京)2013-0019。
1.2 饲养管理及环境
实验BALB/cA-nu小鼠均饲养在北京华阜康生物科技股份有限公司SPF车间的隔离器内,隔离器内的洁净度为5级标准,温度控制在23±3℃,相对湿度40%~70%,换气次数每小时为20次,明暗照明周期为12 h∶12 h,动物自由采食和饮水。
小鼠的饲料为北京华阜康生物科技股份有限公司生产的60Co小鼠繁殖料1315(SCXK(京)2009-0008)。饲料的营养成分为:粗蛋白≥23.0%、粗脂肪≥5.0%、粗灰分≤7.0%、粗纤维≤5.0%、水份≤10%、钙1.4%~1.5%、磷1.0%~1.1%、赖氨酸≥1.32%、蛋氨酸+胱氨酸≥0.78%水为酸化过滤自来水(ph=2.7~3.0)并经121℃ 30 min高压蒸汽灭菌,使用的垫料等物品均经过132℃ 30 min高压蒸汽灭菌,每周更换1次垫料,进出隔离器的物品进行严格消毒,严格遵守隔离系统操作规程。
1.3 仪器及试剂
法国ABX Pentra DX 120血细胞分析仪和配套试剂、日立7100全自动生化分析仪和配套试剂、美国贝克曼Allegra 64R台式高速冷冻离心机、美国BD公司流式细胞仪(FACS)、红细胞裂解液(碧云天生物技术研究所)。
1.4 实验方法
1.4.1 体重和脏器重量的测定:实验前禁食12 h,禁水1 h,用电子天平称取5、10周龄小鼠体重,眼眶采血后脱颈椎处死,立即剖取脾脏、肝脏、肾脏、心脏、肺脏、脑,并用滤纸吸干组织表面的水分,称取重量。
1.4.2 血生理指标测定:从小鼠眼眶后静脉丛采血,取0.2 mL血液到EDTA2k抗凝管内,进行血生理测定。12项血生理指标为:血红蛋白(HGB)、红细胞(RBC)计数、白细胞(WBC)计数、淋巴细胞(LYM)、血小板(PLT)、平均血小板体积(MPV)、血小板压积(PCT)、红细胞压积(HCT)、平均红细胞体积(MCV)、红细胞平均血红蛋白(MCH)、平均血红蛋白浓度(MCHC)、红细胞体积分布宽度(RDW)。
1.4.3 血生化指标测定:将剩余的全血取0.8 mL到离心管内,3000 r/min,离心10 min后取血清,进行血生化测定。15项血清生化指标为:总蛋白(TP)、白蛋白(ALB)、球蛋白(GLOB)、白蛋白/球蛋白(A/G)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、血糖(GLU)、总胆固醇(CHO)、甘油三酯(TG)、总胆红素(TBIL)、尿素氮(UN)、肌酐(CREA)、无机璘(P)、血钙(Ca)。
1.4.4 免疫功能检测方法:采用小鼠摘眼球取血法取300 μL外周血,经红细胞裂解液去除红细胞后,将细胞用1% BSA/PBS洗两次后分为两管备用。其中一管用PerCP-Cy5.5-CD3、APC-Cy7-CD4、FITC-CD8和PE-Cy7-NK1.1染色30 min,另一管用PerCP-Cy5.5-CD3、FITC-B220和APC-Cy7-CD11b染色30 min,洗后用流式细胞仪检测并用FCS Express V3.0软件分析数据。免疫细胞测定:T细胞(CD3+、CD4+、CD8+)、B细胞(CD19+、B220+)、NK细胞(NK1.1+)、粒细胞(CD11b+)。
1.5 结果处理
实验数据采用SPSS19.0软件进行单因素方差统计分析,以平均数±标准差(x±S)表示,显著水平为P< 0.05。
2 结果
2.1 BALB/cA-nu小鼠脏器测定结果
由表1可见,同周龄的BALB/cA-nu小鼠,雄鼠的体重、肝脏和双肾重量高于雌鼠(P< 0.05)。同性别的BALB/cA-nu小鼠,5周小鼠的肺脏、肝脏、双肾重量明显低于10周龄小鼠(P< 0.05)。

表1 BALB/cA-nu小鼠主要脏器重量(单位:g)
2.2 BALB/cA-nu小鼠血生理指标测定结果
由表2可见,同周龄的BALB/cA-nu小鼠,雄鼠HGB、MCH和HCT的值高于雌鼠(P< 0.05)。同性别的BALB/cA-nu小鼠,5周小鼠RDW的值高于10周龄小鼠(P< 0.05)。
2.3 BALB/cA-nu小鼠血生化指标测定结果
由表3可见,同周龄的BALB/cA-nu小鼠,雄鼠TBIL的值高于雌鼠(P< 0.05)。同性别的BALB/cA-nu小鼠,5周小鼠TP、GLOB、CHO、TBIL、UN的值明显低于10周龄小鼠(P< 0.05),而5周小鼠A/G的值高于10周龄小鼠(P< 0.05)。
2.4 BALB/cA-nu小鼠免疫细胞测定结果
图1显示的是一只BALB/cA-nu小鼠外周血中T细胞及其亚群、B细胞、NK细胞和粒细胞的百分比。
由图2可见,BALB/cA-nu 小鼠外周血无T细胞(0.18±0.06)%、CD4+T细胞(0.26±0.08)%、CD8+T细胞(0.13±0.04)%,CD19+B细胞的比例为(30.10±2.74)%、B220+ B细胞的比例为(30.55±2.77)%,NK细胞比例为(1.35±0.29)%,粒细胞比例为(47.90±5.48)%。
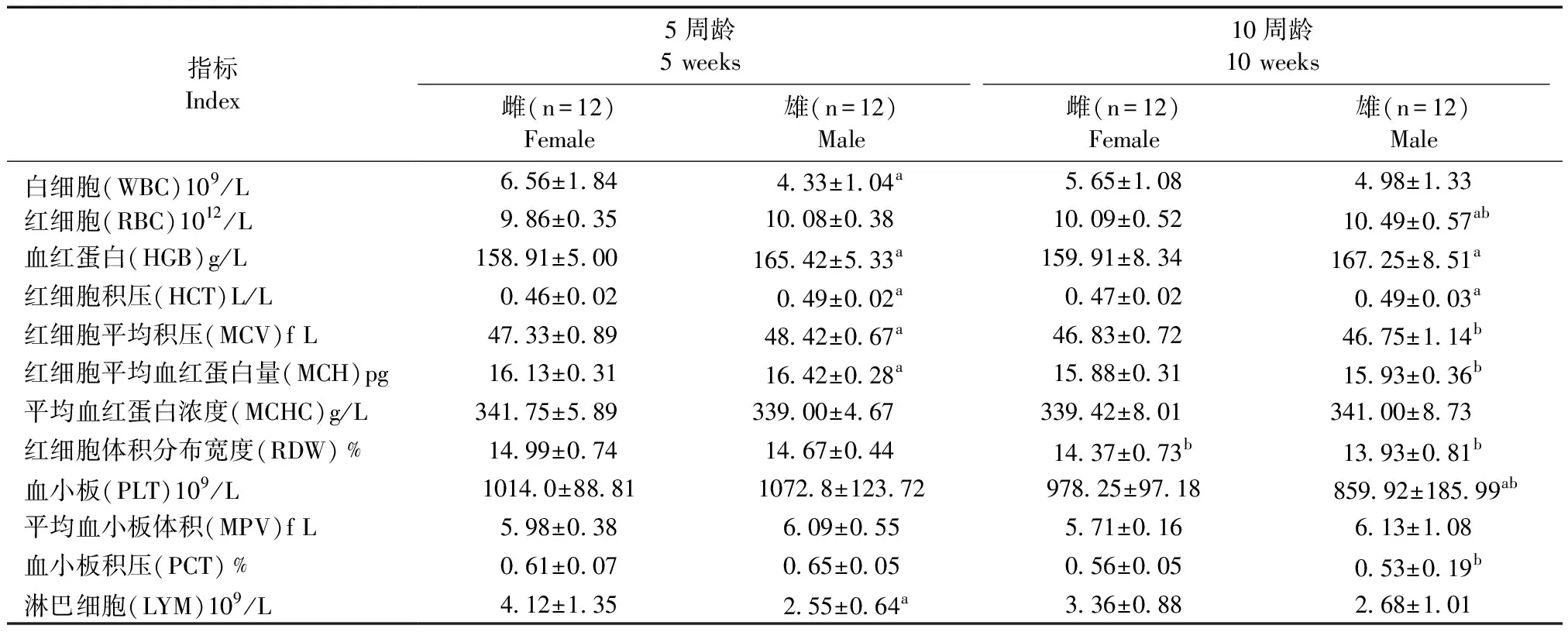
表2 BALB/cA-nu小鼠血生理指标
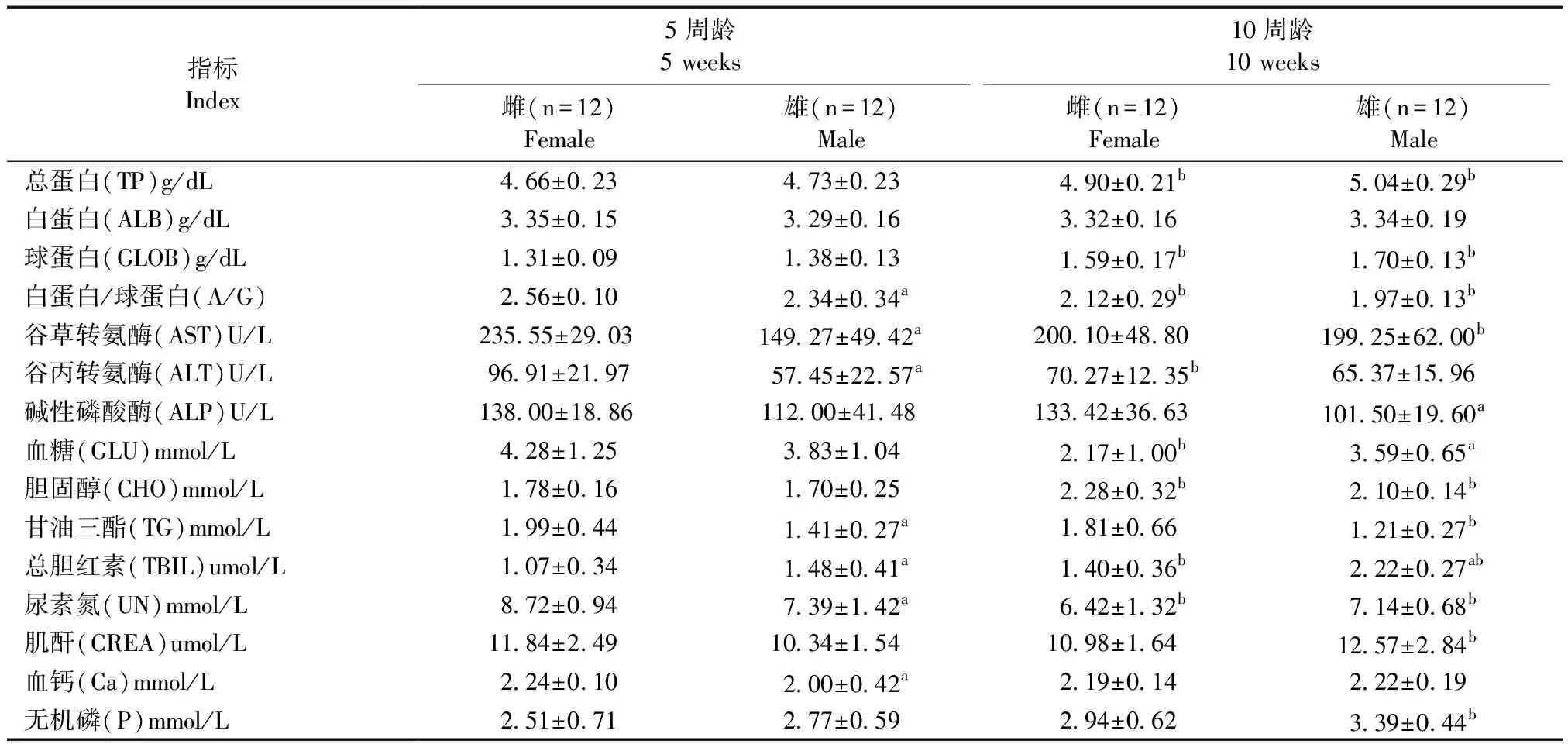
表3 BALB/cA-nu小鼠血生化指标

图1 BALB/cA-nu小鼠外周血免疫细胞百分比

图2 BALB/cA-nu小鼠免疫细胞百分比
3 结论
截止目前,国内报道有关BALB/cA-nu小鼠的主要脏器重量,血生理生化指标以及免疫细胞等基本生物学特性的文献并不多,而这些指标又都是动物实验中的重要基础数据。脏器重量是鉴定动物遗传品质的重要依据,而血生理生化值又是生物医药研究的基础指标,本研究通过对5、10周龄BALB/cA-nu小鼠的主要脏器重量、12项血生理、15项血生化指标进行统计分析,结果表明,同周龄的BALB/cA-nu小鼠的雌雄相比,体重、肝脏、双肾重量差异具有显著性,此结果与文献[3]报道结果一致,血生理指标HGB、MCH差异有显著性与张修彦的BALB/c小鼠的报道相一致[4];同性别小鼠的5周与10周相比,肺脏、肝脏、双肾差异具有显著性,TP、GLOB、A/G、CHO、TBIL、UN血生化指标差异显著。
另外,本研究中测定BALB/cA-nu小鼠的主要脏器,血生理生化的数据,通过与日本SLC公司的1998年的数据集中刊登的10周龄的BALB/c Slc-nu/nu小鼠相比,脾脏、WBC、GLU、CREA、TBIL的值稍低,其余各项值很接近[5];与Charles River公司2011年1月至2012年12月刊登的8~10周龄的BALB/c Nude小鼠相比,血生理很接近,只有血生化中GLU、CREA、TBIL的值偏低[6]。造成此类差异的因素,除品系、饲养环境、营养因素外,样品的采集、贮存处理、仪器、试剂及人员操作等因素的影响也是至关重要的,尤其是GLU、TBIL分别对时间和光照的敏感性,据赵晓红报道[7]血液离体后,随着时间的延长,全血中的葡萄糖被分解代谢,血糖浓度逐渐下降,大约每小时下降5%~7%;血液中的总胆红素,绝大部分为非结合胆红素,血样在受到光照后,使胆红素中相当部分的非结合胆红素形成构型异构体,继而进一步形成结构异构体,由于结构异构体不能参与重氮反应,导致测得TBIL比实际的值低[8],但TBIL值偏低,在临床上无相对意义。另外,实验前动物禁食时间的差异,也对WBC、CREA、GLU等指标有影响[9]。
BALB/cA-nu小鼠作为免疫缺陷动物,因其T细胞特异性免疫缺陷,使其被广泛地应用到免疫学和药物研发研究[10]。机体的特异性免疫功能分为细胞免疫和体液免疫,细胞免疫过程主要是由T淋巴细胞介导的,通过T淋巴细胞特异性地识别抗原,使T细胞活化、增殖和分化,发挥免疫效应。T细胞抗原受体(TCR)和CD3+均为T细胞膜上的重要分化抗原,是成熟T细胞的特征性标志,T细胞表面的TCRCD3+构成复合体;CD4+和CD8+是T细胞表面的糖蛋白,CD4+主要表达MHCⅡ限制的T细胞,CD8+主要表达MHCⅠ限制的T细胞,CD4+和CD8+作为辅助分子增强T细胞和抗原提呈细胞(APC)或CTL靶细胞间的相互作用。CD4+和CD8+的功能与TCR的功能错综复杂地联系在一起,因此CD4+和CD8+分子通常被视为判断和鉴定T细
胞亚群及其成熟的标志。B淋巴细胞是唯一能够产生抗体的细胞,B220+是小鼠全B细胞最常用标记,但这个标记也表达于活化T细胞、活化NK细胞和NK祖细胞。相对来说,CD19+是B细胞较特异的标记,主要表达大多数B细胞,从祖B细胞阶段开始表达直至浆细胞阶段[11-13]。因此我们通过标记6周龄BALB/cA-nu小鼠全血中的CD3+、CD4+、CD8+、CD19+、B220+、NK1.1+、CD11b+抗体基检测此小鼠体内不同的免疫细胞情况,结果表明BALB/cA-nu小鼠表现为T细胞免疫缺陷。
参考文献:
[1] Shanru Li,Dong ping Wang,Xiuling Yu,et al.a new mutation causing hairless on mouse chromosome 11[J].Genet Res Camb,1999,73:233-238.
[2] 吴细丕,钱林法.实验动物与肿瘤研究[M].北京:中国医药科技出版社,2000:18.
[3] 练有文,王晖,倪少凯,等. BALB/c系裸小鼠脏器重量、脏器系数的测定[J].中国比较医学杂志,2006,16:285-287.
[4] 张修彦,詹纯列,肖育华,等.SPF级BALB/c小鼠脏器质量、脏器系数、血常规、血生化指标的测定与比较[J].中国组织工程研究与临床康复,2011,15:7734-7737.
[5] 日本SLC公司1998-实验动物数据集[M],1998,46.
[6] http://www.criver.com/files/pdfs/rms/balbc-nude/rm_rm_r_balb-c_nude_mouse_clinical_pathology_data.aspx.
[7] 赵晓红,血液标本存放时间对生化检验结果的影响研究[J].中国保健营,2013,4:2127.
[8] 刘玉霞,朱晴晖.结合胆红素和非结合胆红素的直接测定在高胆红素血症中的应用[J].检验医学,2008(2):156- 159.
[9] 柯斌,秦鉴,张俊杰.短期禁食对大鼠生理生化指标的影响[J].时珍国医国药,2011,22:2778-2780.
[10] 练有文,王晖,倪少凯,等.不同饲养密度对SPF级BALB/cA裸鼠血生化指标的影响[J].广东医学院学报,2010,28:120-122.
[11] 龚非力,主编.医学免疫学,科学出版社.2000,6:P92-107.
[12] 林学颜,张玲,主编.现代细胞与分子免疫学,科学出版社.1999,8:12-190.
[13] 王冬平,栾蓉晖,李善如,等.BALB/c突变无毛小鼠特异性免疫功能的研究[J].中国实验动物学报,2003,11(1):23-25.
