小鼠诺如病毒间接免疫荧光检测方法的建立
2014-08-14田胜男张丽芳李雨函苏静芬刘先菊向志光刘云波
田胜男,佟 巍,张丽芳,常 慧,李雨函,苏静芬,刘先菊,向志光,刘云波
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
诺如病毒(Norovirus, NoV)属杯状病毒,是全球流行性与散发性急性胃肠炎的主要病因之一,每年至少导致100万例病患就诊和20万例5岁以下儿童死亡,造成巨大的经济损失[1]。由于缺少合适的体外培养模式和小动物模型,使该病毒的研究受到了很大限制。小鼠诺如病毒的发现及其能够在体外细胞中培养的特性,使它成为了良好的NoV研究模型[2]。小鼠诺如病毒在实验小鼠中的感染率非常高,我国已有多个实验动物设施检出小鼠感染该病毒的情况。
间接免疫荧光法基于抗原-抗体反应,以全病毒作为抗原识别血清中存在的病毒抗体,因而具有高特异性[3],该方法在实验小鼠病毒检测中应用非常广泛,多种病毒都能够通过这种方法进行快速检测。本实验旨在建立小鼠诺如病毒间接免疫荧光检测方法,实现MNV高效快速检测。
1 材料和方法
1.1 材料
RAW264.7细胞和MNV-1(CW1)购自ATCC,Manassas, VA;Dulbecco‘s modified Eagle’s medium (DMEM)购自Thermo Scientific,Hyclone;四周龄Balb/c小鼠(SPF级)购自北京维通利华实验动物技术有限公司,感染动物实验得到中国实验动物学会实验动物使用和管理委员会许可(ILAS-PC-2013-005);小鼠诺如病毒ELISA检测试剂盒(SMART-M35)购自Biotech Trading Partners公司。荧光显微镜:Nikon, Ni-U;醋酸纤维素膜:Millipore, Bedford, USA;多通道杂交仪:AE-6195, ATTO, Tokyo, Japan;山羊抗小鼠IgG: Jackson ImmunoResearch, West Grove, USA (1:10000用);化学发光试剂(ECL):Millipore, Bedford, USA;X-ray 胶片:Kodak, Rochester, USA。
1.2 MNV-1的富集
取0.2 mL MNV-1,加入生长密度为80%左右的单层RAW264.7细胞,37℃吸附1 h,加6 mL DMEM(含0.5%双抗),37℃, 5% CO2继续培养。观察细胞生长情况。分别取不同培养时间点的细胞反复冻融3次,2 500 r/min离心5 min,收集上清液。
1.3 TCID50法测定病毒效价
在离心管或12孔细胞培养板中将病毒液作连续10倍的稀释,稀释度从10-1~10-10。将稀释好的病毒悬液接种到铺满单层细胞的96孔微量培养板中(细胞密度约为2~3×105个/mL),每一稀释度接种一纵排共8 孔,每孔接种100 μL。设正常细胞对照,正常细胞对照作两纵排(100 μL生长液)。逐日观察并记录结果,连续观察7 d。按Reed-Muench两氏法计算结果。
1.4 血清样品的收集
取四周龄BALB/c 小鼠(SPF级)进行眼眶采血,收集血清作为阴性对照。其他小鼠通过灌胃的方式感染MNV-1(107TCID50),200 μL/只[4]。取感染后7周内不同时间点的小鼠血清进行检测。
1.5 免疫荧光分析抗体检测
1.5.1 抗原片的制备:选择效价为107TCID50的病毒接种于RAW264.7细胞,收集感染后不同时间细胞,滴加至玻片上,作为抗原孔。未感染的RAW264.7细胞作为对照孔。室温晾干,将玻片浸入4℃预冷的丙酮中固定15 min,固定后通风使丙酮挥发。抗原玻片-30℃保存。
1.5.2 检测步骤:所有的血清样品于56℃,灭活30 min,待检血清用磷酸缓冲液(pH 7.2)1∶10稀释样品。每个样品滴加2个孔(一个抗原孔,一个对照孔)。样品滴加完毕后将玻片放入湿盒内37℃孵育30 min。取出玻片,PBS冲洗3次,每次5 min。抗原玻片风干后,逐孔滴加荧光结合物,放入湿盒内37℃孵育30 min。PBS冲洗1次,蒸馏水冲洗1次。50%甘油封片,荧光显微镜下观察。
1.6 ELISA试剂盒对小鼠血清的检测
对收集的所有血清进行ELISA检测(过程参照说明书),选择强阳性血清作为阳性对照。
1.7 Western blot法对差异样品的验证
对两种方法检测的结果不一致的血清,用Western blot的方法进行验证。按1.2方法对MNV-1进行富集后,30 000 r/min,3 h超速离心,PBS重悬沉淀,NanoDrop 2 000测定蛋白浓度;制备SDS-PAGE凝胶,每孔上样5 μL,恒流100 V电泳2 h,电泳结束后立即转膜,恒流300 A,1 h将蛋白转移至醋酸纤维素膜(NC)上,3%脱脂奶粉封闭1 h,将差异血清1∶100稀释后孵育NC杂交膜,4℃过夜,PBST(PBS含0.05%吐温)洗膜3次,每次10 min,山羊抗小鼠IgG 1∶10 000稀释后 37℃孵育NC杂交膜1 h,PBST洗膜3次,每次10 min,暗室显影。
2 结果
2.1 不同培养时间收集病毒的滴度
对感染MNV-1后不同时间点的RAW264.7细胞进行病毒收集并测定其效价,结果显示在培养前期病毒感染细胞以及初始复制较慢需要6~8 h左右,病毒滴度仅为102TCID50,随后的24~28 h病毒滴度呈对数增长趋势,随着时间的增加,病毒效价明显增强,培养时间增至36 h时病毒效价达到峰值,随后的几小时内病毒滴度无上升趋势,此时感染细胞基本呈破碎或半破碎状态(图1)。
使用24孔细胞培养板,以2 h为间隔,收集病毒感染后2 h、8 h、12 h、16 h、20 h、22 h、24 h、36 h、48 h共9个时间点的感染细胞爬片,分别检测MNV阳性血清并比较结果。全视野观察36 h阳性细胞数可至50%,视野中细胞形态清晰,荧光强度高,便于观察。选择感染病毒36 h的细胞用于IFA 检测。

注:RAW264.7细胞感染MNV-1后不同时间点收集病毒并测定其效价,结果显示在培养8 h后为102pfu,随着时间的增加,病毒效价也逐渐增强,培养时间增至36 h时病毒效价达到峰值。
2.2 IFA方法对血清样品的检测
IFA结果显示小鼠感染MNV-1 7 d内血清样品均为阴性,全视野下无荧光可见;感染后两周时有阳性血清检出,视野下偶见微弱荧光,多存在于胞浆处,呈颗粒状;3周后全部血清样品均为阳性(表1)。图2为MNV免疫荧光法检测血清样品荧光显微镜下效果图,其中图2(a)为典型阳性图像,图2(b)为典型阴性图像(图2见封底)。
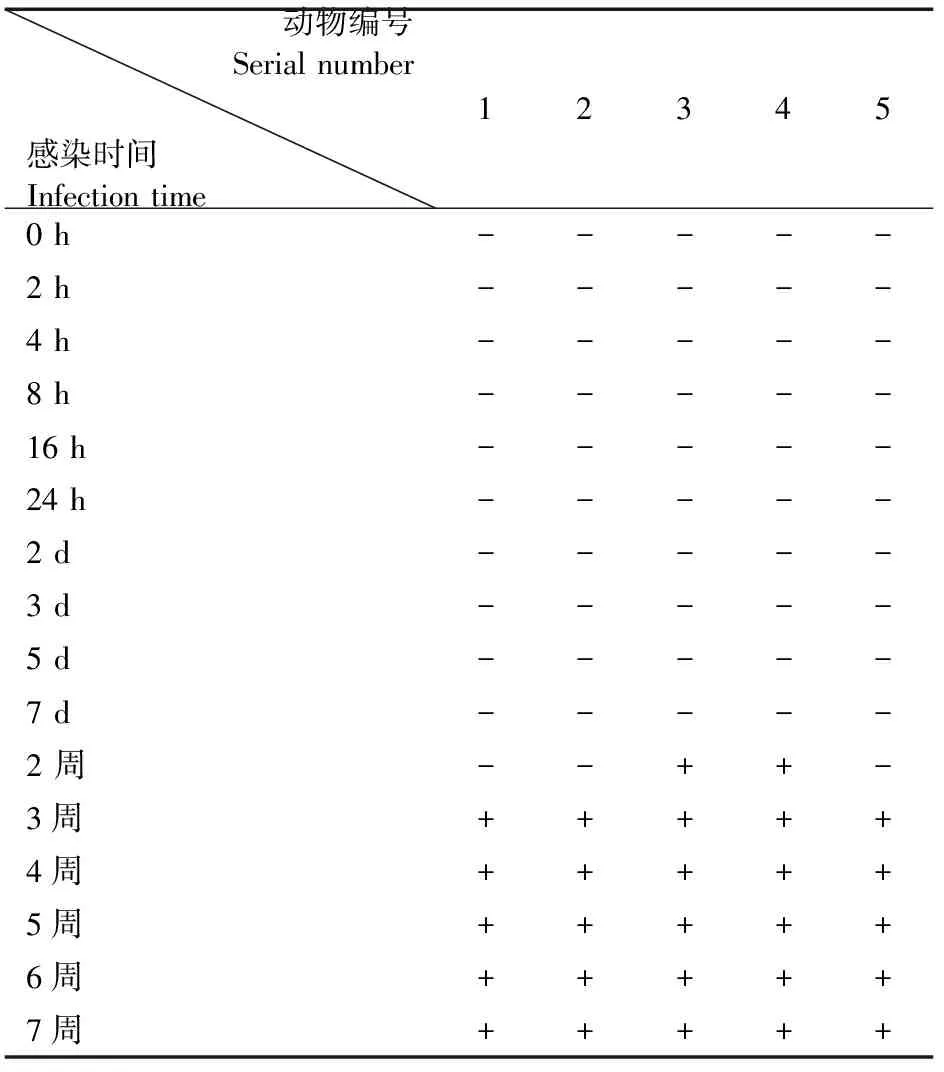
表1 IFA法对小鼠感染MNV-1后不同时间血清检测结果
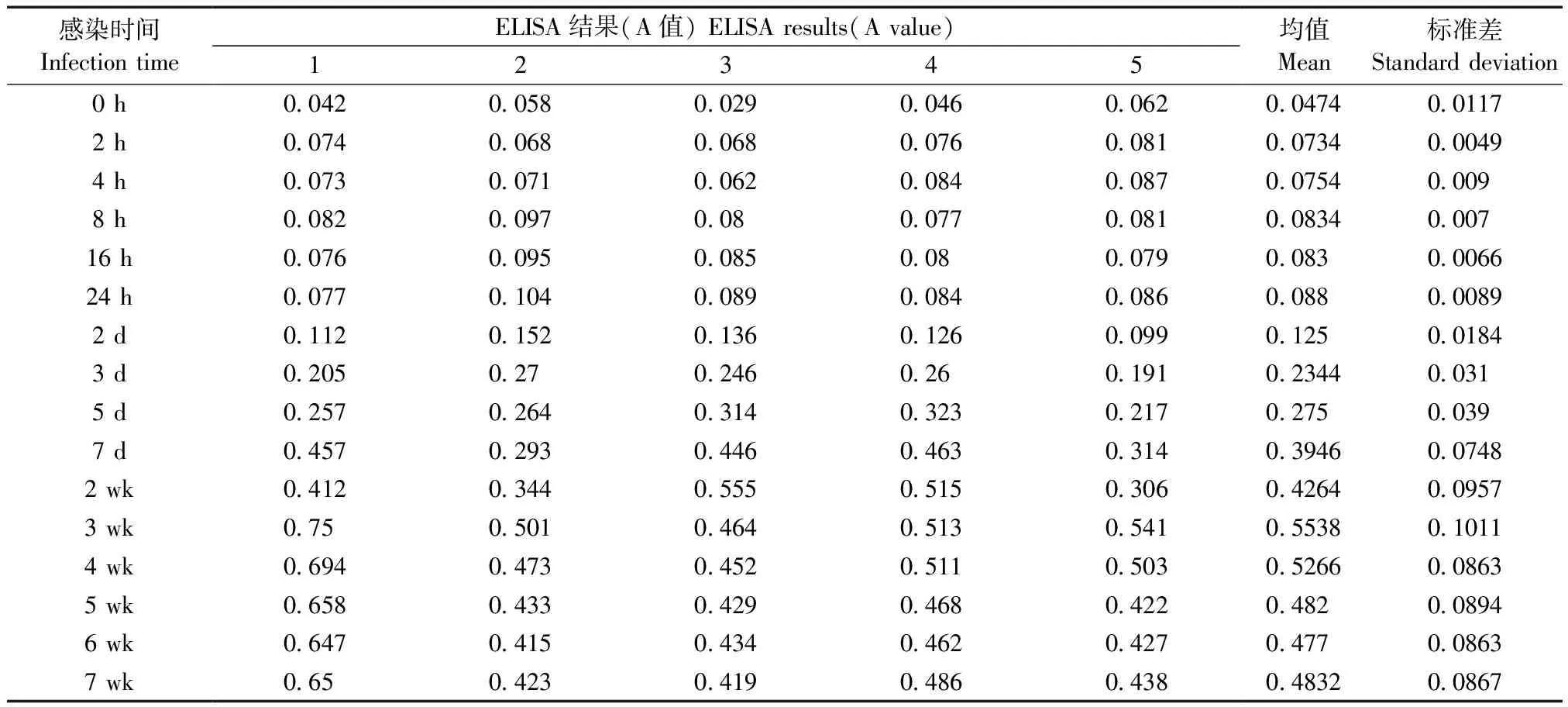
表2 ELISA法对小鼠感染MNV-1后不同时间点血清检测结果
2.3 ELISA 试剂盒对血清样品的检测

图3 ELISA法对小鼠感染MNV-1后不同时间血清检测结果
取不同感染时间的小鼠血清进行ELISA检测(每个时间点采5只小鼠血清样品),统计其吸光值(表2),根据吸光值的结果计算出血清中抗体存在情况。小鼠感染MNV-1 16 h后,血清中的MNV-1抗体明显增加,感染后两周时血清可判定为阳性,感染3周后,血清中抗体达到峰值,随后有微弱的下降,4~7周数值无明显变化(图3)。
2.4 IFA法与ELISA法检测结果对比
分别用IFA法与ELISA法检测80份小鼠血清,IFA法测定阳性27份,阴性53份,ELISA法测定阳性32份,阴性48份。差异样品用Western blot法进行验证,结果显示,5份差异血清中3份血清为弱阳性,2份为阴性。两种结果对比显示IFA法检测符合率为96.0%,ELISA法符合率为97.5%。
3 讨论
随着对小鼠诺如病毒的认识逐渐加强,越来越多的设施中检出到实验小鼠感染诺如病毒的情况。北美、欧洲、亚洲(韩国和日本)等地区均有实验小鼠感染MNV的报道,相关报道也见于我国上海、广东等地区。研究表明小鼠诺如病毒能够使小鼠发生一系列的炎症反应甚至死亡。因此,在进行实验研究的过程中,排除小鼠诺如病毒的干扰,保证实验结果的准确性非常必要[5]。
针对小鼠诺如病毒的检测,酶联免疫吸附试验法试剂盒已经商品化,其快速准确的特点收到多个实验动物使用单位青睐,但其特异性较差。常规PCR法及也能够有效的检出小鼠诺如病毒的存在,尤其是real-time PCR的灵敏度可以达到几十个甚至十几个拷贝数[6],由于不同种类的小鼠诺如病毒序列间存在一定的差异,real-time PCR作为一种高度特异的检测方法,可能无法同时满足多种小鼠诺如病毒的检测。
间接免疫荧光法是一种非常传统的病毒检测方法,在免疫学、生物化学和荧光显微镜技术的基础上建立起来的一项标记检验技术,检测时间短、操作容易、特异性好。检测抗原是采用胞内全病毒,具有较高的特异性不,但其灵敏度略有不足。ELISA法灵敏度高,对血清样品的要求也高,微溶血或有其他杂微生物的污染对检测结果都有非常大的影响。
综上所述,IFA法和ELISA法虽然都能够对小鼠诺如病毒进行常规检测,但这两种方法都不能够完全真实的反应出小鼠的感染情况,在对设施中的实验小鼠进行MNV排查时,建议采用IFA法或ELISA法作为初筛方法,对结果可疑的样品,可采用Western blot法进行验证,才能够得出真实可靠的结果。
参考文献:
[1] Patel MM, Widdowson MA, Glass RI, et al. Systematic literature review of role of noroviruses in sporadic gastroenteritis [J]. Emerg Infect Dis, 2008, 14(8):1224-1231.
[2] Wobus CE, Thackray LB, Virgin HW IV. Murine norovirus: a model system to study norovirus biology and pathogenesis [J]. Virology, 2006, 80(11):5104-5112.
[3] Ison CA, Tanna A, Easmon CSF. Evaluation of a fluorescent monoclonal antibody reagent for identification of cultured Neisseria gonorrhoeae [J]. Med Microbiol, 1988, 26(2):121-123.
[4] Vashist S, Urena L, Goodfellow I. Development of a strand specific real-time RT-qPCR assay for the detection and quantitation of murine norovirus RNA [J]. J Virol Methods, b2012, 184( 1-2):69-76.
[5] 田胜男, 刘云波. 鼠诺如病毒概述 [J]. 中国比较医学杂志, 2013, 23(7):68-71.
[6] 白露 叶伟, 于蒙蒙, 等. 两种方法检测汉坦病毒滴度的比较研究 [J]. 科学技术与工程, 2012, 12(9):2137-2141.
