小豆蔻明诱导K562细胞凋亡及其相关凋亡蛋白的表达
2014-08-14沈一平沈嫣婧楼正青丁志山
翟 斡,沈一平,沈嫣婧,楼正青,丁志山
(1. 浙江省立同德医院,浙江 杭州 310012;2. 浙江省中医院,浙江 杭州 310006; 3. 杭州市中医院,浙江 杭州 310007;4. 浙江中医药大学,浙江 杭州 310053)
小豆蔻明(cardamonin),分子式:C16H14O4,分子量:270.28,化学结构为 2’,4’-二羟基-6’-甲氧基查尔酮,姜科植物草豆蔻中含量较多。最近有文献报道小豆蔻明具有调节糖代谢[1]、舒张血管[2]、抗炎[3]、抗肿瘤[4-6]等作用。本文将从PTEN/PI3K/Akt通路阐述小豆蔻明诱导K562细胞凋亡机制,继续从人慢性粒细胞白血病(CML)发病的分子水平寻找新的治疗手段。
1 材料和方法
1.1 实验细胞及实验材料
人慢性粒细胞白血病细胞株K562,由浙江省中医院血液科实验室提供,实验采用对数生长期K562细胞。小豆蔻明(纯度>98%)批号:110763 北京世纪奥科生物技术有限公司。胎牛血清购自杭州四季青生物工程材料公司,RPMI1640培养液;Trizol RNA提取试剂盒、逆转录聚合酶链反应(RT-PCR)试剂盒、DEPC、dNTP、Random primers均为TaKaRa生物公司产品。PCR引物(由上海生工生物技术服务公司合成):β-actin:上游5′-CAGTCCACCATCC AATGCAC-3′,下游5′-CCATCCACCT GCCTGTTGTA-3′,大小598bp。Bcl-2:上游5′-CTTCGCCGAG ATGTCCAG-3′,下游5′-GGCTCAGATAGGCA CCCA-3′,大小369 bp。Bax:上游5′-CCTTTTG CTTCAGG GTTT-3′,下游5′-TCTTCCAGATGGTGAGTGAG-3′,大小321 bp。羊抗兔二抗 批号:G130321 Epitomics,PTEN一抗批号:YH092107 Epitomics,p-Akt一抗批号:B8501ImmunoWay Biotechnology,NF-κB一抗批号:130809W博奥森生物公司,Bcl-2一抗批号:R080429华安生物公司,β-actin引物购买于华美生物工程公司。
1.2 方法
(1)细胞培养、配药、加药。将K562细胞接种于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI1640培养液中,37℃、5% CO2、饱和湿度的培养箱中常规培养。取小豆蔻明5 mg溶于1 mL的二甲基亚砜(DMSO)震荡、配置成5 mg/mL母液。取4 μL的母液+36 μL的DMSO配置成0.5 mg/mL的工作液40 μL,96孔板中每200 μL的细胞液加入2 μL工作液,终浓度为5 μg/mL;类似方法配置药物、加药,加药后各孔混匀。各组的梯度终浓度为0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL。(2)普通光镜观察细胞形态学。加药后24 h,普通光镜下观察细胞生长状况。(3)MTT测定生长抑制率。各组加药后24 h、48 h、72 h,每孔加入5 mg/mL的MTT溶液20 μL,混匀37℃继续孵育2 h后,离心后加入DMSO 150 μL,混匀10 min后于490 nm波长处用酶标仪测定各吸光度值(A),按公式(生长抑制率(%)=1-实验组A值/对照组A值 × 100%)计算抑制率。(4)细胞凋亡率检测。收集小豆蔻明(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL)作用24 h后的细胞,PBS漂洗两次细胞,取3×105个的细胞,按照流式试剂盒说明书加入AV、PI;15 min后于流式细胞仪检测。(5)RT-PCR检测相关基因的表达。收集小豆蔻明(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL)作用24 h后的细胞5×105个,提取细胞总RNA。cDNA的合成。PCR反应步骤:95℃ 3 min预变性,95℃ 5 s,60℃ 45 s,循环40次。溶解曲线分析要求95℃ 15 s,60℃ 15 s,缓慢上升至95℃ 15 s。(6)Western blot检测相关蛋白表达。收集小豆蔻明(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL)作用24 h后的细胞3×105个,提取蛋白、配胶,电泳、转膜、封闭、一抗、二抗杂交、显影。
1.3 统计学方法
2 结果
2.1 普通光镜观察
小豆蔻明作用K562细胞48 h后,细胞数量明显减少,形态由圆形变为不规则,出现凋亡小体,细胞体积缩小,胞膜皱缩,不均匀,碎片逐步增多。说明K562细胞出现了凋亡现象,随着小豆蔻明浓度的增加,这种凋亡现象更加明显。(图1)
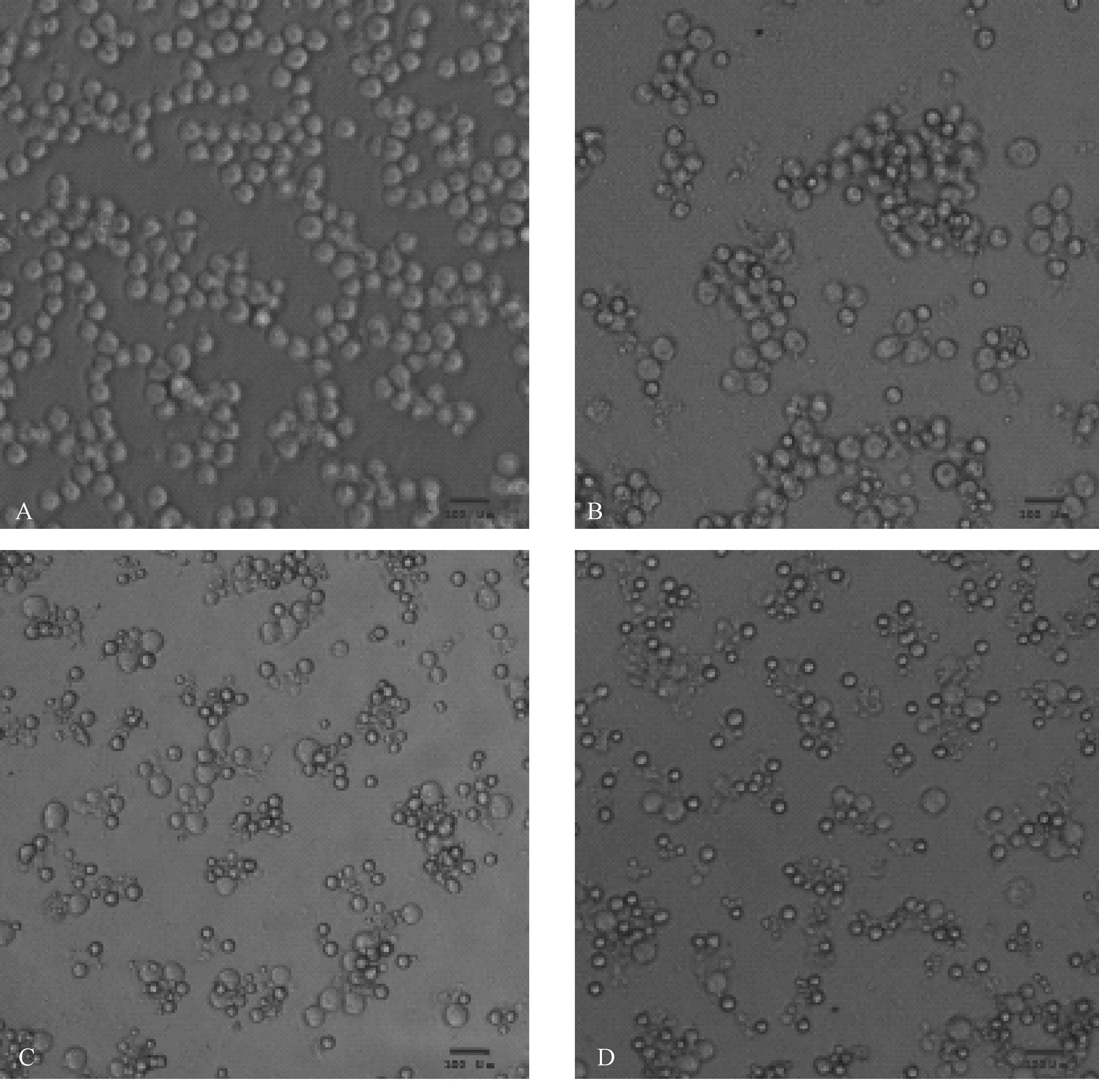
A空白组图;B小豆蔻明5μg/mL;C小豆蔻明10μg/mL;D小豆蔻明20μg/mL
2.2 MTT法检测小豆蔻明对K562细胞的抑制率
小豆蔻明作用K562细胞24 h、48 h、72 h后,细胞出现不同程度的抑制作用,抑制率随着小豆蔻明浓度及时间的增加而增加,呈现量效和时效关系。小豆蔻明(30 μg/mL)组增殖未见明显增加。小豆蔻明(10 μg/mL)作用K562细胞48 h抑制率梯度明显,故选用小豆蔻明(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL)作用K562细胞48 h为随后实验选用细胞,小豆蔻明作用K562细胞48 h,IC50=13.42 μg/mL(见表1,表2)。
2.3 流式结果
提示小豆蔻明(空白组(0 μg/mL)、5 μg/mL、10 μg/mL、20 μg/mL)处理K562细胞48 h后,K562细胞的早期凋亡率分别为(13.52±1.38)%、(19.15±2.06)%、(28.33±1.61)%左右,与空白组(凋亡率(1.4±0.6)%)均有显著增加(P<0.05),K562细胞表现出明显的凋亡,凋亡率随着小豆蔻明浓度的增加而增加,而且呈现剂量依赖关系(图2)。

表1 小豆蔻明作用K562细胞48 h后的MTT结果分析
2.4 RT-PCR结果
RT-PCR结果表明,梯度剂量的小豆蔻明(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL)处理K562细胞48 h后,细胞内Bcl-2、Bax的mRNA表达变化明显,Bcl-2 mRNA的表达较空白组明显下降(P<0.05),Bax mRNA的表达较空白组明显升高(P<0.05),Bax、Bcl-2的mRNA表达与小豆蔻明呈浓度依赖性(表3)。

表2 小豆蔻明(10 μg/mL)作用K562细胞不同时间的MTT结果分析

表3 小豆蔻明作用K562细胞48h后细胞内Bcl-2、Bax的mRNA表达量变化
2.5 不同浓度的小豆蔻明(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL)处理K562细胞48 h后检测PTEN、p-Akt、NF-κB、Bcl-2蛋白
结果提示,PTEN蛋白表达量随小豆蔻明的浓度增加明显增加,p-Akt、NF-κB、Bcl-2蛋白表达量随小豆蔻明的浓度增加明显减少(图3)。
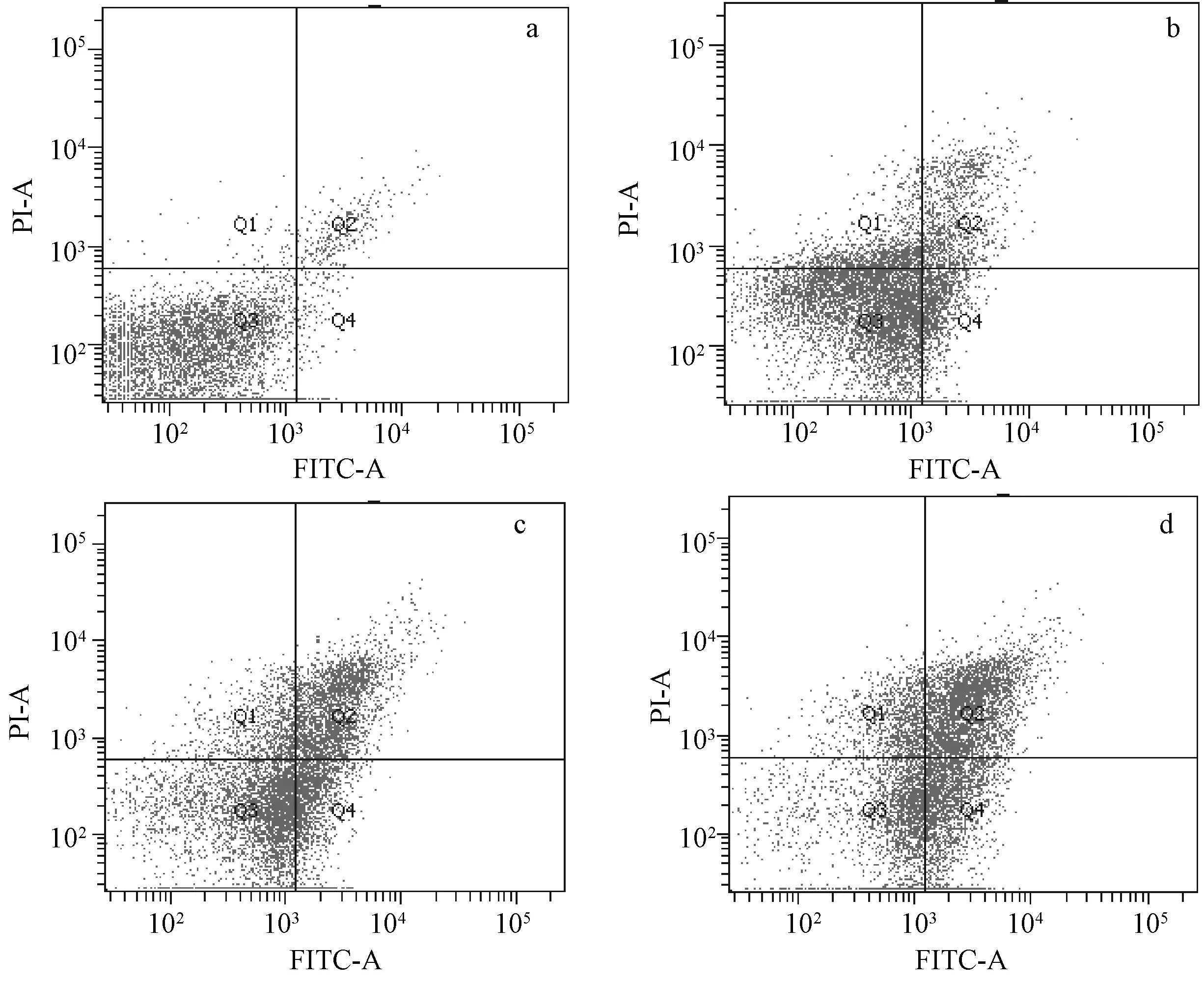
a空白组图;b小豆蔻明5 μg/mL;c小豆蔻明10 μg/mL;d小豆蔻明20 μg/mL

图3 K562细胞中PTEN, p-Akt, NF-κB, Bcl-2蛋白表达量的变化
3 讨论
1977年Li等首先报道PTEN,定位于10q23.3的一种抑癌基因。在生理情况下,PTEN可以抑制Akt通路的过度活化。通过使磷脂酰肌醇D3环去磷酸化,抑制PI3K活化,负性调节PI3K/Akt/PKB通路。抑制细胞增殖,促进细胞凋亡[7]。而在病理情况下,PTEN表达减弱或缺失,失去对PI3K/Akt通路的抑制作用,肿瘤发生。目前报道在大多实体瘤及骨髓瘤中PTEN 基因存在不同程度的突变或缺失。PTEN在造血系统疾病中的研究也逐渐增多[8]。试验中小豆蔻明处理K562细胞48 h后检测到PTEN蛋白表达量明显增加,小豆蔻明具有促进抑癌蛋白量表达的作用,PTEN表达量增加进而抑制了PI3K的活化,抑制PI3K/Akt 通路的活化,促进肿瘤细胞凋亡,调节细胞增殖周期。
PTEN+PI3K/Akt是人体细胞内重要的信号转导通路之一,广泛参与到细胞的各项生理病理功能活动中。激活的PI3K可激活Akt,其从胞膜转移到胞核:终止Bad对抑凋亡蛋白Bc1-2和Bcl-XL的拮抗作用;解离IκB、NF-κB二聚体,促进下游基因的表达;通过作用于P21、P27、cyclinDl调节细胞周期和增殖;作用于mTOR和P70S6K激酶通路调节细胞生长,等等。
P13K/Akt通路的活化在肿瘤发生中表现为抑制细胞凋亡。酪氨酸激酶、mTORC2、表皮生长因子(EGF)、血小板衍生因子(PDGF)、胰岛素样生长因子(IGF-1)、白介素-6(IL-6)等均可活化PI3K/Akt通路。活化的Akt可进一步活化下游IκBs,导致IκB从三聚体(p50、p65、IκB)中解离出来,NF-κB暴露出核内结合位点受体p50、p65,与核内的Rel类蛋白质二聚体转录因子结合,导致下游的基因转录(如IL-1、IL-2、IL-3、IL-6、IL-8、MIP-IA、ICAM-1、VCAM-1、Bcl-xl、cyclin Dl等)。同时NF-κB与Bcl-2家族基因(bcl-2、bcl-xl)上游启动子区域(κB)位结合,抑凋亡蛋白的表达增加。
He等[9]运用小豆蔻明及类似物抑制肺腺癌细胞的NF-κB通路而促进癌细胞凋亡。秦铀等[10]报道;小豆蔻明通过抑制骨髓瘤细胞NF-κB通路上游蛋白活性抑制NF-κB解离,抑制STAT3 通路下游的基因产物,诱导骨髓瘤细胞凋亡。本实验中小豆蔻明处理K562细胞后,抑制了Akt的活化,p-Akt蛋白量减少,减少了IκB的活化,抑制NF-κB从三聚体(p50、p65、IκB)中解离,减少了下游抑凋亡蛋白的表达,及一些具有导致细胞分裂周期失衡,增殖过度活跃作用的细胞因子的表达释放。促进肿瘤细胞的凋亡。
活化的Akt可以进一步活化胞浆中促凋亡蛋白(Bax、Bad等),释放抗凋亡蛋白,增加胞浆中游离的抗凋亡蛋白(Bcl -2、Bcl-XL等)的量。Bad广泛存在于线粒体外膜上。静息状态Bad、Bax可与Bcl-2形成复合体,具有促进凋亡作用[11]。活化的Akt可以磷酸化Bad,活化的Bad就脱离了其与Bcl-2形成二聚体复合物,仅仅Bad是不能促进细胞凋亡的,此时胞浆中存在大量游离的抗凋亡因子Bcl-2,进而起到抑制细胞凋亡的作用,小豆蔻明处理K562细胞后,抑制Akt的活化,导致Bad与Bcl-2形成复合体,减少胞浆中游离抑凋亡蛋白Bcl-2表达量,RT-PCR提示同时Bcl-2基因的表达量减少与NF-κB抑制Bcl-2家族基因(Bcl -2、Bcl-XL)的表达有关。即减少胞浆中游离的Bcl-2蛋白,又减少了Bcl-2基因的翻译。从而使小豆蔻明达到促进K562细胞凋亡的作用。
舒向荣等[12]报道;在分子水平证实小豆蔑明通过caspase和PARP活化途径诱导骨髓微环境中MM细胞的调亡机制。也有文献[13-15]报道小豆蔻明通过抑制mTOR及其下游蛋白而抑制细胞的增殖及新生血管的生成。小豆蔻明抗肿瘤是多重效应的,还要继续从分子层面深入研究小豆蔻明抗肿瘤机制。深入研究慢性粒细胞性白血病的发病机制。为小豆蔻明的动物及临床试验做铺垫。
参考文献:
[1] Yamamoto N,Kawabata K,Sawada K,et al. Cardamonin stimulates glucose uptake through translocation of glucose transporter-4 in L6 myotubes [J]. Pyhtother Res, 2011, 25(8): 1218-1224.
[2] Fusi F, Cavalli M, Mulholland D, et al. Cardamonin is a bifunctional vasodilator that inhibits Ca(v)1.2 current and stimulates K(Ca)1.1 current in rat tail artery myocytes [J]. Pharmacol Exp Ther, 2010, 332(2):531-540.
[3] Hatziieremia S, Gray AI, Ferro VA, et al. The effects of cardamonin on lipopolysaccharide-induced inflammatory protein production and MAP kinase and NFkappaB signalling pathways in monocytes/macrophages [J]. Br J Pharmacol, 2006, 149(2):188-198.
[4] Park MK, Seung HJ, Lee HJ, et al. Novel suppressive effects of cardamonin on the activity and expression of transglutaminase-2 lead to blocking the migration and invasion of cancer cells [J]. Life Sci, 2013, 92(2):154-160.
[5] Hyeonseok K, Young-J K, Evangeline CA, et al. Induction of autophagy by dimethyl cardamonin is associated with proliferative arrest in human colorectal carcinoma HCT116 and LOVO cells [J]. J Cellular Biochem, 2011, 112(9):2471-2479.
[6] Yadav VR, Prasad S, Aggarwal BB, et al. Cardamonin sensitizes tumour cells to TRAIL through ROS- and CHOP-mediated up-regulation of death receptors and down-regulation of survival proteins [J]. Br J Pharmacol, 2012, 165(3):741-753.
[7] Monticl-DC, Cordeu L, Agirre X, et al. Resistance to imatinib mesylate-induced apoptosis in acute lymphoblastic leukemia is
associated with PTEN down regulation due to promoter hypermethylation [J]. Leuk Res, 2008, 32(5): 709-716.
[8] Omer HY, Valdez R, Brian KT, et al. Pten dependence distinguishes haematopoietic stem cells from leukaemia-initiating cells [J]. Nature, 2006, 441(7092):475-482.
[9] He WY, Jiang Y, Zhang XB, et al. Anticancer cardamonin analogs suppress the activation of NF-kappaB pathway in lung cancer cells [J]. Mol Cell Biochem 2014, 389(1-2): 25-33.
[10] 秦铀, 胡豫. 小豆蔻明抗多发性骨髓瘤多重效应及其分子机制 [D]. 武汉, 华中科技大学, 2011: 1-119.
[11] Sawa H, Kobayashi T, Mukai K, et al. Bax overexpression enhances cytochrome c release from mitochondria and sensitizes KATOIII gastric cancer cells to chemotherapeutic agent-induced apoptosis [J]. Int J Oncol, 2000, 16(4):745-754.
[12] 舒向荣, 胡豫. 小豆蔻明诱导骨髓微环境中多发性骨髓瘤细胞Caspase依赖性凋亡 [D]. 武汉, 华中科技大学, 2013:1-91.
[13] 郑炜, 史道华. 小豆蔻明对人脐动脉平滑肌细胞增殖的影响及机制研究 [J]. 中国中药杂志, 2010, 35(17):2318-2323.
[14] 汤莹. 小豆蔻明基于mTOR作用靶标的研究 [D]. 福建, 福建医科大学, 2010:1-61.
[15] 薛增贵. 基于mTOR靶标小豆蔻明抑制肿瘤血管生成及其机制的研究 [D].福州, 福建医科大学, 2013:1-43.
