新发高致病性禽流感H5N1病毒的致病性、传播力研究及进化分析
2014-08-14许黎黎鲍琳琳李枫棣
袁 静,许黎黎,鲍琳琳,吕 琦,李枫棣,于 品,秦 川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
流感是由流感病毒引起的一种急性呼吸道传染病,它通过飞沫传播,能在短时间内迅速蔓延。1997年香港首次报道了18例人感染高致病性H5N1禽流感病例,其中6例死亡,感染的临床特征包括骤然发热和上呼吸道感染等典型流感症状,许多病人出现严重并发症,主要有肺炎、胃肠道症状、肝酶升高和肾衰[1]。其后,全球已经有15个国家和地区相继出现了人禽流感病例和有限的人际间传播报道[2]。时至2011年底,世界卫生组织(WHO)共累计接收人感染H5N1病例报告584例,死亡345例,病死率接近60%[3],远高于2003 年全球严重急性呼吸综合症(SARS)疫情时11%的总体死亡率。鉴于甲型流感病毒高度变异和2009年出现的新型甲型H1N1流感全球大流行,高致病性禽流感H5N1病毒仍然是引起全球流感大流行疫情的潜在病原之一,散在出现的人际间传播事件表明H5N1病毒一旦突破物种间屏障而在人群中流行,必将成为世界各国所面临的巨大公共卫生威胁之一,将会给人类的生存和发展带来灾难性打击。
2011年底,香港再度爆发禽流感,死亡的红嘴鸥证实感染禽流感H5N1病毒, 并且其基因序列与同期深圳死亡患者高度同源,此次疫情再次提醒我们,在环境选择压力下,禽流感H5N1病毒不断的抗原漂移现象可能随时导致其跨越物种屏障,从而实现对人群的感染。因此,加强对新发H5N1病毒感染性及传播力的研究,对于防范可能发生的禽流感疫情,具有非常重要的现实意义。
本文拟对2011年底香港死亡红嘴鸥所携带的、与深圳死亡患者分离株高度同源的H5N1病毒进行感染性评价,证实其是否确实具有在人类细胞中增殖的能力,并对该毒株体外基于细胞水平的复制能力以及体内基于小鼠模型的毒力与致病性进行研究,与迄今为止毒力最强的H5N1毒株A/Shenzhen/406H/2006及WHO推荐的禽流感H5N1疫苗制备株A/Vietnam/1194/2004进行比较。同时,设立攻毒组与同居组,对新发H5N1病毒能否在小鼠群体间传播进行评测,从而对新病毒的传播力进行研究。此外,通过对病毒的HA基因进行测序及序列分析,构建病毒的进化树,分析其分子遗传进化地位。研究结果对于应对未来可能出现的禽流感疫情具有非常重要的现实意义。
1 材料和方法
1.1 材料
1.1.1 病毒: 本研究所使用毒株详情参见表1,均由香港大学陈洪霖教授惠赠。体外细胞感染实验及体内动物攻毒实验都按照WHO指导原则在ABSL-3实验室中进行。
1.1.2 细胞:犬肾细胞MDCK、人肺腺癌细胞A549、及小细胞肺癌细胞NCI-H446均于本课题组保存。
1.1.3 实验动物:5周龄SPF级雌性BALB/C小鼠由医科院医学实验动物研究所提供(合格证号:SCXK(京)2006-0009)(实验室许可证号:ILAS-PC-2012-002)。
1.2 方法
1.2.1 体外(Invitro)细胞感染实验:细胞在含有10%胎牛血清的DMEM(Invitrogen)中培养,将102TCID50的病毒液接种于培养在直径35 mm培养板内的单层细胞中,37℃吸附60 min,加入10 mL无血清培养基、含TPCK的胰蛋白酶(0.5 μg/mL)和双抗。分别在感染细胞后12,24,36,48,56,72 h收集250 μL病毒上清液,3000 r/min离心10 min,取上清通过Real-time PCR测定病毒核酸载量。
1.2.2 体内(Invivo)小鼠感染实验:每组12只小鼠分为组1(8只)及组2(4只)。将小鼠按0.02 mL/g比例肌注三溴乙醇麻醉后,通过滴鼻途径对小鼠进行攻毒,每只小鼠接种102TCID50病毒液50 μL。组1小鼠连续观察14 d,记录临床表征和死亡率。组2小鼠在攻毒后第5天,安乐后取肺组织,通过Real-time PCR测定病毒核酸载量。
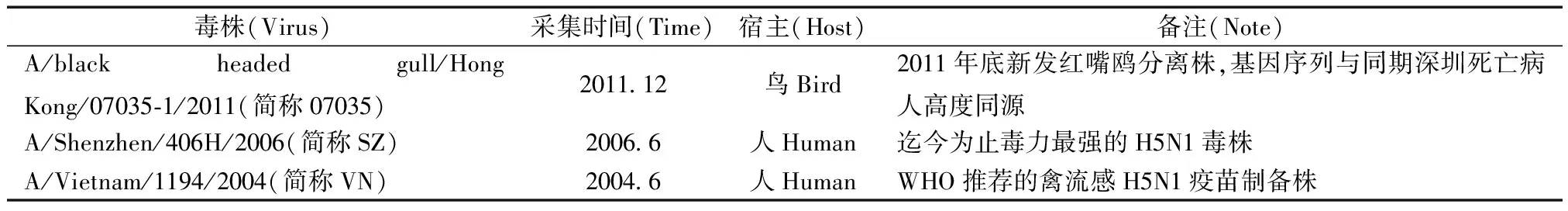
表1 本研究中所使用的高致病性禽流感H5N1病毒详情
1.2.3 小鼠同居实验:18只小鼠随机分配于两个鼠盒中,每盒9只,其中3只标记后通过滴鼻途径进行攻毒,另外6只同笼饲养。第一盒同居小鼠于攻毒后5,8,11 d各安乐2只,取肺组织,测定病毒核酸载量及滴度。第二盒同居小鼠于攻毒后14,21,28 d各摘除2只小鼠的眼球获取血清,通过血凝抑制实验及微量中和实验测定抗体效价。
1.2.4 Real-time PCR:小鼠肺组织研磨成匀浆,从上清液中提取RNA(Qiagen),溶于30 μL Diethyl pyrocarbonate(DEPC)处理过H2O中,保存于-80℃。取8 μL RNA进行逆转录cDNA的合成,加入到总体积为20 μL,含有200 U Superscript Ⅲ逆转录酶((Invitrogen)的反应体系中。实时荧光定量PCR检测体系为20 μL,包括10 μL 2× SYBR Green荧光染料Mix (ABI),各1 μL 10 μmol/L的正向和反向引物(NP-688F: 5′-ttccaaacagcagcacaaag-3′, NP-817R:5′-tatgggccaatgatcctctc-3′),2 μL cDNA模板和6 μL无RNA酶的H2O。热循环条件,94℃ 3 min,94℃ 30 s,58℃ 30 s,72℃ 30 s,35个循环。每个循环结束后读取荧光值。
1.2.5 血凝抑制实验(HI):先用Receptor-destroying enzyme(RDE)酶处理血清,1份血清加入3份RDE酶工作液,37℃水浴12~16 h后56℃灭活30 min。将1份浓缩火鸡血和10份RDE酶工作液处理过的灭活血清(200 uL)充分混匀,4℃放置1 h,重悬后1200 r/min离心5 min,取上清,向其中加入2.5倍血清体积的PBS溶液即得到工作血清。96孔V型板除第一列(共八列)外,每孔加入25 μL的PBS,在第一,二,八列每孔加入25 μL工作血清,从第二列移取25 μL,由第二到第七列对倍稀释,每孔加入25 μL新调制的4HA病毒液(最后一列除外),充分混匀,室温静置40 min,每孔加入1%火鸡血50 μL,室温静置30 min观察结果。将96孔V型板垂直竖起,观察孔底红细胞滑下速度,待对照孔内红细胞自由下滑呈泪滴状时读结果,红细胞下滑速度与对照相同者为完全抑制,完全抑制时的血清最高稀释度即抗体效价。
1.2.6 微量中和实验(MN):将攻毒后14、21、28 d的小鼠血清放在60℃水浴锅中灭活30 min,之后在96孔板中将待检血清用维持液稀释为1∶8、1∶16、1∶32……1∶1 024。将稀释好的血清100 μL/每孔分别与100 μL 102TCID50的病毒等量混合,37℃孵育1 h。将血清-病毒混合液接种于培养在96孔培养板内的单层MDCK细胞中,经3天培养观察细胞病变(CPE),同时吸取上清每孔50 μL,加入1%的火鸡血50 μL,混匀,静止30 min进行复核实验。
1.2.7 基因测序、比对、及进化树构建:病毒HA基因分为相互重叠的三段利用高保真PCR系统进行扩增(KOD plus,TOYOBO),所用引物序列为:HAF1(1~22): 5′-atggagaaaatagtgcttctt-3′;HAR1(651-671): 5′-ctctggttaagtgttgatgtc-3′; HAF2(481~502): 5′-agaaatgtgatatggcttatca-3′; HAR2(1201~1221): 5′-ctgagtgttcattttgtcaat-3′; HAF3(925~945): 5′-aacatacaccctctcaccatc-3′; HAR3(1693~1715): 5′-ctcacaaatttaaatgcaaattc-3′。扩增产物纯化后(QIAGEN)外送测序(中美泰和)。利用CLUSTAL W (version 1.83)软件对HA基因序列进行比对,利用MEGA5.0软件基于HA蛋白序列构建Neighbor-joining进化树,校验值(bootstrap)设为500。
1.2.8 数据统计分析:病毒核酸载量和滴度的数据处理运用SPSS 11.5软件包中DUNCAN及LSD法进行ANOVA单因素方差分析。
2 结果
2.1 新发H5N1毒株07035对人源肺细胞的感染性研究
将102TCID50的07035毒株分别感染人肺腺癌细胞A549及小细胞肺癌细胞NCI-H446,在感染细胞后12,24,36,48,56,72 h收集病毒上清液,取上清测定病毒核酸载量。结果显示,07035病毒可在A549细胞中有效复制,拷贝数从12~72 h呈持续增长态势(P<0.05),而其在NCI-H446中并不能增殖(图1),说明07035病毒在体外对人源肺细胞具有一定程度的感染性。
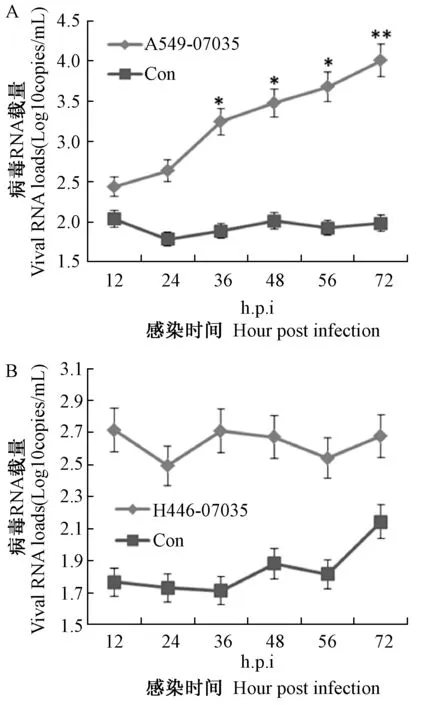
图1 07035毒株体外在人源肺细胞中的复制曲线。(A)A549细胞;(B)NCI-H446细胞
2.2 细胞水平(In vitro)病毒复制能力比较
将102TCID50的新发H5N1病毒07035、迄今为止毒力最强的SZ株、及WHO推荐的禽流感疫苗制备株VN分别感染MDCK细胞。病毒复制动力学结果显示,07035毒株在MDCK细胞中于56 h.p.i达到复制峰值,同时,从感染后12~72 h,07035在MDCK细胞中的复制能力较SZ与VN株稍低,但与后两者并不存在显著性差异(P>0.05)(图2)。
图2 07035毒株与SZ及VN株在MDCK细胞中复制能力比较
2.3 小鼠体内(In vivo)病毒毒力及致病性比较
将102TCID50的07035、SZ、及VN分别对BALB/c小鼠攻毒,通过观察小鼠的存活率,体重变化情况,肺组织中病毒核酸载量等,来对病毒的毒力及致病性进行比较。小鼠攻毒后连续观察14 d,其中感染SZ及VN株的小鼠100%死亡,而07035感染后小鼠仍有12.5%存活(图3)。SZ与VN感染的小鼠平均存活天数显著低于07035感染的小鼠(图4)。由图5可见SZ株感染的小鼠体重下降最为显著,其次为VN株,下降最少的为07035感染的小鼠。同时,Real-time PCR结果可见SZ与VN感染的小鼠肺组织病毒核酸拷贝数显著高于07035感染的小鼠(P<0.01)(图6)。因此,新发禽流感H5N1病毒07035对小鼠的致病性较目前毒力最强的SZ株及WHO推荐的疫苗制备株VN较弱,在进化的过程中暂未发生导致致病性增强的正向选择事件。
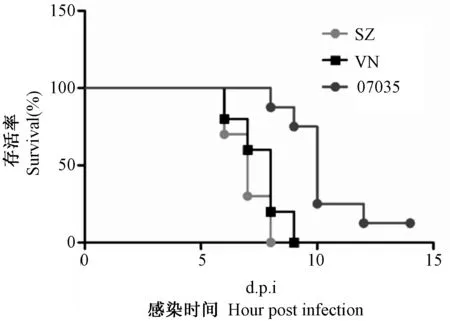
图3 102 TCID50的07035、SZ、VN株感染小鼠后的存活曲线

图4 102 TCID50的07035、SZ、VN株感染小鼠后的平均存活天数
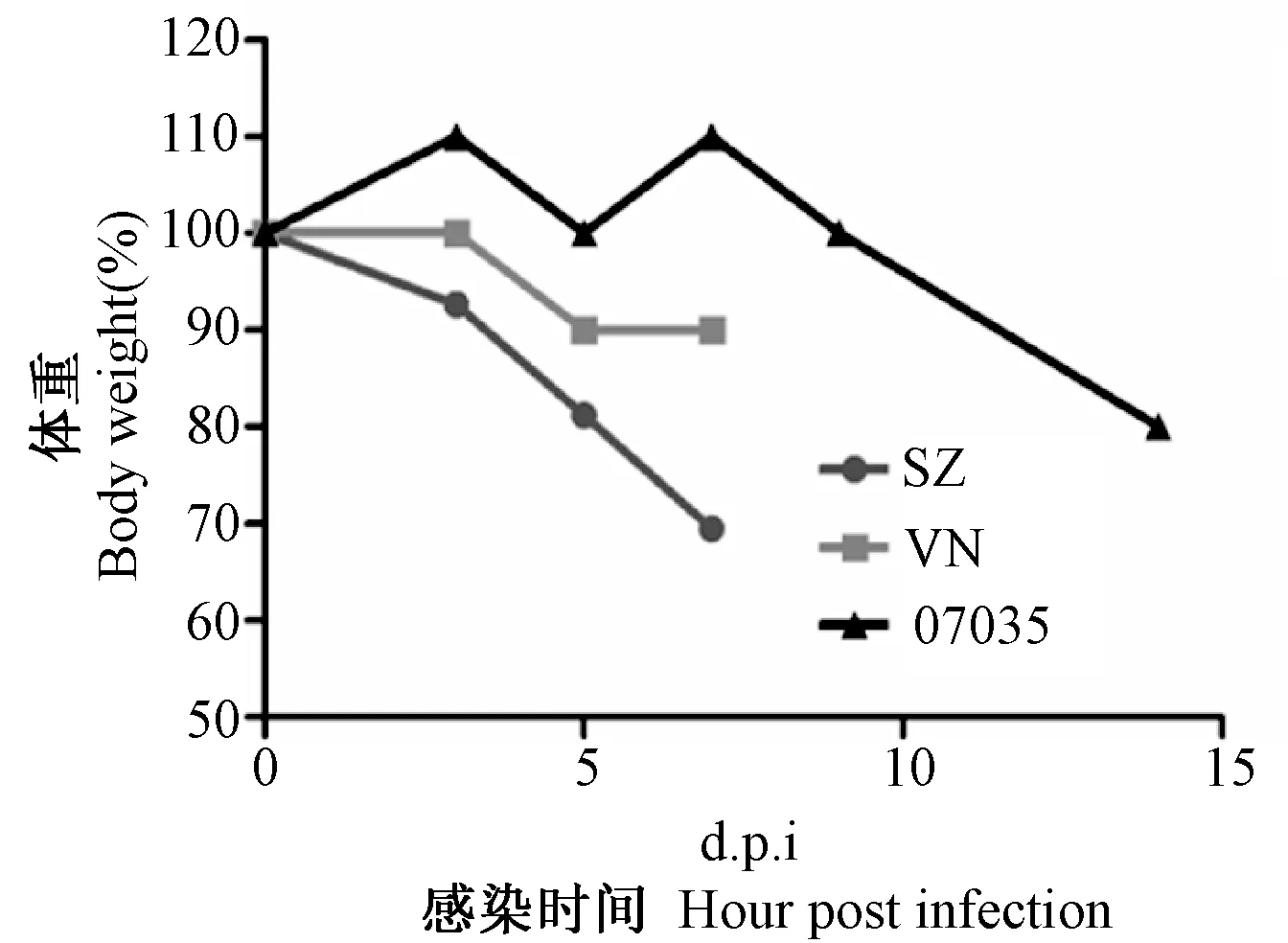
图5 102 TCID50的07035、SZ、VN株感染小鼠后的体重变化曲线
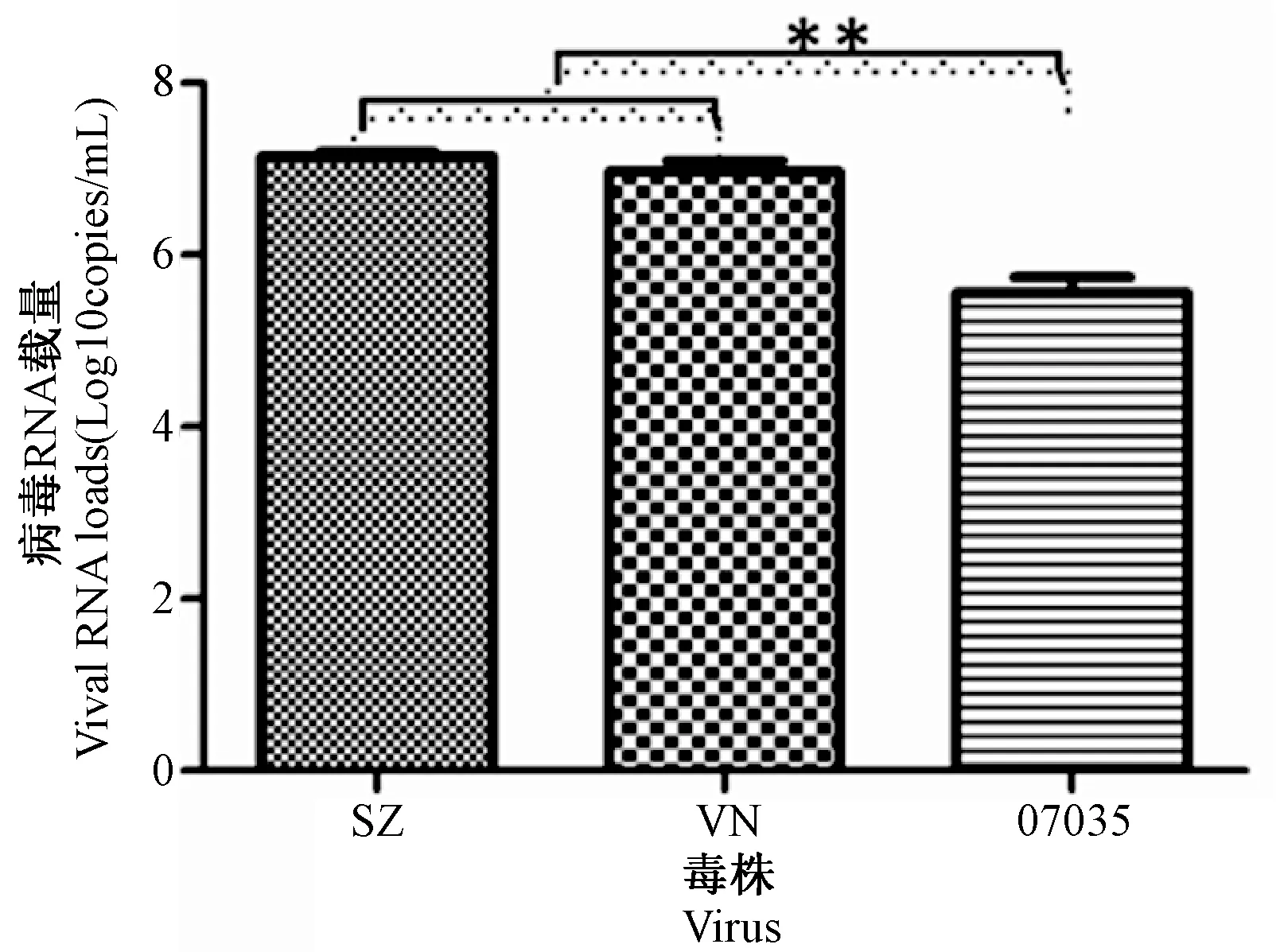
图6 102 TCID50的07035、SZ、VN株感染小鼠后第5天肺组织携带病毒核酸拷贝数
2.4 新发H5N1毒株07035在小鼠群体间的传播力研究
每盒9只小鼠中3只被攻毒的小鼠于感染后9 d内全部死亡,同居小鼠第5天及第8天肺组织检测不到病毒核酸载量,而第11天两只同居小鼠中的一只经Real-time PCR检测为阳性,拷贝数为6×108copies/mL。将PCR产物外送测序证实其与攻毒毒株07035 100%同源。此外,将该同居小鼠的肺组织上清接种MDCK细胞,传至第二代时出现典型CPE现象,测定其滴度为104.86TCID50。然而,同居小鼠第14,21,28天的血清经血凝抑制实验及微量中和实验检测,其结果均为阴性。以上结果证实07035毒株可在小鼠群体间进行有效传播,但诱发机体体液免疫保护程度较弱。
2.5 新发H5N1病毒的遗传进化分析
对07035的HA基因进行分段高保真PCR后外送测序,序列拼接后已提交至Genbank数据库中,登陆号为JQ922566。与WHO禽流感H5N1监测网络提供的各进化分支(Clade)代表株进行序列多重比对后,构建了HA蛋白的分子遗传进化树(图7)。结果证实07035的进化地位属于2.3.2.1,为近两年来的主流流行Clade。值得注意的是,与07035最为同源的毒株A/Guangxi/1/2009分离自我国广西一名因接触病死禽类而感染H5N1并导致死亡的18岁男孩体内。
3 讨论
图7 基于HA蛋白序列的分子遗传进化树
流感病毒特异性受体末端的N-乙酰基神经氨酸(又称为唾液酸)可与半乳糖以α2,3或α2,6键的方式结合,所形成的受体分别命名为α2,3唾液酸受体或α2,6唾液酸受体。通常情况下,人源流感病毒识别α2,6唾液酸受体,而禽源病毒识别α2,3唾液酸受体[4]。Shinya等[5]报道人呼吸道组织切片从鼻腔至终末和呼吸细支气管主要表达α2,6唾液酸受体,除鼻腔粘膜个别上皮细胞偶尔表达α2,3唾液酸受体外,其他部位缺乏α2,3唾液酸受体,相反,下呼吸道的呼吸细支气管与肺泡之间连接部的非纤毛立方细胞以及肺泡细胞表达α2,3唾液酸受体为主。因此理论状态下禽流感H5N1病毒并不具备在人际间通过空气经上呼吸道传播的能力。然而,目前仍有少量H5N1在人际间传播的散发案例的报道[6-9]。本研究中将攻毒鼠与健康鼠同笼饲养,健康鼠获得了感染,说明新发H5N1病毒可在小鼠群体间通过接触而传播。有学者曾用1997年的人(A/HK156/97)及鸡(A/Chicken/Hong Kong/258/97)H5N1分离毒株感染猪及小鼠,并将健康的猪及小鼠分别与攻毒动物同笼饲养,结果同笼饲养的猪、小鼠均未发生感染[10]。也有人用2.5 × 104TCID50的VN株感染家猫,并将健康家猫与感染猫同舍饲养,结果健康猫获得感染,这可能与所使用的毒株以及攻毒剂量等有关,另一方面也提示经过进化后病毒的致病力及传播力可能发生了变化[11]。H5N1病毒在禽类群体间拥有较明确的泄殖腔-口腔传播途径,而其在人类及哺乳动物之间能否进行传播,至今仍存在争议。2004年泰国动物园中大量虎发生H5N1感染,通过流行病学调查及病原学等研究认为病毒在老虎之间可能发生了水平传播[12]。自1997年以来,H5N1呈现出致病力逐渐增强的态势,体现在人感染后病死率的增加、病毒抗原特性的变化、内部基因的重排以及宿主范围的扩大等,提示H5N1在人与人之间传播的可能性大大增加,而近年来越南、泰国、印度尼西亚已出现H5N1病毒感染的家庭聚集现象[10, 13-17]。但也有人对此持反对意见,他们认为家庭成员所生活的环境、背景、生活习惯都基本相同,不能完全确定感染源,看护H5N1感染病人的护理员的血清抗体也均呈阴性[18-21]。 有学者担心H5N1病毒是否与人流感病毒发生了基因重组,从而使传播能力大大增强,设计了将H5NI病毒与引起1968年流感大流行的H3N2病毒杂交,杂交后的病毒能感染雪貂,但不能引起雪貂间的水平传播,说明杂交后的病毒传播力并没有增强,同时也提示人流感病毒与禽流感病毒的重组并不像我们想象中的那么容易,可能是一个非常复杂的过程[20]。但是,2011年底,来自荷兰的病毒学家Ron Fouchier和来自美国的病毒学教授Yoshihiro Kawaoka分别在某国际流感会议上扔下两枚重磅炸弹——他们对禽流感H5N1病毒进行基因改造,培育出的H5N1病毒变种已具备在雪貂间通过空气传播的能力,并暗示也具备在人际间传播的可能。说明H5N1病毒仍然是引起全球流感大流行疫情的潜在病原之一,加强对新发病毒感染性及传播力监测具有重要的现实意义。
本实验中健康鼠通过与攻毒鼠同笼饲养而获得了感染,再次证实H5N1已具备在哺乳动物之间进行传播的能力。传播的可能途径包括:空气飞沫、粪口污染、身体接触等多个方面,具体是通过何种方式进行传播还有待进一步的研究。尽管本研究结果显示新发 H5N1病毒07035对小鼠的致病性相比目前毒力最强的SZ株及WHO推荐的疫苗制备株VN较弱,在进化的过程中暂未发生导致致病性增强的正向选择事件。但07035毒株可在小鼠群体间进行有效传播且诱发机体体液免疫保护程度较弱的结果值得高度关注。尤其是与07035最为同源的毒株A/Guangxi/1/2009分离自我国广西一名因接触病死禽类而感染H5N1并导致死亡的18岁男孩体内,而且07035病毒在体外对人源肺细胞还具有一定程度的感染性,都说明新发禽流感H5N1病毒07035存在潜在传给人的威胁。若病人同时受人类流感病毒及禽流感病毒感染,就有可能成为病毒的“混合炉”,并存在产生在人群间传播能力的高致病性新型重组病毒的可能性。一旦出现这种情况,即意味着将会给人类的生存和发展带来灾难性打击的流感大疫情的爆发。
参考文献:
[1] Yuen KY, Chan PK, Peiris M, et al. Clinical features and rapid viral diagnosis of human disease associated with avian influenza A H5N1 virus. Lancet 1998;351:467-471.
[2] Maines TR, Szretter KJ, Perrone L, et al. Pathogenesis of emerging avian influenza viruses in mammals and the host innate immune response. Immunol Rev 2008;225:68-84.
[3] WHO. http://www.who.int/influenza/human_animal_interface/H5N1_cumulative_table_archives/en/index.html. 2012.
[4] Ito T, Couceiro JN, Kelm S, et al. Molecular basis for the generation in pigs of influenza A viruses with pandemic potential. J Virol 1998;72:7367-7373.
[5] Shinya K, Ebina M, Yamada S, et al. Avian flu: influenza virus receptors in the human airway. Nature 2006;440:435-436.
[6] Buxton Bridges C, Katz JM, Seto WH, et al. Risk of influenza A (H5N1) infection among health care workers exposed to patients with influenza A (H5N1), Hong Kong. J Infect Dis 2000;181:344-348.
[7] Tran TH, Nguyen TL, Nguyen TD, et al. Avian influenza A (H5N1) in 10 patients in Vietnam. N Engl J Med 2004;350:1179-1188.
[8] Ungchusak K, Auewarakul P, Dowell SF, et al. Probable person-to-person transmission of avian influenza A (H5N1). N Engl J Med 2005;352:333-340.
[9] Wang H, Feng Z, Shu Y, et al. Probable limited person-to-person transmission of highly pathogenic avian influenza A (H5N1) virus in China. Lancet 2008;371:1427-1434.
[10] Herfst S, Schrauwen EJ, Linster M, et al. Airborne transmission of influenza A/H5N1 virus between ferrets. Science 2012;336:1534-1541.
[11] Maher JA, DeStefano J. The ferret: an animal model to study influenza virus. Lab Anim (NY) 2004;33:50-53.
[12] van Riel D, Munster VJ, de Wit E, et al. Human and avian influenza viruses target different cells in the lower respiratory tract of humans and other mammals. Am J Pathol 2007;171:1215-1223.
[13] Sorrell EM, Wan H, Araya Y, et al. Minimal molecular constraints for respiratory droplet transmission of an avian-human H9N2 influenza A virus. Proc Natl Acad Sci U S A 2009;106:7565-7570.
[14] Imai M, Watanabe T, Hatta M, et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature 2012;486:420-428.
[15] Munster VJ, de Wit E, van den Brand JM, et al. Pathogenesis and transmission of swine-origin 2009 A(H1N1) influenza virus in ferrets. Science 2009;325:481-483.
[16] Maines TR, Jayaraman A, Belser JA, et al. Transmission and pathogenesis of swine-origin 2009 A(H1N1) influenza viruses in ferrets and mice. Science 2009;325:484-487.
[17] Yen HL, Lipatov AS, Ilyushina NA, et al. Inefficient transmission of H5N1 influenza viruses in a ferret contact model. J Virol 2007;81:6890-6898.
[18] Hu J, Zhao K, Liu X, et al. Two highly pathogenic avian influenza H5N1 viruses of clade 2.3.2.1 with similar genetic background but with different pathogenicity in mice and ducks. Transbound Emerg Dis 2012;60:127-139.
[19] Marinova-Petkova A, Georgiev G, Seiler P, et al. Spread of influenza virus A (H5N1) clade 2.3.2.1 to Bulgaria in common buzzards. Emerg Infect Dis 2012;18:1596-1602.
[20] Choi JG, Kang HM, Jeon WJ, et al. Characterization of clade 2.3.2.1 H5N1 highly pathogenic avian influenza viruses isolated from wild birds (mandarin duck and Eurasian eagle owl) in 2010 in Korea. Viruses 2013;5:1153-1174.
[21] Tung DH, Van Quyen D, Nguyen T, et al. Molecular characterization of a H5N1 highly pathogenic avian influenza virus clade 2.3.2.1b circulating in Vietnam in 2011. Vet Microbiol 2013;165:341-348.
