活性炭对含钴矿物生物浸出的催化作用
2014-08-13杨洪英佟琳琳刘媛媛
刘 伟,杨洪英,佟琳琳,刘媛媛
(东北大学 材料与冶金学院,沈阳 110819)
钴是继铜、铀、金之后第四个采用生物浸出技术处理的金属,自从20世纪50年代首次提出利用微生物浸出含钴矿物的概念以来,国内外众多学者利用氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)、氧化硫硫杆菌(Acidithiobacillus thiooxidans)和氧化亚铁微螺菌(Leptospirillum ferrooxidans)等浸矿细菌对各种类型含钴矿物[1−5]进行浸出研究,并取得了可喜成果。但是,浸出周期长、浸出速率慢的缺点仍没有得到很好地解决。
为了加快浸出速率,提高金属回收率,研究者们从生物学、电化学、冶金学等角度出发探索各种强化生物浸矿的方法,其中利用原电池效应强化生物浸矿的方法倍受关注。其原理是在浸出过程中加入静电位较高的矿物作阴极,如磁黄铁矿、黄铁矿、辉锑矿等,通过原电池效应,可加速静电位较低的阳极硫化矿物的溶解,提高金属浸出率[6−8]。由于活性炭是良导体,静电位高,比表面积大,且极其稳定,不溶于任何溶剂,因此是一种作为阴极的理想材料[9]。NAKAZAWA等[10]研究了活性炭对黄铜矿精矿生物浸出的影响。研究结果表明,活性炭的添加促进了黄铜矿的氧化溶解,随着活性炭添加量的增加铜回收率增加,同时Acidithiobacillus ferrooxidans的存在能够促进原电池作用。LIANG等[11]在研究活性炭对极端嗜热菌Acidianus manzaensis浸出黄铜矿的影响时,发现活性炭的添加能够降低[Fe3+]/[Fe2+]的比值,使浸出体系的氧化还原电位维持在较低值。在低电位条件下亚铁离子可还原黄铜矿,生成次生铜矿辉铜矿,促进黄铜矿的溶解。ZHANG等[12]在研究活性炭对低品位原生硫化铜矿的催化影响时也指出添加活性炭可以抑制细菌氧化溶液中的亚铁离子,降低浸出体系的氧化还原电位,促进黄铜矿的生物浸出。
虽然活性炭对黄铜矿生物浸出的催化作用已经被证实,但是活性炭对含钴矿物生物浸出的影响仍不明了。因此,本文作者以国外某矿山的钴矿石为研究对象,其中含钴矿物为硫铜钴矿。在浸出过程中添加活性炭,通过研究活性炭对钴矿物生物浸出的影响,探讨活性炭催化细菌浸钴的可行性。目前,国内外对活性炭催化细菌浸钴的研究鲜有报道。
1 实验
1.1 实验材料
1) 矿样。本实验所用的矿样为国外某矿山选矿过程中的中间产品,其主要元素含量见表 1。工艺矿物学研究表明[13],硫化矿物主要为硫铜钴矿、黄铜矿、斑铜矿、辉铜矿、铜蓝、黄铁矿。含钴矿物为硫铜钴矿,多数为单体硫铜钴矿,还有一部分为连生体,硫铜钴矿与其他矿物连生。脉石矿物主要为石英、长石、黑云母、透闪石等。矿样用球磨机细磨至粒度小于38 μm的占80%,备用。活性炭为果壳炭,购买自沈阳第五试剂厂。活性炭粉末粒度小于75 μm的占65%,活性炭颗粒粒径为2~3 mm。

表1 矿石中主要元素含量Table1 Content of main elements of ore (mass fraction, %)
2) 菌种与培养基。本研究所用菌种为ZY101菌,该菌种是以氧化亚铁硫杆菌为主的混合菌。经过驯化,该菌种具有优良的抗钴特性。培养基采用9K培养基。
3) 实验设备与仪器。HZQ−QX型恒温振荡箱(哈尔滨东联电子技术开发有限公司生产),TU−1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),pHS−25数显pH计(上海精密科学仪器有限公司生产)、可调式移液器(上海仪器有限公司生产)、TG−WS台式离心机(长沙湘仪离心机有限公司生产)等。
1.2 试验方法
1.2.1 活性炭浓度对浸出的影响
向5个盛有200 mL已活化好的菌液的锥形瓶中分别加入不同质量的活性炭粉末,质量浓度分别为0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L。调节矿浆初始pH值为1.5,矿浆浓度为10%,在温度为45 ℃、转速为180 r/min的恒温振荡箱中进行浸出,定时监测矿浆pH值、氧化还原电位(φh)及Fe2+、Co2+离子浓度等参数,考察活性炭浓度对浸出的影响。
1.2.2 活性炭形状对浸出的影响
向两个盛有200 mL已活化好的菌液的锥形瓶中分别加入活性炭粉末与活性炭颗粒,质量浓度为上述实验所得的最佳浓度。调节矿浆初始pH值为1.5,矿浆浓度为10%,在温度为45 ℃、转速为180 r/min的恒温振荡箱中进行浸出,考察不同粒度的活性炭对浸出的影响。
1.2.3 pH值对活性炭吸附Co2+离子的影响
在3个250 mL锥形瓶中,分别移入100 mL浸出液,此浸出液中含有一定浓度的Co2+离子。活性炭浓度为2.0 g/L,用稀硫酸调节溶液pH值分别为1.2、1.5、1.8。在温度为45 ℃、转速为180 r/min的恒温振荡箱中进行吸附试验,研究不同pH值对活性炭吸附Co2+离子的影响。
2 结果与分析
2.1 活性炭对生物浸出的影响
图1所示为不同质量浓度的活性炭对生物浸出的影响实验结果。由图1可看出,浸出18 d,钴浸出率分别为72.92%、87.63%、94.98%、86.58%、84.32%;铜浸出率分别为50.19%、61.90%、65.62%、63.01%、60.81%。可见,添加活性炭能够强化硫铜钴矿生物浸出,并且活性炭的质量浓度不同其强化效果亦不同。其中,活性炭质量浓度为 1.0 g/L时的催化效果最好,钴浸出率提高 22.06%,铜浸出率提高 15.43%。在浸出过程中,当活性炭与硫铜钴矿接触时,两者组成原电池,如图2所示。活性炭具有较高的静电位,因此作为阴极,而硫铜钴矿则为阳极。通过原电池效应,阳极硫铜钴矿的氧化溶解加速,进而钴的浸出率提高[13−15]。
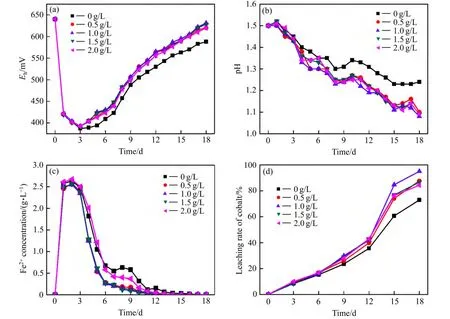
图1 不同浓度活性炭对细菌浸钴的影响Fig. 1 Effect of different activated carbon concentrations on bioleaching of cobalt
阳极氧化反应:

阴极还原反应:

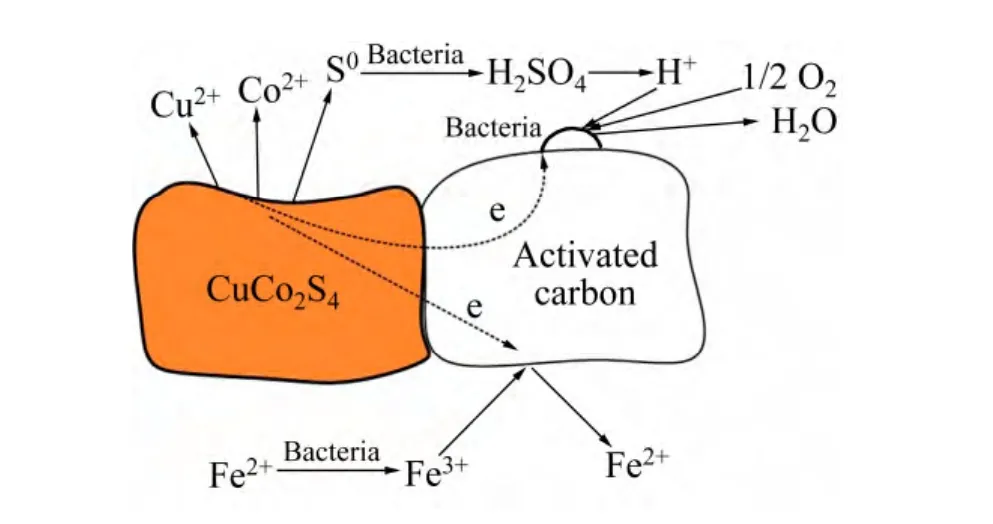
图2 原电池效应示意图Fig. 2 Schematic diagram of galvanic effect
随着活性炭浓度的增加,为原电池反应提供了更大的表面积,原电池效应增强,因此,钴浸出率随着活性炭浓度的增加而提高。但活性炭对细菌有很强的吸附作用,加入活性炭的细菌大量吸附在活性炭表面[14],抑制细菌在硫铜钴矿表面的吸附,不利于硫铜钴矿的氧化溶解。当添加低浓度活性炭时,抑制作用小,催化作用随活性炭浓度增加而增强。但随着活性炭浓度的增加,抑制作用逐渐增强,催化作用进而降低。因此,当活性炭浓度高于1 g/L后,钴浸出率随着活性炭浓度的增加而降低,如图1(d)所示。
由图1(a)和(c)可看出,浸出初期,含铁矿物如黄铁矿、黄铜矿在细菌与Fe3+离子的共同作用下被氧化分解[15],生成大量Fe2+离子。由于细菌被转移到新的环境后有一个适应的过程,生长繁殖处于诱导期,生成的Fe2+不能被细菌迅速氧化为Fe3+,因此Fe2+离子浓度迅速增大。同时,由于Fe3+不断消耗且Fe2+氧化生成Fe3+的速率慢,因此Fe3+浓度降低,浸出体系中[Fe3+]/[Fe2+]的比值降低,氧化还原电位下降。随着细菌通过氧化Fe2+离子获得能源,不断生长繁殖,活性增强,细菌氧化 Fe2+离子速率加快,Fe2+离子浓度达到最大值后开始降低,浸出体系中[Fe3+]/[Fe2+]比值增大,氧化还原电位升高。
由φh与Fe2+浓度的变化趋势可以看出,添加活性炭可以促进浸矿细菌对Fe2+的氧化,提高浸出体系的φh。而 NAKAZAWA 等[10]、LIANG 等[11]、ZHANG等[12]在活性炭催化黄铜矿的研究中则指出添加活性炭会抑制细菌氧化亚铁离子,降低[Fe3+]/[Fe2+]比值,进而浸出体系的氧化还原电位低于空白试样的。研究结果不同的原因为:由HIROYOSHI等[16]提出的黄铜矿两步溶解模型可知,在低电位条件下亚铁离子会还原黄铜矿,生成次生铜矿辉铜矿,辉铜矿易被溶解氧和 Fe3+氧化溶解,进而黄铜矿的溶解加速(见反应式(3)~(5))。由于Fe2+是浸矿细菌生长的主要能源物质,当Fe2+参与还原溶解黄铜矿时将导致浸矿细菌生长所需的能源物质减少,生长被抑制,氧化能力降低。而在硫铜钴矿浸出体系中,在低电位条件下即存在高浓度Fe2+时,硫铜钴矿的氧化溶解没有被加速,钴浸出率增长缓慢(见图 1(c)和(d))。可见 Fe2+没有参与还原硫铜钴矿,浸矿细菌生长所需的能源物质没有减少,细菌生长没有被抑制。同时,含铁硫化矿物氧化分解释放出的 Fe2+被细菌氧化为 Fe3+,Fe3+在活性炭阴极表面上得到电子还原为Fe2+[8,11]。该反应使消耗掉的营养物质得到补充,从而细菌的活性提高,细菌的氧化能力增强。因此,Fe2+氧化速率加快,浓度降低,浸出体系中[Fe3+]/[Fe2+]比值增大,矿浆氧化还原电位迅速上升并高于空白试样的(见图 1(a)和(c))。图 1(b)所示为浸出过程中矿浆的pH值变化趋势。由pH值变化趋势也可发现,添加活性炭增强了细菌的氧化能力,S元素的氧化得到促进,浸出体系的pH值降低。
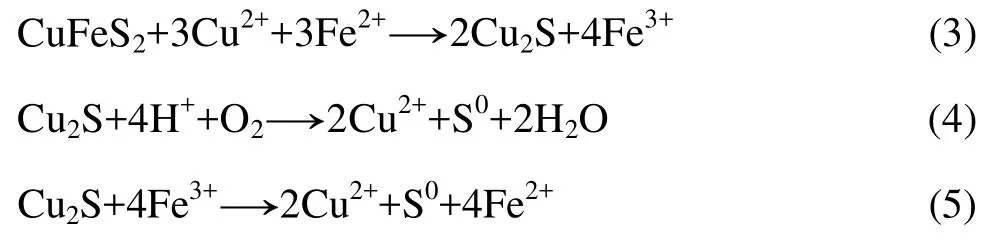
图3所示为活性炭形状对生物浸出的影响实验结果。由图3可看出,添加活性炭粉末体系的钴浸出率为 92.49%,添加活性炭颗粒体系的钴浸出率为93.27%,两个浸出体系的钴浸出率基本一致,说明活性炭形状对硫铜钴矿生物浸出没有影响。因此,在浸出过程中可以用活性炭颗粒代替活性炭粉末,有利于活性炭的回收利用,降低生产成本。
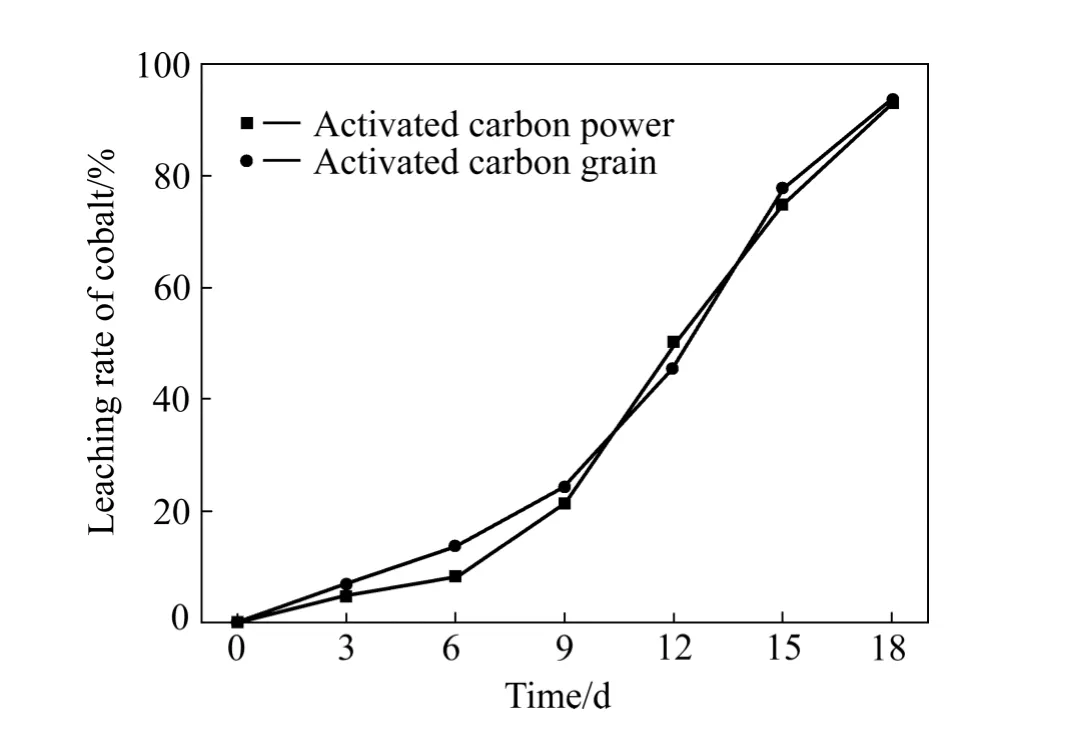
图3 活性炭粒度对细菌浸钴的影响Fig. 3 Effect of different activated carbon granularity on bioleaching of cobalt
2.2 pH值对活性炭吸附Co2+离子的影响
表2所列为不同pH值条件下活性炭对Co2+的吸附实验结果。由表2可看出,活性炭对钴离子的吸附量随着pH值的降低而减小,且吸附速率快,24 h即可达到吸附平衡。在活性炭浓度小于 2 g/L,浸出液pH≤1.8的条件下,活性炭对钴离子的吸附量小于3%,吸附量很低。
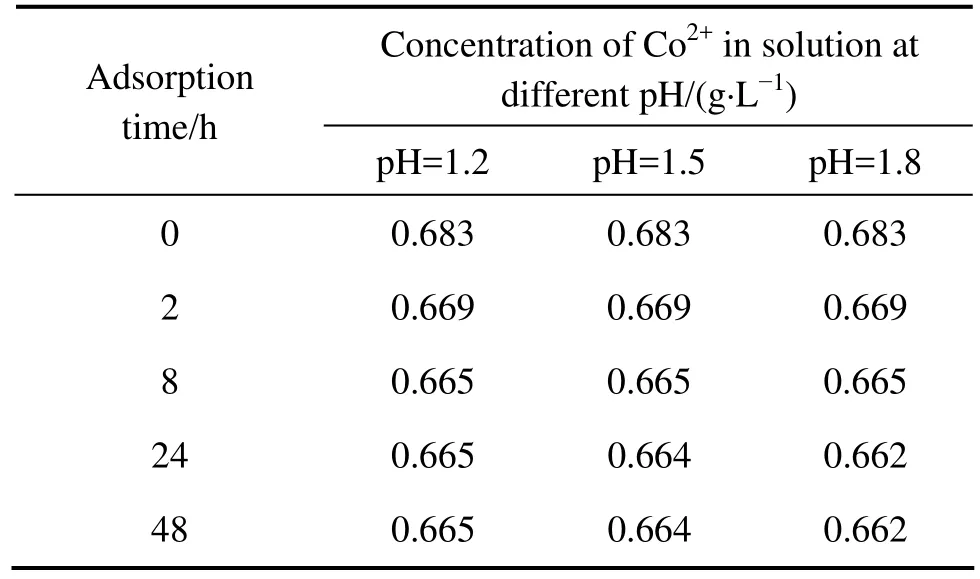
表2 pH值对活性炭吸附Co2+离子的影响Table 2 Effect of pH on adsorption of activated carbon on Co2+
活性炭表面各类含氧基团、官能团主要以—CHO、—OH、—COOH、—C=O 4种形式存在,它们通常是活性炭吸附金属离子的活性中心。在低pH值条件下,溶液中存在大量的H+离子,活性炭表面的活性基团会与H+离子结合。此时,大量的活性中心被H+离子占据,可吸附Co2+离子的活性基团减少,因此,吸附量很低[17−18]。而活性炭对铜离子的吸附由张卫民等[19]的研究可知其吸附量也低于 3%,吸附量很小。此外,在浸出过程中,由于矿物与活性炭充分混合,部分矿物微粒会将活性炭部分孔洞堵塞,使可吸附金属离子的活性面积减小,活性炭对重金属离子的吸附量进一步下降。因此,在浸出过程中,由于矿浆 pH值的降低以及部分矿物微粒会将活性炭部分孔洞堵塞而使可吸附金属离子的活性面积减小,活性炭对钴、铜离子的吸附量很小,不会造成金属钴、铜的大量损失。
3 结论
1) 活性炭的添加可以促进硫铜钴矿的氧化溶解,提高钴浸出率。其中添加1.0 g/L活性炭,在矿浆浓度为10%、浸出温度为45 ℃、转速为180 r/min的条件下,钴浸出率提高 22.06%,铜浸出率提高 15.43%。活性炭粉末与活性炭颗粒的催化效果一致,可用活性炭颗粒代替活性炭粉末,方便回收利用,节约生产成本。
2) pH值对活性炭对钴离子的吸附有控制作用,随着pH值降低,活性炭对钴离子的吸附量减小。在浸出过程中,由于矿浆 pH值的降低以及部分矿物微粒会将活性炭部分孔洞堵塞而使可吸附金属离子的活性面积减小,活性炭对钴、铜离子的吸附量很小,不会造成金属钴、铜的大量损失。
[1]D’HUGUES P, CEAZC P, CABRAL T, BATTAGLIA F,TRUONG-MEYER X M, MORIN D. Bioleaching of cobaltiferous pyrite: A continuous laboratory-scale study at high solids concentration[J]. Minerals Engineering, 1997, 10(5):507−527.
[2]BEHERA S K, PANDA P P, SINGH S, PRADHAN N, SUKLA L B, MISHRA B K. Study on reaction mechanism of bioleaching of nickel and cobalt from lateritic chromite overburdens[J].International Biodeterioration & Biodegradation, 2011, 65:1035−1042.
[3]YANG C R, QIN W Q, LAI S S, WANG J, ZHANG Y S, JIAO F,REN L Y, ZHUANG T, CHANG Z Y. Bioleaching of a low grade nickel-copper-cobalt sulfide ore[J]. Hydrometallurgy, 2011,106: 32−37.
[4]温建康, 阮仁满. 高砷硫低镍钴硫化矿浸矿菌的选育与生物浸出研究[J]. 稀有金属, 2007, 31(4): 537−542.WEN Jian-kang, RUAN Ren-man. Selection of bioleaching bacteria and bioleaching of high arsenic/sulfur, low-grade nickel/cobalt sulfide ore[J]. Chinese Journal of Rare Metals,2007, 31(4): 537−542.
[5]蒋金龙, 汪模辉. 一种含钴废渣的生物浸出初步研究[J]. 矿产综合利用, 2003, 1: 41−45.JIANG Jin-long, WANG Mo-hui. Preliminary research on bioleaching of a waste slag containing cobalt[J]. Multipurpose Utilization of Mineral Resources, 2003, 1: 41−45.
[6]WOODS R. Recent advances in electrochemistry of sulfide mineral flotation[J]. Transactions of Nonferrous Metals Society of China, 2000, 10(S1): 26−29.
[7]刘晓荣, 李宏煦, 胡岳华, 邱冠周, 徐 兢. 生物浸矿的电化学催化[J]. 湿法冶金, 2000, 19(3): 22−27.LIU Xiao-rong, LI Hong-xu, HU Yue-hua, QIU Guan-zhou, XU Jing. Electrochemical methods applied in catalyzing bioleaching process[J]. Hydrometallurgy of china, 2000, 19 (3): 22−27.
[8]李宏煦, 邱冠周, 胡岳华, 王淀佐. 原电池效应对混合硫化矿细菌浸出的影响[J]. 中国有色金属学报, 2003, 13(5):1283−1287.LI Hong-xu, QIU Guan-zhou, HU Yue-hua, WANG Dian-zuo.Galvanic effect on mixed sulfide bioleaching[J]. The Chinese Journal of Nonferrous Metals, 2003, 13(5): 1283−1287.
[9]LI C Y, WANG Y Z, WANG J, WANG Y L, JIANG X Q, HAN L M. Antibacterial pitch-based activated carbon fiber supporting silver[J]. Carbon, 1998, 36(1/2): 61−65.
[10]NAKAZAWA H, FUJISAWA H, SATO H. Effect of activated carbon on the bioleaching of chalcopyrite concentrate[J].International Journal of Mineral Processing, 1998, 55(2): 87−94.
[11]LIANG C L, XIA J L, ZHAO X J, YANG Y, GONG S Q, NIE Z Y, MA C Y, ZHENG L, ZHAO Y D, QIU G Z. Effect of activated carbon on chalcopyrite bioleaching with extreme thermophile Acidianusmanzaensis[J]. Hydrometallurgy, 2010,105: 179−185.
[12]ZHANG W M, GU S F. Catalytic effect of activated carbon on bioleaching of low-grade primary copper sulfide ores[J].Transactions of Nonferrous Metals Society of China, 2007, 17(5):1123−1127.
[13]YANG H Y, WANG S H, SONG X L, PAN H D, MA P C. Gold occurrence of Jiaojia gold mine in Shandong province[J].Transactions of Nonferrous Metals Society of China, 2011, 21(9):2072−2077.
[14]王磊磊, 陈 卫, 林 涛. 活性炭出水中炭附细菌解吸附机制及工况优化[J]. 中国矿业大学学报, 2011, 40(5): 829−834.WANG Lei-lei, CHEN Wei, LIN Tao. Desorption mechanism and operating optimization of bacteria attached to carbon fines(BACF)in GAC process effluents[J]. Journal of China University of Mining & Technology, 2011, 40(5): 829−834.
[15]马鹏程, 杨洪英, 韩战旗. 低品位原生金矿的生物柱浸[J]. 东北大学学报: 自然科学版, 2012, 33(6): 857−861.MA Peng-cheng, YANG Hong-ying, HAN Zhan-qi. Column bioleaching of low-grade primary gold ore[J]. Journal of Northeastern University: Natural Science, 2012, 33(6): 857−861.
[16]HIROYOSHI N, ARAI M, MIKI H, TSUNEKAWA M,HIRAJIMA T. A new reaction model for the catalytic effect of silver ions on chalcopyrite leaching in sulfuric acid solutions[J].Hydrometallurgy, 2002, 63(3): 257−267.
[17]张淑琴, 童仕唐. 活性炭对重金属离子铅镉铜的吸附研究[J].环境科学与管理, 2008, 33(4): 91−94.ZHANG Shu-qin, TONG Shi-tang. The adsorption studies of activated carbon for heavy metal ions of lead, cadmium and copper[J]. Environmental Science and Management, 2008, 33(4):91−94.
[18]徐 啸, 刘伯羽, 邓正栋. 活性炭吸附重金属离子的影响因素分析[J]. 能源环境保护, 2010, 24(2): 48−50.XU Xiao, LIU Bo-yu, DENG Zheng-dong. Analysis of decisive parameters in activated carbon’s adsorption of heavy metals[J].Energy Environmental Protection, 2010, 24(2): 48−50.
[19]张卫民, 谷士飞. 活性炭在原生硫化铜矿细菌浸出中对铜与铁离子吸附的影响[J]. 中国有色冶金, 2009(1): 64−67.ZHANG Wei-min, GU Shi-fei. Effect of activated carbon on the absorption of copper and iron ions in the bioleaching of primary copper sulfide ore[J]. China Nonferrous Metallurgy, 2009(1):64−67.
