晚期糖基化终产物改变心肌细胞自发钙火花形态学*
2014-08-13邓建新刘文娟林泽勋王永辉阎德文
邓建新, 刘文娟, 林泽勋, 王永辉, 阎德文
(深圳大学 1第一附属医院内分泌科, 2医学院病理生理学教研室,广东 深圳 518060; 3南方医科大学病理生理学教研室,广东 广州 510515)
在心肌细胞的兴奋收缩过程中,钙离子起着至关重要的桥梁作用。心肌细胞兴奋引起膜上的L-型钙通道(L-type calcium channel,LCC)开放,钙离子从胞外进入胞内。进入的钙离子又激活雷诺丁受体(ryanodine receptor,RyR)钙释放通道,肌浆网中的钙库瞬时打开,使得胞内钙浓度瞬间升高,最终引起细胞的收缩。钙火花是内质网/肌浆网(sarcoplasmic reticulum, SR)上单个钙释放单元中雷诺丁受体随机性的开放事件,其发现使得我们可以借助激光共聚焦显微镜实时观察到钙释放单元(Ca2+release unit,CRU)激活和内质网/肌浆网钙离子外流的情况,它是反映阵列RyR 的门控及其所形成的微钙区域信号。“钙火花”(Ca2+spark)及其相关钙信号事件是近百年来生理学研究领域的一个重大的发现,它们揭示了钙信号局部控制的新机制,以及细胞内精细的钙信号结构体系。
近年来,糖尿病的发病率在我国急剧上升,目前已有超过9 400万的糖尿病患者,此外尚有约 1.5亿中国人处于糖尿病前期,中国已成糖尿病患者大国[1]。晚期糖基化终产物(advanced glycation end products, AGEs)是机体在长期高糖状态时蛋白质和还原糖之间经过非酶性糖基化反应生成的物质,它被认为是糖尿病最主要的致病物质之一。很多的疾病如糖尿病、炎症、肾功能衰竭等都可以引起AGEs的聚集。已有的研究表明AGEs 主要通过与其受体RAGE作用从而促发氧化应激反应,导致 ROS 大量产生, 促进一系列炎症因子的表达,进而引起细胞的损伤。但是AGEs对心肌细胞钙信号调控机制尚不完全清楚。
材 料 和 方 法
1 材料
1~3 d SD乳鼠20只,购于南方医科大学实验动物中心。AGEs由南方医科大学黄巧冰教授惠赠;胶原酶II购于Worthington;5-溴脱氧尿嘧啶和胰蛋白酶购于Sigma;DMEM培养基和 新生牛血清为Gibco产品; Fluo-4 AM购于Invitrogen;其余无特别说明为国产分析纯。主要的仪器为Zeiss LSM-780倒置共聚焦显微镜(Zeiss)。
2 方法
2.1乳鼠心肌细胞的原代培养 用胰蛋白酶消化方法[2]把1~3 d 龄 SD大鼠心室肌消化成单细胞悬液。经差速法贴壁心肌细胞:37 ℃、5 % CO2培养箱中培养60~90 min,分离纯化心肌细胞。将纯化的细胞按1×105细胞数接种于35 mm培养皿中(培养皿事先加入了共聚焦专用玻片),培养24 h后饥饿2 h,然后加入不同浓度的AGEs进行刺激,8 h后进行钙火花检测实验[3]。
2.2荧光染料的加载 把钙荧光指示剂Fluo-4 AM(5 μmol/L)与细胞共同孵育10 min(室温、避光),之后清洗3次,以去除多余的荧光染料。将加载好荧光染料的细胞置于Zeiss LSM-780 倒置共聚焦显微镜系统的载物台上,以台氏液灌流细胞等待实验。
2.3钙火花的采集 由于钙火花的发放速度快、时程短,因此采用线扫描的方式进行捕捉。 在400倍镜下,固定激光强度为2%,随机选取横纹清晰、无自主跳动的细胞,采样速率为每线3.07 ms,采集1 000条线,在采集过程中放大倍数和采样速度应尽量保持一致以便于数据统计分析。激发光波长为488 nm,收集波长为505 nm以上的发射光。钙火花图像采用IDL 6.3软件进行处理。参照以往的方法[4],选取无钙信号释放区域进行静息钙水平的分析。
3 统计学处理
用SPSS 13.0软件分析。统计方法为单因素方差分析,方差齐时采用LSD法,方差不齐时组间比较采用Welch检验。数据以均数±标准误(mean±SEM)表示,以P<0.05为差异有统计学意义。
结 果
1 AGE增加钙火花的发放频率
结果表明,AGEs可以显著增加心肌细胞自发钙火花的发放频率。对照组的钙火花发放频率为1.56±0.13 (n=274), 10 mg/L AGEs 组为2.31±0.24 (n=258),50 mg/L AGEs 组自发钙火花的发放频率为4.68±0.30 (n=180),150 mg/L AGEs 组钙火花的发放频率为3.59±0.25 (n=158),见图1。

Figure 1. AGEs increased spontaneous calcium sparks frequency.Mean±SEM.**P<0.01 vs control.
2 AGEs 改变自发钙火花的形态
在观察AGEs 调控钙火花发放频率的同时,发现AGEs可以影响钙火花的形态学特性。选取各组的钙火花通过三维重组技术后可以看出,AGEs使得钙火花的大小减小,见图2。在分析的钙火花动力学时,我们着重分析钙火花的4个特征:钙火花峰值幅度(amplitude, F/F0)、空间半高宽(full width at half maximum, FWHM;空间变化曲线中高于峰值1/2的曲线部分所对应的距离计算)、持续时程(full du-ration at half maximum, FDHM;时间变化曲线中高于峰值1/2的曲线部分所持续的时间)和上升时间(rise time,RT;指钙火花起始处到峰值处所经历的时间)均有不同程度的变化,见表1。
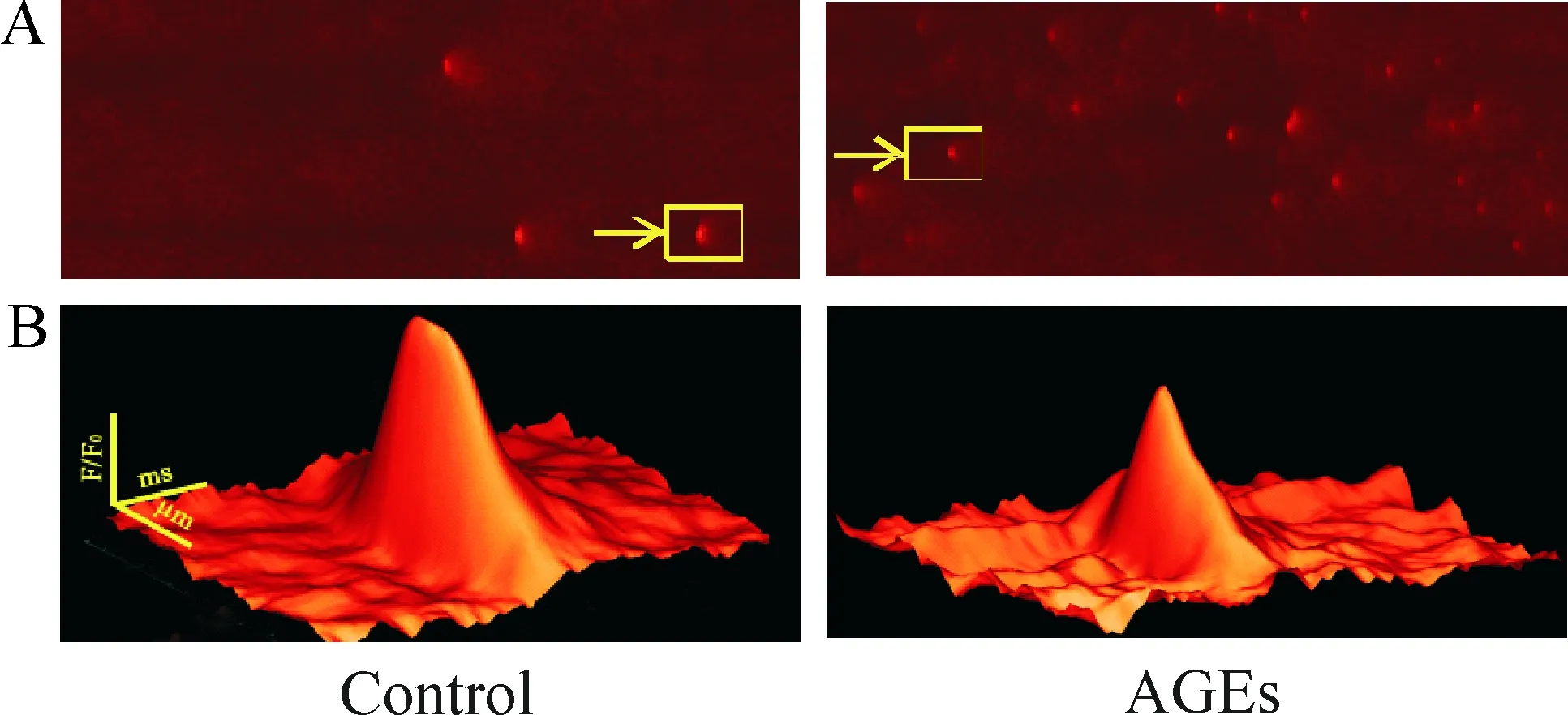
Figure 2. AGEs changed spontaneous calcium sparks morphology. A: typical calcium spark line scan image; B: single three-dimensional diagram of recombinant calcium sparks
3 AGEs增加心肌细胞静息期肌浆网内钙水平
结果显示,AGEs组略微增加静息期内钙离子水平,钙离子水平对照组为48.25±1.57,10 mg/L AGEs组(51.04± 2.01)与对照组相比差异不明显,50 mg/L AGEs组(53.45±2.28)和150 mg/L AGEs 组(60.27±4.28)均较对照组明显升高(P<0.05或P<0.01),见图3。

表1 AGEs改变钙火花形态学指标

Figure 3. Effects of AGEs on cardiomyocyte resting Ca2+.Mean±SD.*P<0.05,**P<0.01 vs control.
讨 论
在本实验中,我们发现AGEs可以增强肌浆网中RyR的活性,使得心肌细胞自发钙火花发放频率增加,并使钙火花的形态发生改变。钙火花形态反映了丰富的信息,包括CRU 的门控、释放的离子流、微观尺度的钙扩散及这些过程的生理调控。钙火花反映的是单个或少数几个RyR的同步开放。钙火花的发放频率及功能特性反映舒张期RyR的功能活动,同时还反映SR钙库和胞浆钙的平衡状态[5]。钙火花的发现,使人们得以在完整细胞更接近生理条件下研究RyR的功能。
正常静息心肌细胞,RyR通道主要处于关闭状态,只有零星的钙火花发放,有利于维持正常的SR钙库容量。但若病理刺激引起舒张期RyR通道开放异常增加,势必导致SR钙漏流增强,SR钙库容量减少,使心肌收缩力减弱。SR钙漏流还引起心肌细胞钙超载,从而造成心肌细胞的损伤。近些年来,一系列研究工作发现心力衰竭的心肌细胞SR钙漏流增加,是引起心衰的一个重要机制[4,6-9]。
借助钙火花成像技术,Yaras等[10]研究发现,链脲佐菌素诱导糖尿病大鼠5周时离体心肌细胞钙火花频率显著增加。与此同时,还发现静息期胞浆钙浓度升高(钙超载),收缩期钙瞬变幅度降低,心肌收缩力减弱。AGEs对离体心肌细胞的作用与之相似,因此,我们有理由相信,AGEs引起的钙火花增加介导的钙漏流的产生,进而引起肌浆网钙库的下降,另外AGEs引起的钙超载也对心肌细胞造成损伤,最终引起收缩期心肌收缩力的下降。这可能是糖尿病性心肌病心功能不全的重要机制。
[参 考 文 献]
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12):1090-1101.
[2] Liu W, Deng J, Xu J, et al. High-mobility group box 1 (HMGB1) downregulates cardiac transient outward potassium current (Ito) through downregulation of Kv4.2 and Kv4.3 channel transcripts and proteins[J]. J Mol Cell Cardiol, 2010, 49(3):438-448.
[3] Guo X, Wang L, Chen B, et al. ERM protein moesin is phosphorylated by advanced glycation end products and modulates endothelial permeability[J]. Am J Physiol Heart Circ Physiol, 2009, 297(1):H238-H246.
[4] Jiang X, Liu W, Deng J, et al. Polydatin protects cardiac function against burn injury by inhibiting sarcoplasmic reticulum Ca2+leak by reducing oxidative modification of ryanodine receptors[J]. Free Radical Biol Med, 2013, 60(8):292-299.
[5] Cheng H, Lederer WJ. Calcium sparks[J]. Physiol Rev, 2008, 88(4):1491-1545.
[6] Terentyev D, Gyorke I, Belevych AE, et al. Redox modification of ryanodine receptors contributes to sarcoplasmic reticulum Ca2+leak in chronic heart failure[J]. Circ Res, 2008, 103(12):1466-1472.
[7] van Oort RJ, McCauley MD, Dixit SS, et al. Ryanodine receptor phosphorylation by calcium/calmodulin-dependent protein kinase Ⅱ promotes life-threatening ventricular arrhythmias in mice with heart failure[J]. Circulation, 2010, 122(25):2669-2679.
[8] Belevych AE, Terentyev D, Viatchenko-Karpinski S, et al. Redox modification of ryanodine receptors underlies calcium alternans in a canine model of sudden cardiac death[J]. Cardiovasc Res, 2009, 84(3):387-395.
[9] Zou Y, Liang Y, Gong H, et al. Ryanodine receptor type 2 is required for the development of pressure overload-induced cardiac hypertrophy[J]. Hypertension, 2011, 58(6):1099-1110.
[10] Yaras N, Ugur M, Ozdemir S, et al. Effects of diabetes on ryanodine receptor Ca release channel (RyR2) and Ca2+homeostasis in rat heart[J]. Diabetes, 2005, 54(11):3082-3088.
