南方二氯喹啉酸残留药害早期诊断和预警亟待研究
2014-08-13陈国奇田兴山
陈国奇, 田兴山, 冯 莉
(广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广东广州 510640)
随着我国生产力水平和劳动力成本不断上升,轻简化、规模化和集约化农业耕作模式逐步兴起,作物生产中越来越依赖省时、省工、高效、快捷的耕作管理模式[1],因而田间杂草防控越来越依赖化学除草剂[2-4]。据国家统计局统计,2012年我国国内化学除草剂消费量高达113.8万t,是2005年消费量(28.3万t)的4倍多。然而,除草剂使用不当会引起农作物药害[5],造成巨大损失,尤其是我国农田多为小块化经营,机械化程度和整体用药水平较低,因而除草剂药害事件时有发生[6-7]。
除草剂对作物产生药害主要有2种类型[8],一类是对当茬作物产生的药害,即直接药害;另一类是对后茬作物产生的药害,即间接药害,也称为残留药害。目前对除草剂药害的研究报道多为直接药害,除草剂生产、供应商和农户通常对直接药害的防范意识更高。在多数情况下,直接药害通过查询相关田块的近期用药记录和症状即可诊断[9]。而残留药害具有很大的危害性和隐蔽性,通常观察到药害症状时,作物已经出苗甚至到了种植后期,造成巨大损失,尤其是农户不知道药害根源,当作病害防治,投入大量人力和财力,错过了补救的关键时期。因此,除草剂残留药害早期诊断技术体系的研究具有突出的生产指导意义。目前关于除草剂残留药害诊断的研究主要基于幼苗生长和形态学观察,诊断往往只是针对已经发生残留药害的情况分析,而隐性残留药害检测、残留药害的量化诊断和对作物生产风险的量化评估等基本问题亟需通过科学研究解决。
1 南方除草剂残留药害威胁严重
在我国南方高温高湿的气候条件下,土壤中残留的除草剂分解相对较快,因而多年来南方除草剂药害问题研究相对较少。而事实上,南方除草剂药害形势严峻,尤其是一些土壤残留时间长(长残留)的除草剂在南方更容易造成药害。究其原因,一是,杂草在田间周年生长,一年多熟制的种植模式下田间控草频繁,除草剂施用的频度和累积剂量上升;二是,南方不同类型作物轮作频繁更易引发残留药害;三是,随着田间大量、频繁地施用除草剂,抗药性和耐药性杂草问题日趋严重,而农户往往会直接增加施药量或施药次数,尤其是增施一些价格较低的除草剂。随机采访发现,农户在田间单次施药剂量有时高达推荐剂量的3倍,甚至更高。根据市场调查数据(未公开发表资料)结合《中国统计年鉴2010》发布的数据[10],2009年广东省平均每公顷耕地中的除草剂施用费用和平均每公顷水稻田施用除草剂二氯喹啉酸的费用分别是全国平均水平的2.6倍和1.7倍。因此,近年来南方的除草剂残留药害问题开始被发现[11-12]。
2 二氯喹啉酸土壤残留能引发明显的或隐性的药害
二氯喹啉酸(3,7-二氯-8-喹啉羧酸)是1988年在德国上市、1990年开始在我国稻田使用的稗属杂草(Echinochloaspp.)特效除草剂[13],可有效防除超过50种常见恶性杂草[14-16],因而二氯喹啉酸是华南地区水稻田使用的主要除草剂之一。然而,该药是典型的长残留除草剂[13],极易对多种重要作物产生明显药害[11,17-19],包括烟草(Nicotianaspp.)、马铃薯(Solanumtuberosum)、豌豆(Pisumsativum)、甘薯(Dioscoreaesculenta)、番茄(Lycopersiconesculentum)、西瓜(Citrulluslanatus)、辣椒(Capsicumannuum)、茄子(Solanummelongena)、胡萝卜(Daucuscarotavar.sativa)、大豆(Glycinemax)、水稻(Oryzasativa)等,并能对多种水生动植物造成毒害[20-23]。陈泽鹏等取无二氯喹啉酸用药史的土壤(pH值5.48)添加0.8 mg/kg该药后,发现其半衰期为22 d,并且在180 d后,仍然检测到0.069~0.085 mg/kg的残留量,进而推论稻田中一次施用二氯喹啉酸后,烟草的安全间隔期为342 d[24]。
在二氯喹啉酸残留药害严重的情况下,植株幼苗生长呈现明显异常,如在烟草上表现为新叶畸形,叶片变窄变厚,叶片边缘向叶背面内卷、皱缩,严重时出现线状叶形,基部老叶叶形基本正常;在马铃薯上表现为植株明显矮化和黄化,叶皱缩、卷曲、僵硬、发脆,叶柄和茎秆细小,根系不发达,长度只有正常植株的1/3左右。通常在田间观察到药害症状时,作物已经出苗并生长了一段时间,因而造成巨大损失,尤其是农户在不知道药害根源的情况下,当作病害加以防治,投入大量人力和财力,错过补救的关键时期,导致大面积严重减产,或者即使有少量收成,商品率也极低,损失惨重。
此外,二氯喹啉酸残留药害不明显时也会造成极大的作物生产损失,即隐性药害。在二氯喹啉酸药害程度相对较轻时,作物的药害形态会缓慢地恢复,甚至有些情况对某些作物不造成可视的药害症状,但是可能影响作物生长发育或农产品品质,进而导致生产损失。这种隐性药害不容易被发现,但危害同样巨大。例如,有研究表明,土壤中残留的二氯喹啉酸能够被番茄吸收并转移到果实中积累,进而影响其品质和商品率[25],并且在烟草的研究中得到同样的结论[26];此外,二氯喹啉酸浓度较低也可能干扰作物生长和生理,进而产生不明显药害[27],或推迟作物的成熟期而造成生产损失[17]。更多关于二氯喹啉酸药害症状和生态毒理学研究进展见宋稳成等的综述论文[28]。
3 二氯喹啉酸残留药害早期诊断困难
二氯喹啉酸引起作物药害的形态症状与其他激素类除草剂引起的药害形态症状相似,甚至与某些病毒病害症状相似,这容易导致误诊,而其隐性药害则不容易引起注意,农户往往将作物减产归咎于其他因素,如种子质量、土壤问题等。虽然可以通过测定土壤中的残留含量来推测药害来源,然而土壤温度、颗粒组成、有机质含量、pH值等都可能对作物药害程度和表征产生明显影响[12,28];并且不同作物对二氯喹啉酸残留的敏感性不尽相同,更何况土壤农药残留量测定成本以及对仪器、试剂、操作等要求相对较高,因而土壤含量测定方法难以在生产中推广。因此,二氯喹啉酸残留药害诊断难度很大,亟需探索新的高效而实用的早期诊断技术体系来回答诸如“如何量化诊断二氯喹啉酸土壤残留药害?”“如何将量化诊断结果与作物生产损失相对应,并用于相应的作物药害风险评估?”等问题。因此,可根据植物对二氯喹啉酸敏感性机制和相关关键检测指标的研究结果,探索建立相关的残留药害早期诊断体系。
4 植物对二氯喹啉酸敏感性的机制和相关检测指标
二氯喹啉酸作为喹啉酸家族的一种激素类除草剂[29],能够诱导乙烯前体氨基环丙烷羧酸(ACC)的从头合成[14]。许多研究表明,一些禾草类敏感型植株采用二氯喹啉酸处理后ACC含量大幅上升,继而引起植株体内快速合成超量乙烯,并伴有副产品HCN过量积累,引起处理植株受毒害[30-31];而激素诱导的乙烯合成也会促进脱落酸(ABA)的生物合成,进而引起植株体内活性氧积累、细胞凋亡和叶片衰老等[15,30,32-34]。相关分子水平的研究目前较少,且尚没有取得广泛认可的研究成果。据Grossmann报道,TIR1/AFB(生长素受体转运抑制响应蛋白/生长素结合蛋白)是多种激素类除草剂的作用受体;对TIR1晶体结构模型的研究结果表明,上述受体很可能也是二氯喹啉酸的作用靶标,即二氯喹啉酸处理后可能引起ACC合成酶以及脱落酸生物合成通路上的关键物质NCED(9-顺式-环氧类胡萝卜素加双氧酶蛋白)基因的表达[15]。更多关于二氯喹啉酸研究进展见Yasuor等的研究论文[14]和李岗等的综述论文[35-36]。
大量研究结果表明,二氯喹啉酸抗性机制主要在于:(1)植物体内对于该药诱导乙烯合成信号通路并不敏感;(2)植物体内解毒和抗氧化能力增强[14,35]。有研究表明,对二氯喹啉酸不敏感性的禾草类抗性植株在该药处理后体内的乙烯和HCN含量并无明显提高[30,37]。而对猪殃殃的研究发现,二氯喹啉酸处理后,敏感型植株体内的乙烯含量是抗性植株体内的3倍,脱落酸水平则是14倍[33]。植株体内抗氧化能力和解毒能力与其对该药的敏感性密切相关[35,38]。例如,有研究表明,抗药性植株体内的抗氧化酶,如SOD(超氧化物歧化酶)、CAT(过氧化氢酶)、APX(抗坏血酸过氧化物酶)、GR(谷胱甘肽还原酶)等,活性较高[18]。另外,细胞色素P450单加氧酶(是一种除草剂在作物体内的代谢解毒酶)活性与植株对二氯喹啉酸的敏感性紧密相关。有研究表明,添加细胞色素P450抑制剂马拉硫磷(malathion)能使抗二氯喹啉酸的水稗(Echinochloaphyllopogon)失去抗性,进一步研究发现,抗性水稗植株体内的氰化物解毒酶β-CAS(β-氰丙氨酸合成酶)的活性是敏感型植株的2~3倍,而在马拉硫磷处理后抗性和敏感型水稗植株体内的β-CAS酶活性均下降40%[14];在对止血马唐(Digitariaischaemum)的研究中得出了类似结论[37]。
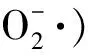
5 总结
二氯喹啉酸由于药效好、价格低廉、选择性强,近年来在南方的使用量越来越大,尤其是田间抗药性种群出现后,农户容易随意增加施用量和频度,加上土地承包、加速流转等社会现象,导致农田用药背景不明,二氯喹啉酸土壤残留药害威胁不断加剧。二氯喹啉酸土壤残留药害具有很高的隐蔽性和潜伏性,而目前相应的诊断知识模糊,还没有数值化的诊断评估方法。
当前针对除草剂残留药害早期诊断技术的研究较少,有研究报道了叶片叶绿素色素含量快速测定可以用于诊断10%硝磺草酮悬浮液玉米的药害情况[40];也有研究报道可以借助花生生长指标判断土壤二氯喹啉酸残留药害情况[41];或者通过番茄根长来评估水体中二氯喹啉酸引起药害风险[42]。
6 研究设想
我们需要找到更为敏感、实用的指示植物,进而基于研究指示植物在二氯喹啉酸胁迫下的形态学、解剖学、生理学等一系列观察指标的变化,建立系统而完善的二氯喹啉酸残留药害早期诊断和风险评估技术体系,来量化研究有关问题,对二氯喹啉酸残留药害进行分级,并将不同的药害等级与对应作物生产损失进行量化评估和预警,确保即使对隐性残留药害也能够进行诊断和预警。此外,二氯喹啉酸药害补救与土壤修复技术亟待研究开发。
参考文献:
[1]李淑顺,张连举,强 胜. 江苏中部轻型栽培稻田杂草群落特征及草害综合评价[J]. 中国水稻科学,2009,23(2):207-214.
[2]涂鹤龄. 我国农田杂草研究和防治进展[J]. 农药,2001,40(3):1-3.
[3]Zhang Z P. Development of chemical weed control and integrated weed management in China[J]. Weed Biology and Management,2003,3(4):197-203.
[4]强 胜. 杂草学[M]. 北京:中国农业出版社,2003.
[5]Pannacci E,Covarelli G. Efficacy of mesotrione used at reduced doses for post-emergence weed control in maize(ZeamaysL.)[J]. Crop Protection,2009,28(1):57-61.
[6]张朝贤,钱益新,胡祥恩,等. 合理用药预防长残效除草剂残留药害[J]. 杂草科学,1998(2):2-4.
[7]王明勇,韩道一,耿继光,等. 安徽省农作物药害现状及对策[J]. 安徽农学通报,2005,11(5):44-45.
[8]王险峰,关成宏,辛明远. 我国长残效除草剂使用概况、问题及对策[J]. 农药,2003,42(11):5-10.
[9]吴文革,李泽福,张四海,等. 安徽江淮地区2006年中籼水稻结实不良情况调查[J]. 安徽农学通报,2006,12(13):85-88.
[10]中华人民共和国国家统计局. 中国统计年鉴2009[M]. 北京:中国统计出版社,2010.
[11]韩锦峰,张志勇,刘华山,等. 稻田残留二氯喹啉酸对后茬烤烟的危害及其修复研究进展[J]. 中国烟草学报,2013(1):81-83.
[12]尹 冬,曾勇军,章建其,等. 稻烟轮作区二氯喹啉酸残留对烤烟药害研究进展[J]. 江西农业学报,2012,24(8):38-40.
[13]A herbicide used for post-emergence weed control on grass and turf[EB/OL]. (2013-09-09)[2013-12-09]. http://sitem.herts.ac.uk/aeru/iupac/577.htm.
[14]Yasuor H,Milan M,Eckert J W,et al. Quinclorac resistance:a concerted hormonal and enzymatic effort inEchinochloaphyllopogon[J]. Pest Management Science,2012,68(1):108-115.
[15]Grossmann K. Auxin herbicides:current status of mechanism and mode of action[J]. Pest management science,2010,66(2):113-120.
[16]Grossmann K. Quinclorac belongs to a new class of highly selective auxin herbicides[J]. Weed Science,1998,46(6):707-716.
[17]Bond J A,Walker T W. Effect of postflood quinclorac applications on commercial rice cultivars[J]. Weed Technology,2012,26(2):183-188.
[18]Sunohara Y,Matsumoto H. Quinclorac-induced cell death is accompanied by generation of reactive oxygen species in maize root tissue[J]. Phytochemistry,2008,69(12):2312-2319.
[19]Lovelace M L,Talbert R E,Scherder E F,et al. Effects of multiple applications of simulated quinclorac drift rates on tomato[J]. Weed Science,2007,55(2):169-177.
[20]de Menezes C C,Leitemperger J,Santi A,et al. The effects of diphenyl diselenide on oxidative stress biomarkers inCyprinuscarpioexposed to herbicide quinclorac (Facet®)[J]. Ecotoxicology and Environmental Safety,2012,81:91-97.
[21]Pretto A,Loro V L,Menezes C,et al. Commercial formulation containing quinclorac and metsulfuron-methyl herbicides inhibit acetylcholinesterase and induce biochemical alterations in tissues ofLeporinusobtusidens[J]. Ecotoxicology and Environmental Safety,2011,74(3):336-341.
[22]陶 玲,尹黎燕,李 伟. 除草剂二氯喹啉酸对粗梗水蕨有性繁殖的影响[J]. 武汉植物学研究,2007,25(6):601-604.
[23]Resgalla C Jr,Noldin J A,Tamanaha M S,et al. Risk analysis of herbicide quinclorac residues in irrigated rice areas,Santa Catarina,Brazil[J]. Ecotoxicology,2007,16(8):565-571.
[24]陈泽鹏,王 静,万树青,等. 烟区土壤残留二氯喹啉酸的消解动态[J]. 农药,2007,46(7):479-480,483.
[25]Lovelace M L,Hoagland R E,Talbert R E,et al. Influence of simulated quinclorac drift on the accumulation and movement of herbicide in tomato(Lycopersiconesculentum) plants[J]. Journal of Agricultural and Food Chemistry,2009,57(14):6349-6355.
[26]王 静. 土壤残留二氯喹啉酸引起烟草畸形生长的研究[M]. 广州:华南农业大学硕士学位论文,2004.
[27]袁树忠,吴进才,徐建祥,等. 丁草胺等除草剂对水稻生理生化的影响[J]. 植物保护学报,2001,28(3):274-278.
[28]宋稳成,余苹中. 二氯喹啉酸的生态毒理学研究进展[J]. 农药科学与管理,2006,27(9):13-17.
[29]Han X L,Mei P,Liu Y,et al. Binding interaction of quinclorac with bovine serum albumin:a biophysical study[J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy,2009,74(3):781-787.
[30]Grossmann K,Kwiatkowski J. The mechanism of quinclorac selectivity in grasses[J]. Pesticide Biochemistry and Physiology,2000,66(2):83-91.
[31]Grossmann K,Scheltrup F. Selective induction of 1-aminocyclopropane-1-carboxylic acid(ACC) synthase activity is involved in the selectivity of the auxin herbicide quinclorac between barnyard grass and rice[J]. Pesticide Biochemistry and Physiology,1997,58(2):145-153.
[32]Sunohara Y,Shirai S,Yamazaki H,et al. Involvement of antioxidant capacity in quinclorac tolerance inEleusineindica[J]. Environmental and Experimental Botany,2011,74:74-81.
[33]van Eerd L L,McLean M D,Stephenson G R,et al. Resistance to quinclorac and ALS-inhibitor herbicides inGaliumspuriumis conferred by two distinct genes[J]. Weed Research,2004,44(5):355-365.
[34]Alonso-Simón A,García-Angulo P,Encina A,et al. Habituation of bean(Phaseolusvulgaris) cell cultures to quinclorac and analysis of the subsequent cell wall modifications[J]. Annals of Botany,2008,101(9):1329-1339.
[35]李 岗,吴声敢,吴长兴,等. 稗草对二氯喹啉酸抗性研究进展[J]. 杂草科学,2012,30(2):1-5.
[36]罗 沙,余柳青,刘都才,等. 稻田稗草对二氯喹啉酸的抗药性研究进展[J]. 植物保护,2011,37(1):7-10.
[37]Abdallah I,Fischer A J,Elmore C L,et al. Mechanism of resistance to quinclorac in smooth crabgrass(Digitariaischaemum)[J]. Pesticide Biochemistry and Physiology,2006,84(1):38-48.
[38]苑学霞,郭栋梁,赵善仓,等. 二氯喹啉酸在水稻、土壤和田水中消解动态及残留[J]. 生态环境学报,2011,20(6):1138-1142.
[39]李晶新,韩锦峰,刘华山,等. 二氯喹啉酸对烤烟种子萌发及幼苗生长的影响[J]. 河南农业科学,2010(2):37-39,48.
[40]郭建文. 玉米叶片SPAD值在除草剂药害早期诊断中的应用[J]. 山西农业科学,2013,41(1):86-88,91.
[41]徐子晶,逯 州,向殿福. 二氯喹啉酸药害的生物测定[J]. 安徽农业科学,2010,38(23):12762-12763,12772.
[42]de Barreda D G,Lorenzo E,Carbonell E A,et al. Use of tomato (Lycopersiconesculentum) seedlings to detect bensulfuron and quinclorac residues in water[J]. Weed Technology,1993,7(2):376-381.
