草甘膦对耐草甘膦大豆体内莽草酸含量及产量的影响
2014-08-13杨鑫浩李香菊
杨鑫浩,李香菊
(中国农业科学院植物保护研究所,北京 100193)
转基因耐草甘膦大豆是种植规模最大的的转基因耐除草剂作物,2012年种植面积占全球转基因作物种植面积的52%[1]。大部分商业化种植的耐草甘膦大豆转入的是cp4-epsp基因,该基因的转入,使大豆对草甘膦具有耐受性,所以田间可以喷施灭生性药剂草甘膦除草[2]。草甘膦是一种非选择性、传导型茎叶处理除草剂,其作用机理是竞争性抑制莽草酸合成途径中5-烯醇丙酮莽草酸-3-磷酸合成酶(EPSPS)与底物莽草酸-3-磷酸(S3P)的结合,导致植物体内的莽草酸过量积累,阻断植物芳香族氨基酸的生物合成,最终杀死植物[3]。国内外研究表明,喷施草甘膦后,植物体内莽草酸含量升高,因此,莽草酸积累是植物经草甘膦处理后最早出现的且相对敏感的生理指标[4-5];陈景超等报道,施用草甘膦后杂草植株体内莽草酸积累量可以反映不同杂草对草甘膦的敏感性,莽草酸积累量越多,植株对草甘膦耐受性越差[6]。国外对耐草甘膦大豆的研究发现,用1/4~1/2草甘膦推荐剂量进行处理,耐草甘膦大豆体内莽草酸无明显积累[7-8]。但是,对使用高剂量草甘膦处理后耐草甘膦大豆体内莽草酸含量的变化情况国内外少有研究。生产中,草甘膦喷施剂量往往会超过推荐剂量,农民甚至使用 2~3 倍推荐剂量局部定向喷雾。因此,研究高剂量草甘膦处理后耐草甘膦大豆体内莽草酸含量的变化及草甘膦对大豆产量的影响更具有实际意义。06-698 是我国选育的耐草甘膦大豆,有较高增产潜力[9];MON87701RR2Y为美国孟山都公司选育的耐草甘膦品种,具有高产、优质、抗除草剂、抗虫特性,这2种耐草甘膦大豆均通过转入cp4-epsp基因而对草甘膦产生耐受性。本试验通过研究耐草甘膦大豆喷施不同剂量草甘膦后叶片莽草酸含量的变化,其一,明确莽草酸积累量与大豆对草甘膦耐受性的关系;其二,通过草甘膦使用量与不同大豆材料莽草酸积累量的关系研究,试图建立一种大豆对草甘膦耐受性评价的早期、快速、不破坏植株的方法,为我国耐草甘膦大豆的商业化种植提供数据支撑
1 材料与方法
1.1 供试材料
大豆材料:耐草甘膦大豆06-698和MON87701RR2Y均转入cp4-epsp基因,对照分别为常规大豆材料绥农14和A5547。上述材料中 06-698 由内蒙古呼伦贝尔市农业科学研究所提供,绥农14由黑龙江省农业科学院绥化农科所提供,MON87701RR2Y和A5547由美国孟山都公司提供。
仪器及喷雾器械:FA1104 电子分析天平(上海天平仪器厂);5417R型低温台式离心机(德国艾本德公司);紫外-可见分光光度计 UV2102 C型[优尼科(上海)仪器有限公司];ASS-4型行走式喷雾塔(国家农业信息化工程技术研究中心);CO2背负式喷雾器(国家农业信息化工程技术研究中心)。
试剂及药品:莽草酸(Sigma 公司标样);0.1 mol/L 甘氨酸;0.25 mol/L HCl(北京化工厂分析纯);1%HIO4(天津市光复精细化工研究所分析纯);41%草甘膦异丙胺盐水剂(孟山都公司)。
1.2 试验方法
1.2.1 网室试验及田间试验
1.2.1.1 网室试验 取未使用除草剂的农田表层土壤过2 mm筛,按3 ∶1混入凯茵营养土(有机质含量≥15%,N、P、K总含量≥0.88%,pH值7.0~7.5),定量装入直径为15 cm的塑料花盆中,加水使土壤含水量为30%。每盆播种10粒大豆种子,播深3.0 cm,播种后将花盆置温室(20±5)℃下培养。分别于大豆3、5、7张羽状三出复叶期(3、5、7叶期)置ASS-4型行走式喷雾塔内,喷施41%草甘膦异丙胺盐水剂,剂量分别为615.0、1 230.0、2 460.0、3 690.0、4 920.0 g a.i./hm2,即1/2、1倍、2倍、3倍、4倍推荐剂量,记为X/2、X、2X、3X、4X,另设清水对照(CK),其中1 230.0 g a.i./hm2为推荐剂量,每处理重复3次。
1.2.1.2 田间试验 于2012年5—11月在中国农业科学院植物保护研究所廊坊中试基地暨农业部转基因植物环境安全监督试验测试中心(北京)试验隔离区进行。试验地为中壤,pH值为8.0,试验过程中的管理条件及安全措施按NY/T719.3—2003《转基因大豆环境安全检测技术规范 第3部分:对生物多样性影响的检测》进行。试验采取随机区组设计,每处理3次重复,每小区面积20 m2。大豆条播,行距40 cm,株距8 cm,出苗后按常规方式进行田间管理,全小区均为人工除草。
分别于大豆3、5、7叶期用CO2背负式喷雾器喷施41%草甘膦异丙胺盐水剂,剂量分别为0、615.0、1 230.0、2 460.0、3 690.0、4 920.0 g a.i./hm2。
1.2.2 取样方法及莽草酸测定 大豆喷施草甘膦后1、3、5、7、9、11 d从每株大豆上剪取一小部分三出复叶,用液氮研磨叶片,称取磨碎的样品0.2 g于2.0 mL的离心管中,加入1.0 mL 0.25 mol/L HCl,4 ℃ 12 000 r/min离心20 min,收集上清液,4 ℃冰箱保存待测。
参考Gaitonde等的方法[10-11],取200 μL上清液,加入2.0 mL 1% HIO4溶液,室温静置3 h,加入2.0 mL 1.0 mol/L NaOH并混匀;然后加入1.2 mL 0.1 mol/L甘氨酸,混匀,静置5 min,于紫外分光光度计380 nm比色,记录D。每处理重复3次,并重复试验3次。
1.2.3 大豆生长状况观察及产量测定 田间试验在大豆施药后1~14 d目测大豆长势长相,收获时每小区取2行大豆植株,晾干至籽粒含水量14%以下,测籽粒产量。
1.2.4 数据处理方法 试验数据采用Excel、SPSS软件进行分析处理,采用Duncan新复极差法进行差异显著性分析。
2 结果与分析
2.1 草甘膦不同剂量对大豆叶片中莽草酸积累量的影响
网室试验结果表明,于大豆3叶期时喷施 1 230.0 g a.i./hm2草甘膦后,绥农14和A5547常规大豆叶片内即出现莽草酸积累,且其积累量随用药后时间的推移逐渐增加,分别在药后3、5 d时达到峰值,即为2 561.54、2 565.38 μg/g,是处理前的7.17、7.47倍(图1-A)。随着草甘膦用量的增加,上述大豆材料叶片内莽草酸积累量增加,即当施药剂量为 2 460.0 g a.i./hm2时,药后3、5 d,大豆叶片莽草酸积累量分别为4 830.77、3 415.38 μg/g(图1-B)。
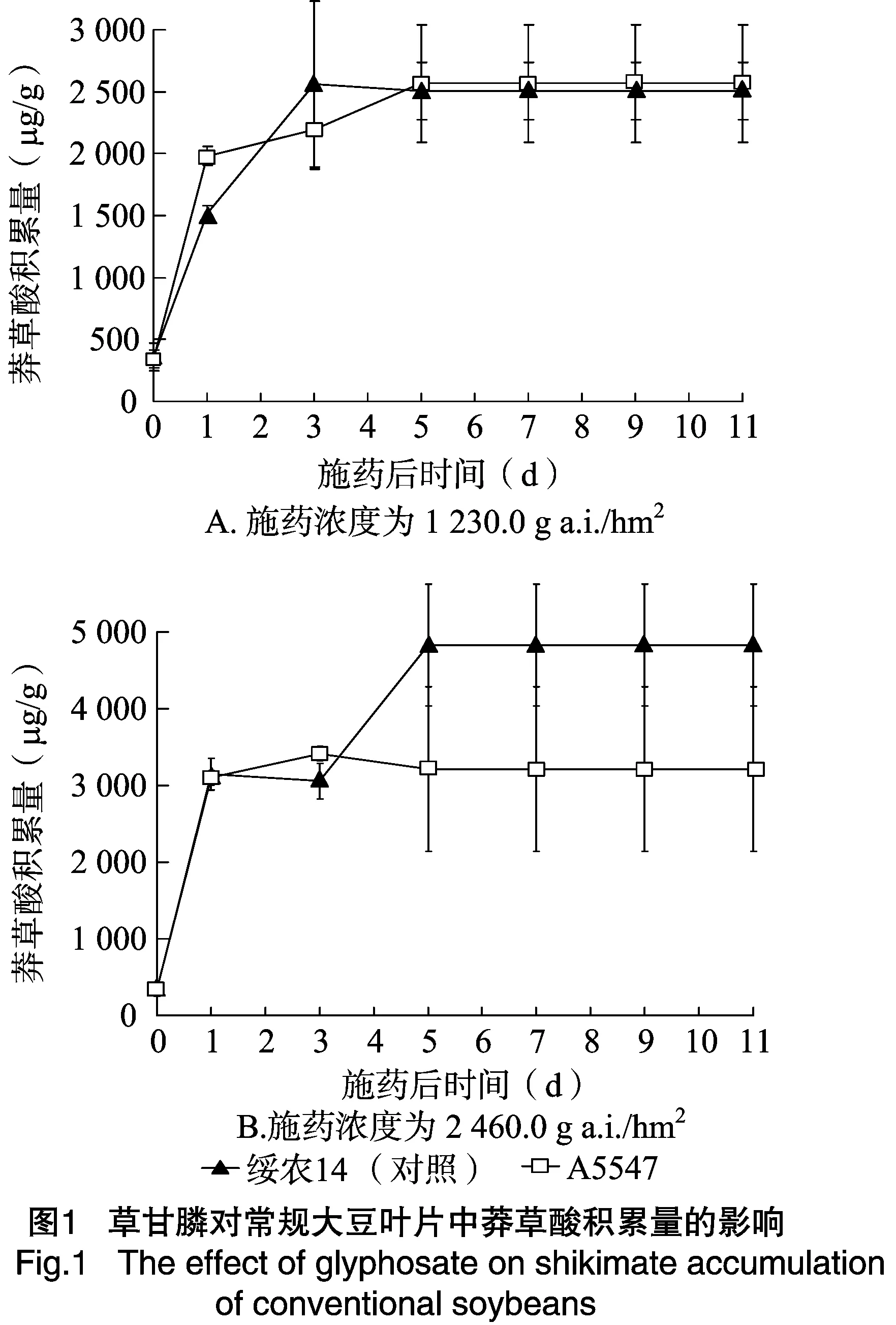
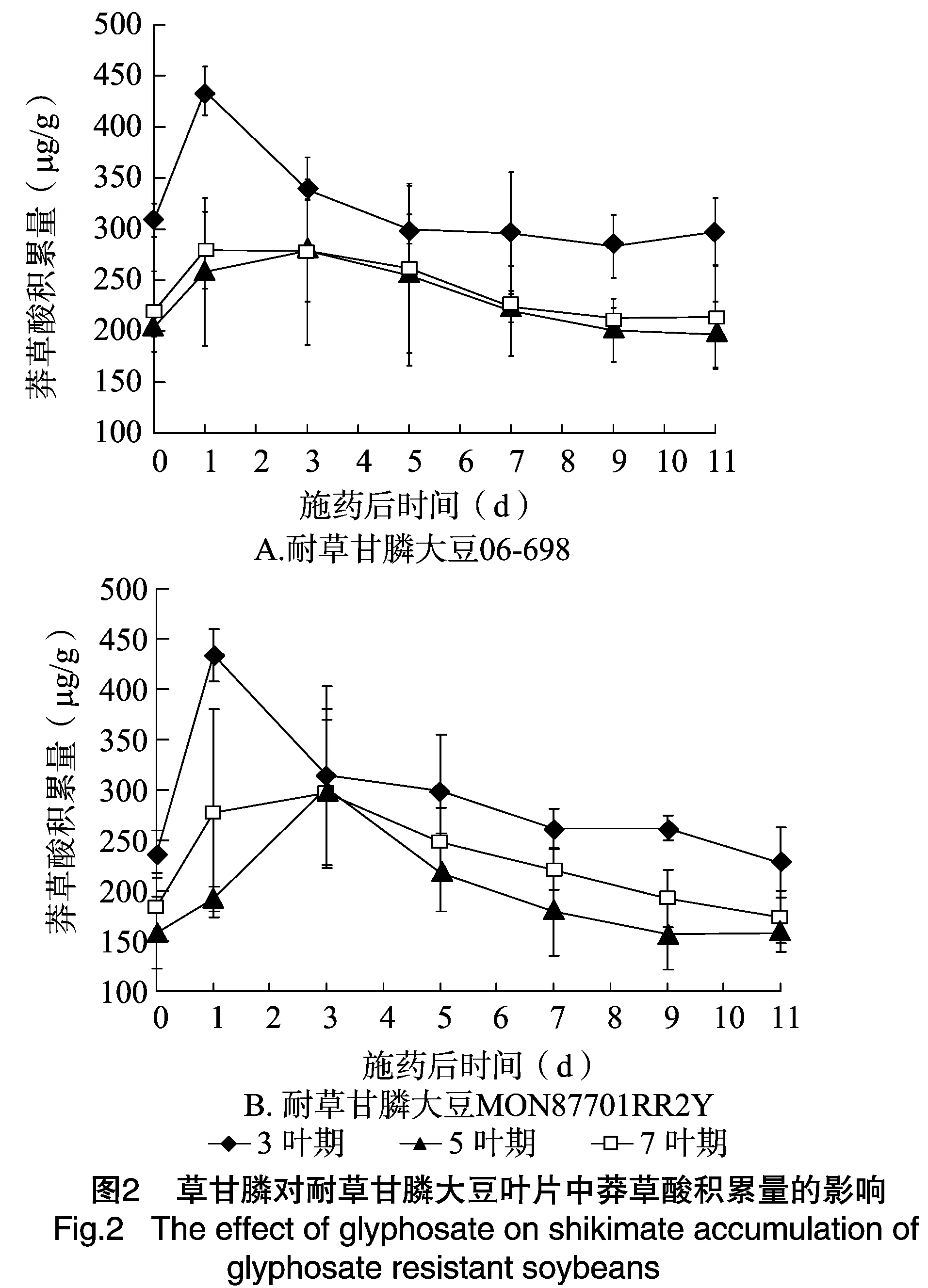
草甘膦施药量为1 230.0~3 690.0 g a.i./hm2时,药后1~9 d,耐草甘膦大豆 06-698体内莽草酸积累量与清水对照相比没有明显变化(图2-A),MON87701RR2Y也表现同样趋势,即喷施草甘膦处理与清水对照莽草酸积累差异不显著(图2-B)。用4倍推荐剂量草甘膦处理06-698和MON87701RR2Y后1 d,大豆叶片中莽草酸有一定程度积累,积累量分别为435.26、433.97 μg/g,是处理前的1.41、1.84倍,之后上述材料大豆叶片莽草酸积累量逐渐下降;至药后9 d,两材料叶片内莽草酸的积累量与药前相比差异不显著(图2)。田间试验结果与网室试验相近,即2个耐草甘膦大豆材料在草甘膦施药量为X~3X时,莽草酸积累量与清水对照差异不显著,草甘膦施药量为4X时,莽草酸积累量在药后1~3 d升高,之后与清水对照差异不显著。
2.2 不同叶龄喷施草甘膦后大豆体内莽草酸积累量的变化
在网室盆栽试验中,分别在大豆06-698的3、5、7叶期喷施4 920.0 g a.i./hm2草甘膦,随后研究该大豆材料叶片中莽草酸积累量的变化情况,结果见图3-A。由此可看出,3叶期施用草甘膦的大豆莽草酸积累量与5、7叶期施用草甘膦的大豆相比偏高。但方差分析结果表明,不同叶期施药,大豆叶片莽草酸积累量差异不显著。MON87701RR2Y也表现同样趋势(图3-B)。

由图4可知,田间条件下分别于3、5、7叶期对耐草甘膦大豆06-698和MON87701RR2Y喷施 4 920.0 g/hm2草甘膦后,其叶片中莽草酸积累量的变化趋势与网室盆栽试验中的相近,说明在供试的不同叶龄期喷施4 920.0 g/hm2草甘膦并未使耐草甘膦大豆叶片中莽草酸积累量发生显著变化。喷施其他低剂量草甘膦后,耐草甘膦大豆叶片中莽草酸积累量的变化趋势相同。但是,田间试验测得的耐草甘膦大豆叶片中莽草酸积累量和莽草酸峰值出现的时间与网室盆栽试验略有差异,这可能与田间较为复杂的环境条件有关。

2.3 喷施草甘膦对大豆产量的影响
由表1可以看出,在3~7叶期喷施不同剂量草甘膦后,06-698和MON87701RR2Y耐草甘膦大豆产量与对照差异不显著(P>0.05)。说明耐草甘膦大豆喷施草甘膦后,若叶片莽草酸积累量与对照差异不显著,则喷施草甘膦不会造成减产;喷施较高剂量草甘膦后,虽然大豆叶片莽草酸积累量前期有一定增加,但如果莽草酸短期能够恢复至药前水平,则大豆产量也不会受到影响。常规大豆在喷施X剂量草甘膦后,莽草酸积累量急剧增加且一直维持在较高水平,药后2周内基本死亡,无经济产量。

表1 不同叶龄期喷施草甘膦对耐草甘膦大豆产量的影响
3 结论与讨论
网室盆栽和田间条件下用草甘膦处理耐草甘膦大豆和常规大豆,这2种大豆叶片中莽草酸积累量差异显著。与不用药空白对照相比,用1 230.0~2 460.0 g a.i./hm2草甘膦处理后的耐草甘膦大豆06-698、MON87701叶片莽草酸积累量均未显著增加,而常规大豆绥农14和A5547叶片中的莽草酸积累量在1 230.0、2 460.0 g a.i./hm2草甘膦处理下急剧增加,之后一直保持在很高水平直至枯萎死亡。田间条件下的试验结果与盆栽结果相一致,这是因为受体大豆绥农14、A5547在喷施草甘膦后,其EPSPS酶受到抑制,导致莽草酸大量积累,而 06-698 和MON87701RR2Y则由于转入了不敏感的epsp基因使得芳香族氨基酸的合成继续进行,体内莽草酸积累量基本没有变化。这与Singh等报道的“普通大豆草甘膦处理后莽草酸积累量快速增加,而耐草甘膦大豆莽草酸积累量在低剂量307.5 g a.i./hm2草甘膦处理下基本不变”的结论[8]一致。
盆栽试验中耐草甘膦大豆MON87701RR2Y和06-6983在不同叶龄期喷施615.0~3 690.0 g a.i./hm2草甘膦,其叶片莽草酸积累量基本没有变化,表现出对草甘膦很强的耐受性。在 4 920.0 g a.i./hm2草甘膦处理下,这2种大豆在药后1~3 d出现莽草酸短暂积累峰值,但很快趋于平稳,这期间目测到大豆叶片有发黄现象,之后随大豆生长症状逐渐缓解。田间条件下的试验结果与盆栽试验莽草酸变化趋势相同,但田间试验条件下的大豆在不同叶龄期施药后,叶片莽草酸最大积累值出现的时间偏晚于盆栽试验,莽草酸总积累量也略有差异,这可能与田间复杂而多变的环境有关,如干旱,高温均会对耐草甘膦大豆体内EPSPS酶表达产生影响,从而影响莽草酸的积累[12-13]。盆栽及田间试验结果均显示,耐草甘膦大豆在3~7叶期对草甘膦耐受性没有明显差异,均表现出对1、2倍推荐剂量草甘膦很强的耐受性和对4倍推荐剂量草甘膦较强的耐受性,大豆测产结果也表明不同时期施药和不同处理剂量下的大豆产量与空白对照差异不显著。
本试验以施用草甘膦后大豆叶片莽草酸积累量为指标,对大豆耐草甘膦的程度进行研究,结果表明,施用草甘膦后,可以通过测定大豆叶片的莽草酸积累量来评估大豆对草甘膦的耐受性,其测定时间以药后3~5 d为宜。如果药后3~5 d,大豆叶片中莽草酸积累量与不用药空白对照差异不显著,则表明该大豆材料对草甘膦有较好的耐受性。以往主要采用生物测定方法来测定作物对草甘膦的耐受性,即在作物生长期喷施不同剂量草甘膦,以作物的株高、鲜质量等生物学指标的受抑制程度来判定其对草甘膦的耐受性,但这种方法历时较长,得出结论较晚;而且株高、鲜质量等指标常受环境的影响,造成个体生长量的差异。莽草酸积累量的测定,将为大豆的草甘膦耐受性检测提供一种简便、易行和不破坏整株植物的耐受性测定方法,对准确评价大豆对草甘膦的耐受性有重要意义。
参考文献:
[1]James C. Highlights of global status of commercialized biotech/GM crops[R]. New York:ISAAA,2012.
[2]宋 敏,刘丽军,苏颖异,等. 抗草甘膦EPSPS基因的专利保护分析[J]. 中国生物工程杂志,2010,30(2):147-152.
[3]Amrhein N,Deus B,Gehrke P,et al. The site of the inhibition of the shikimate pathway by glyphosate.Ⅱ. Interference of glyphosate with chorismate formationinvivoandinvitro[J]. Plant Physiology,1980,66(5):830-834.
[4]Pline W A,Wilcut J W,Duke S O,et al. Tolerance and accumulation of shikimic acid in response to glyphosate applications in glyphosate-resistant and nonglyphosate-resistant cotton(GossypiumhirsutumL.)[J]. Journal of Agricultural and Food Chemistry,2002,50(3):506-512.
[5]Lorraine-Colwill D F,Hawkes T R,Williams P H,et al. Resistance to glyphosate in Lolium rigidum[J]. Pesticide Science,1999,55(4):489-491.
[6]陈景超,张朝贤,黄红娟,等. 三种杂草对草甘膦的敏感性及处理后植株体内莽草酸积累量差异[J]. 农药学学报,2011,13(5):471-474.
[7]Henry W B,Koger C H,Shaner D L. Accumulation of shikimate in corn and soybean exposed to various rates of glyphosate[J]. Crop management,2005,4(1):1-6.
[8]Singh B K,Shaner D L. Rapid determination of glyphosate injury to plants and identification of glyphosate-resistant plants[J]. Weed Technology,1998,12(3):527-530.
[9]曹洪玉,李香菊,刘士阳,等. 草甘膦水剂在抗草甘膦转基因大豆田除草效果及安全性研究[J]. 杂草科学,2011,29(3):22-25.
[10]Gaitonde M K,Gordon M W. A microchemical method for the detection and determination of shikimic acid[J]. Journal of Biological Chemistry,1958,230(2):1043-1050.
[11]娄远来,邓渊钰,沈晋良,等. 甲磺隆和草甘膦对空心莲子草乙酰乳酸合酶活性和莽草酸含量的影响[J]. 植物保护学报,2005,32(2):185-188.
[12]李昌晓,钟章成,陶建平.不同水分条件下池杉幼苗根系的苹果酸、莽草酸含量及生物量[J]. 林业科学,2008,44(10):1-7.
[13]原向阳,郭平毅,张丽光,等. 干旱及复水条件下草甘膦对抗草甘膦大豆幼苗渗透调节物质和莽草酸含量的影响[J]. 核农学报,2012,26(7):1075-1081.
