丙酮酸钠林格氏液体外孵育对CPB患者血液流变学的影响
2014-08-13陈文博周方强何明海周佳丽罗玉涵唐金清芶大明
陈文博,周方强,黄 钦,何明海,周佳丽,罗玉涵,唐金清,芶大明
(1.遵义医学院 麻醉学系,贵州 遵义 563099;2.美国芝加哥费森尤斯透析中心,芝加哥 60102,美国)
体外循环(Cardiopulmonary bypass,CPB)是心内直视手术的必备技术,但CPB转机过程中的各种因素均可能导致红细胞损伤。红细胞是血液中主要有形成分,临床上常以血液流变指标的变化情况反映红细胞的变化情况。大量的动物实验已证实丙酮酸盐(Pyruvate)具有改善糖代谢和提供能量代谢底物,抗氧化应激,抗炎,纠正细胞内酸中毒,从而提高细胞缺氧耐受性 (Hypoxia tolerance), 改善组织、细胞的氧合功能等多方面作用[1-4]。从理论上推测,丙酮酸钠林格氏液有可能对体外循环转机中损伤的红细胞有保护作用,因而丙酮酸钠林格氏液体外孵育有可能对CPB患者血液流变学有积极作用。本研究观察丙酮酸钠林格氏液体外孵育CPB患者血液后对血液流变学的影响,从而为临床血液保护探寻新的方法。
1 材料与方法
1.1 溶液的配制 丙酮酸钠林格氏液:取丙酮酸钠0.31 g,NaCl6.0 g,KCl0.3 g,CaCl20.2 g及用注射用水加到1 000 mL,未用完当天弃掉。乳酸钠林格氏液:取乳酸钠0.31 g,NaCl6.0 g,KCl0.3 g,CaCl20.2 g及用注射用水加到1 000 mL,未用完当天弃掉。
1.2 实验方法
1.2.1 病例资料 本研究经遵义医学院附属医院伦理委员会同意,并获得病人及其家属知情同意并签订知情同意书,2013年3~9月在遵义医学院附属医院因心脏瓣膜病变择期在CPB直视下行单瓣膜置换术的13例成年患者。
1.2.2 病例纳入与排除标准 纳入标准:心脏手术的单瓣膜置换 (二尖瓣、主动脉瓣) 患者,年龄18~65岁;ASA分级Ⅱ~Ⅲ;心功能分级Ⅱ~Ⅲ;凝血功能、肝肾功能均在正常范围内。
排除标准:急症手术;临床明确诊断的严重的血液系统疾病;临床明确诊断的血红蛋白携氧能力缺陷;同时伴有良恶性肿瘤;同时伴有全身免疫系统疾病患者;术前两周使用过影响凝血功能类药物的患者。
1.2.3 患者分别在CPB转机前(T1)经桡动脉采血3 mL;转机10 min(T2)、60 min (T3)、停机60 min (T4)各采血21 mL。①患者分别在T1时点采血3 mL,测血液流变学指标(基础值)。②患者分别在转机10 min(T2)、60 min (T3)和停机60 min (T4)各采血21 mL,各时点取标本3 mL,测血液流变学指标(基础值),T2、T3和T4各时点剩余血样18 mL均分成6份 (每份3 mL),随机分为对照组 (C组)、丙酮酸钠林格氏液组 (P组) 和乳酸钠林格氏液组 (L组),每组两份。C组各时点的两样本各加入生理盐水1 mL后,在37℃下,一份孵育30 min,另一份孵育60 min后检测血液流变学指标;P组和L组各时点的两份样本分别加入丙酮酸钠林格氏液1 mL、乳酸钠林格氏液1 mL后,余处理同C组。采用LH-75全自动五分类血细胞分析仪(Beckman Coulter公司,美国)测定红细胞压积(Hct),采用EHK-40红细胞沉降压积仪(百康立科技有限公司)检测血沉,Hct和血沉的数据输入South-990全自动血液粘度动态分析仪(重庆南方数控设备有限责任公司)检测血液流变学指标。为避免血液稀释对实验结果的影响,所测数据均用校正值=测定值×CPB前HCT/测定值HCT予以校正。
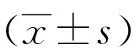
2 结果
2.1 一般资料 本研究自2013年1~9月,在遵义医学院附属医院行择期手术的患者中随机选择13例符合入选标准者。13例病例一般资料(见表1)。

项目数值年龄 (岁)性别 (男/女)主动脉置换 (例)二尖瓣置换 (例)CPB时间 (min)主动脉阻断时间 (min)ASA分级Ⅱ/Ⅲ级 (例)心功能分级Ⅱ/Ⅲ级 (例)心功能分级Ⅱ级~Ⅲ级 (例)50.40±3.255/849100.00±24.9564.53±17.116/72/92
2.2 血液流变学指标
2.2.1 CPB转机过程对患者血液流变学指标的影响情况 CPB转机后全血高切还原粘度( BHRV )、全血低切还原粘度( BLRV )、红细胞聚集指数( EAI )、红细胞刚性指数( ERI )、红细胞变形指数( EDI )与T1比较,各个指标基础值分别在T2、T3时点明显升高,差异有统计学意义(P< 0.05);其余血液流变学指标基础值比较均无明显差异(P> 0.05,见表2)。


项目T1T2T3T4BHV (200 /s,mPa)3.70±0.394.21±0.353.98±0.253.69±0.14BMV (30 /s,mPa)4.44±0.534.95±0.414.60±0.314.30±0.17BLV (1/ s,mPa))9.22±1.3011.31±2.068.56±0.828.20±0.41全血高切相对粘度2.10±0.373.18±0.363.17±0.213.14±0.13全血低切相对粘度5.49±0.978.06±0.757.48±0.736.97±0.36BHRV (10 / s)11.10±0.3923.42±2.89▲19.46±2.4616.17±0.75BLRV (1/ s)15.30±2.6831.43±3.94▲21.88±3.1021.40±0.94PV (mPa, s)1.89±3.561.70±0.581.64±1.301.48±0.36EAI2.43±0.793.04±0.213.91±0.18▲2.78±0.85 EET(s)12.93±1.3514.11±0.6913.93±0.8712.94±0.50ERI5.11±2.969.30±1.79▲8.97±2.78 ▲7.19±0.91EDI0.81±0.362.34±1.02▲1.79±0.37▲1.47±0.13
转机后各时点(T2,T3,T4)与转机前(T1)比较:▲P<0.05, ▲▲P<0.01。
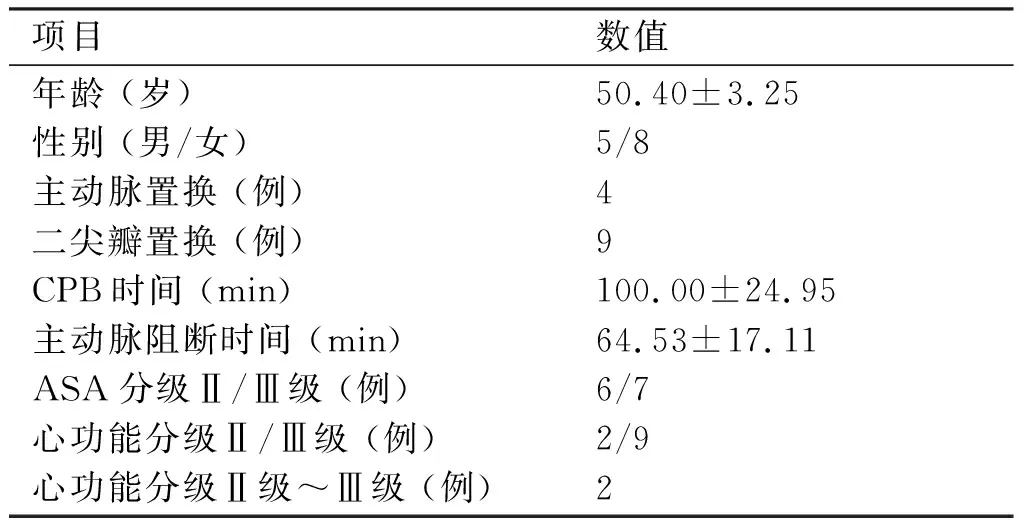
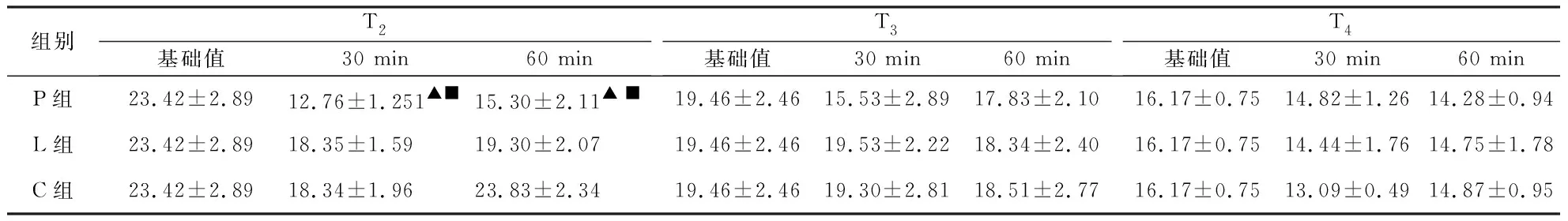
2.2.2 CPB转机后各时点3组液体孵育后血液流变学指标的变化情况 ①BHRV:T2时点,P组孵育30 min后BHRV明显低于基础值,差异有统计学意义(P< 0.05)。②红细胞聚集指数( EAI ): T3时点,P组孵育30 min后EAI显著比基础值降低,差异有统计学意义(P<0.05)。③红细胞电泳时间(EET):T2时点,P组孵育30 min后EET显著比基础值降低,差异有统计学意义(P<0.05)。④红细胞刚性指数(ERI):T2时点,与T2时点基础值比较,P组孵育30 min后ERI明显降低,差异有统计学意义(P<0.05),P组孵育30 min、60min后,ERI明显低于孵育同时间的C组和L组,差异有统计学意义(P<0.05)。⑤红细胞变形指数(EDI):T2、T3时点,孵育30 min后,P组EDI值明显低于C、L组,差异有统计学意义(P<0.05)。⑥其余血液流变学指标孵育前后均无明显变化(P>0.05,见表3~7)。

组别T2基础值30 min60 min T3基础值30 min60 minT4基础值30 min60 minP组23.42±2.8912.76±1.251▲■15.30±2.11▲ ■19.46±2.4615.53±2.8917.83±2.1016.17±0.7514.82±1.2614.28±0.94L组23.42±2.8918.35±1.5919.30±2.0719.46±2.4619.53±2.2218.34±2.4016.17±0.7514.44±1.7614.75±1.78C组23.42±2.8918.34±1.9623.83±2.3419.46±2.4619.30±2.8118.51±2.7716.17±0.7513.09±0.4914.87±0.95
组内 T2、T3、T4时点各组孵育后与基础值比较:▲P < 0.05,▲▲P < 0.01;同时点P组与R组和C组比较:■P<0.05,■■P<0.01。

组别T2基础值30 min60 min T3基础值30 min60 minT4基础值30 min60 minP组3.04±0.213.09±0.213.33±0.233.90±0.182.81±0.14▲ 3.31±0.202.78±0.852.94±0.102.89±0.11L组3.04±0.213.33±0.153.43±0.173.91±0.183.46±0.253.38±0.102.78±0.853.00±0.193.03±0.13C组3.04±0.213.49±0.173.61±0.153.91±0.183.46±0.213.45±0.232.78±0.852.81±0.652.73±0.18
T2、T3、T4时点各组孵育后与基础值比较:▲P< 0.05,▲▲P<0.01。


组别T2基础值30 min60 min T3基础值30 min60 minT4基础值30 min60 minP组14.11±0.6911.67±0.43■12.47±0.0613.93±0.879.84±0.58▲■12.38±0.5812.94±0.5110.24±0.4411.04±0.40L组14.11±0.6913.43±0.5613.74±0.5213.93±0.8713.51±0.6013.73±0.5412.94±0.5111.86±0.3912.31±0.43C组14.11±0.6913.75±0.5813.91±0.5713.93±0.8713.85±0.6013.73±0.5812.94±0.5112.06±0.3511.85±0.44
T2、T3、T4时点各组孵育后与基础值比较:▲P<0.05,▲▲P< 0.01;同时点P组与R组和C组比较:■P<0.05,■■P<0.01。


组别T2基础值30 min60 min T3基础值30 min60 minT4基础值30 min60 minP组2.34±1.021.49±0.25▲# 2.33±0.821.79±0.731.23±0.47▲#1.73±0.25 1.47±0.13 1.52±0.381.74±0.42L组2.34±1.022.78±0.86 2.60±0.391.79±0.732.52±0.47 2.46±0.401.47±0.131.93±0.781.89±0.52C组2.34±1.022.59±0.61 2.72±0.421.79±0.73 2.24±0.94 2.29±0.801.47±0.13 1.96±0.671.87±0.24
T2、T3、T4时点各组孵育后与基础值比较:▲P<0.05,▲▲P<0.01;同时点P组与L和C组组间比较:#P<0.05,##P<0.01。


组别T2基础值30 min60 min T3基础值30 min60 minT4基础值30 min60 minP组9.30±1.795.87±1.25▲#7.47±2.28▲# 8.97±2.785.85±1.287.04±1.487.91±0.916.59±0.897.13±0.57L组9.30±1.799.47±1.8310.79±1.33 8.97±2.789.82±2.439.58±2.647.91±0.917.90±0.938.35±1.21C组9.30±1.799.34±2.6011.10±1.878.97±2.789.72±2.169.49±3.737.91±0.917.96±1.117.56±1.25
T2、T3、T4时点各组孵育后与基础值比较:▲P<0.05,▲▲P< 0.01;同时点P组与L和C组组间比较:#P<0.05,##P<0.01。
3 讨论
3.1 CPB转机对血液流变学的影响 血液流变学是研究血液及其成分的流动性和变形性规律的科学[5]。 由于红细胞占据血液有形成分的95%以上,所以红细胞功能状态与血液流变学指标的变化密切相关。本研究显示,CPB转机10 min,BHRV,BLRV,ERI和EDI与转机前比较显著增高(P<0.05),说明CPB确能增加红细胞的粘度,降低红细胞的变形功能[6];目前认为CPB导致增加红细胞的粘度,降低红细胞的变形功能可能因素有:①CPB转机后血液与非生物人工材料表面相接触、温度的骤变、酸中毒、血流动力学的急剧改变、血液的异常稀释、血液中各种成分和多种酶系统被激活,诱导激发一系列炎性反应损伤红细胞和组织[7];②CPB转机可引起红细胞膜脂质过氧化反应增强,膜流动性降低,使红细胞刚性增高、变形能力下降[8-9];③CPB转机中能量的代谢异常,红细胞膜中ATP减少会导致Ca2+的增加,当能量耗竭时,Ca2+-ATP酶和Na+-K+-ATP酶因ATP缺乏而被抑制,同时Na+-Ca2+交换减少甚至出现逆向交换,细胞内Ca2+超载[ 10-11 ],从而导致红细胞膜变硬,变形性降低。CPB停机60 min血液流变学指标比CPB转机10 min和CPB转机60 min有改善,但与转机前比较仍未完全恢复,可能与停机60 min后,机器损伤减少,血液剪切力恢复到正常的生理状态有关。
综上所述,CPB转机对血液流变学有不良影响,丙酮酸钠林格氏液体外孵育CPB患者血液后,对血液流变学有改善作用,而乳酸钠林格氏液体外孵育血液无此效应。
[参考文献]
[1] 谭洪婧,芶大明,周方强.丙酮酸盐对红细胞的影响机制及在体外循环中的应用前景[J].国际麻醉学与复苏杂志,2011,32(3):347-350.
[2] 芶大明,谭洪婧,周方强,等.丙酮酸钠对犬血在体外循环机内循环时红细胞能量代谢的影响[J].中华麻醉学杂志,2012,32(2):152-153.
[3] Gou D, Tan H, Cai H,et al. Pyruvate effects on red blood cells during in vitro cardiopulmonary bypass with dog's blood[J].Artificial Organs,2012,36(11): 988-991.
[4] 韩晓春,胡森,刘先奇,等.丙酮酸钠液对烫伤休克大鼠肾血管通透性的影响[J].中国医学工程,2011,19(4):4-6.
[5] 秦任甲.临床血液流变学[M].北京:北京大学医学出版社,2003:4-6.
[6] 石英,陶国才,汪玉林,等.复方电解质注射液对回收红细胞膜Na+-K+-ATP酶活性和血液流变学的影响[J].临床麻醉学杂志,2012,28(9):888-890.
[7] Berg K, Langaas M, Ericsson M, et al. Acetylsalicylic acid treatment until surgery reduces oxidative stress and inflammation in patients undergoing coronary artery bypass grafting [J].European Journal Cardio-Thoracic Surgery,2013,43(6): 1154-1163.
[8] Ochoa J J,Vilchez M J, Ibanez S, et al.Oxidative stress is evident in erythrocytes as well as plasma in patients undergoing heart surgery involving cardiopulmonary bypass [J].Free Radical Res,2003,37(1): 11-17.
[9] Ochoa J J, Vilchez M J, Palacios M A, et al. Melatonin protects against lipid peroxidation and membrane rigidity in erythrocytes from patients undergoing cardiopulmonary bypass surgery [J].J Pineal Res,2003,35(2):104-108.
[10] Nicolay J P, Schneider J, Niemoeller O M, et al.Stimulation of suicidal erythrocyte death by methylglyoxal [J].Cell Physiol Biochem,2006,18(4-5): 223-232.
[11] Barvitenko N N, Adragna N C, Weber R E. Erythrocyte Signal transduction pathways, their oxygenation dependence and functional significance [J].Cell Physiol Biochem,2005,15(1-4):1-18.
[12] Knott E M, Sun J, Lei Y, et al. Pyruvate mitigates oxidative stress during reperfusion of cardioplegia-arrested myocardium [J].Ann Thorac Surg,2006,81(3): 928-934.
[13] Zhou F Q. Pyruvate in the correction of intracellular acidosis: a metabolic basis as a novel superior buffer [J].Am J Nephrol,2005,25(1):55-63.
[14] Nyengaard J R, Ido Y,Kilo C , et al. Interactions between hyperglycemia and hypoxia: implications for diabetic retinopathy [J].Diabetes,2004,53(2):2931-2938.
