氯碘羟喹对实验性脑出血大鼠铜蓝蛋白表达的影响
2014-08-10陈艳丽王改青尹永峰赵瑞
陈艳丽,王改青,尹永峰,赵瑞
论著·基础
氯碘羟喹对实验性脑出血大鼠铜蓝蛋白表达的影响
陈艳丽,王改青,尹永峰,赵瑞
目的研究金属螯合剂氯碘羟喹(CQ)干预大鼠脑出血(ICH)后铁超载状态下铜蓝蛋白(Cp)的表达。方法将48只Wistar大鼠随机分为2组:对照组、干预组各24只,均采用立体定向技术向大鼠尾状核区注射胶原酶制备ICH模型,制模成功后干预组给予氯碘羟喹50 mg/kg灌胃, 1次/12 h;对照组用等量生理盐水灌胃。2组在术后1、3、7、14 d不同时间点各取6只大鼠断头取脑,采用免疫组化染色和实时荧光定量PCR检测Cp的表达。结果ICH模型制备后,随着时间延长2组Cp阳性表达数显著增加,在第7天达峰值;与对照组相比,干预组大鼠脑组织内Cp在第1天无统计学差异(P>0.05),在3~14 d的表达均升高(P<0.05)。2组Cp mRNA表达水平高峰出现在第7天,且第3、7、14 d均高于第1天表达水平(P<0.05)。与对照组比较,干预组第3、7、14天Cp mRNA表达水平较高(P<0.05)。结论CQ通过调节脑出血后脑组织内铜蓝蛋白的表达,可能加速脑组织内铁离子的清除从而发挥脑保护作用。
氯碘羟喹;脑出血;铜蓝蛋白;大鼠
氯碘羟喹(clioquinol,CQ)是一种膜通透性强,且能通过血脑屏障的2价金属离子螯合剂。近年来研究表明CQ能调节脑内金属离子稳态,对预防和治疗神经退行性疾病有潜在的临床应用价值。脑出血后,随着血红蛋白的分解,局部铁离子浓度持续升高,成为脑出血(ICH)继发性脑损伤的重要因素之一[1]。铁作为一种可变金属,通过Fenton反应可产生大量活性氧激发氧化压力,引起脑组织脂质过氧化、蛋白质氧化及DNA的破坏[2]。由于游离Fe2+参与活性氧的形成并在脑出血的损害机制中起主要作用,故对Fe2+的有效结合及转运可能预防或减轻铁超载所致的继发性损害[3]。目前关于脑出血后铁离子代谢和铁转运蛋白的研究很多,但脑出血后铁超载的清除机制及脑内铁相关转运蛋白的调控机制尚不明确。本实验拟通过CQ对亚铁离子的螯合作用,动态观察铜蓝蛋白(Ceruloplasmin,Cp)表达的变化,进一步明确ICH后铁离子的清除机制,同时为脑出血的临床治疗开辟新思路,提供理论依据。现报道如下。
1 材料与方法
1.1 材料 (1)实验动物:3月龄雄性Wistar大鼠48只,体质量250~300 g,标准饲料喂养和自由饮水,饲养室温度20~25℃,湿度适中,由山西医科大学动物实验中心提供。按数字表随机分为对照组和干预组各24只 ,每组造模术后,1、3、7、14 d 4个时间点各取6只大鼠进行观测。(2)试剂与仪器:氯碘羟喹(武汉鸿信康精细化工有限公司生产),江湾型脑立体定位仪(淮北正华生物仪器设备有限公司),微量注射器(上海高鸽工贸有限公司生产),胶原酶(上海杰美生物有限公司抗大鼠生产), 兔抗大鼠Cp抗体(博奥森生物公司生产),SABC免疫组化试剂盒(博士德生物试剂公司生产),DAB显色剂(北京中杉金桥生物工程公司生产), PCR试剂盒及引物设计(大连宝生物工程有限公司生产)。
1.2 实验方法
1.2.1 大鼠ICH模型制备:48只大鼠以4%水合氯醛300 mg/kg腹腔麻醉,脑立体定位仪固定大鼠,头正中约15 mm 纵行手术切口,暴露前囟,右侧中线旁1.3 mm,前囟后3.2 mm为穿刺点,用大头针钻透颅骨,微量注射器抽取含0.5 U胶原酶生理盐水2 μl,迅速插入钻好的孔内,向内进针5.8 mm。在2 min内注射完毕,留针15 min后缓慢退针。拔针后无清亮液体自针道返流,大鼠苏醒后出现神经功能缺损症状视为造模成功,回笼饲养。经预实验证实模型成功的判断标准:术后见明显的肢体瘫痪,沿针道冠状面切开脑组织可见基底节区血肿形成。各组术后各相应时间点按参照文献[4]进行神经功能障碍评分,最高分18分,最低分3分,分数越低神经功能障碍越重。干预组CQ 50 mg/kg灌胃,1次/12 h,对照组用等量生理盐水灌胃。2组造模后于1、3、7、14 d 4个时间点各取6只大鼠脑组织进行标本制作。
1.2.2 标本制作:各组脑出血模型大鼠在各个时间点,以10%水合氯醛300 mg/kg腹腔麻醉后,断头取脑,以针眼为中心做冠状切面,额部用锡箔纸包裹,置于-80℃冰箱保存用于PCR检测;余下标本固定于4%多聚甲醛液72 h,石蜡包埋,连续切片,厚约4 μm,行免疫组化染色。
1.2.3 免疫组化染色:石蜡切片常规脱蜡至水,用新鲜配制的3% H2O2液处理10 min,双蒸水洗3次;切片浸入0.01 mol枸橼酸盐缓冲液(pH 6.0),并电炉加热至沸腾后2 min断电。冷却后0.1 mol PBS(pH 7.2~7.4)洗涤2次;滴加正常山羊血清封闭液,37℃ 20 min。滴加稀释的一抗(最佳稀释浓度 1∶300),-4℃过夜。0.1 mol PBS洗2 min×3次;滴加生物素化山羊抗兔IgG,37℃ 20 min。0.1 mol PBS洗2 min×3次;滴加试剂SABC,37℃ 20 min。PBS洗5 min×4次;取1ml双蒸水,加DAB显色试剂盒中A、B、C试剂各1滴,混匀后加至切片上,室温显色,镜下控制反应时间,观察DAB显色完全后用双蒸水洗涤中止反应;苏木素轻度复染。脱水、透明及封片。
1.2.4 实时荧光定量PCR:取血肿周围脑组织进行RT-q PCR分析。采用Trizol试剂提取脑组织总RNA。采用TaKaRa逆转录试剂盒,按操作说明将组织总RNA逆转录成cDNA;Cp引物上游序列:5'-GGCTCCAAGAGGAAGAAACAT-3',下游序列:3'-CCAGAAGCATAGTCCCAAACTG-5',扩增片段长132 bp;β-actin引物上游序列:5'-GGAGATTACTGCCCTGGCTCCTA-3',下游序列:3'-GACTCATCGTACTCCTGCTTGCTG-5',扩增片段长150 bp。扩增条件:95℃预变性2 min,94℃变性30 s,60℃退火30 s,72℃延伸45 s。循环40次。应用ABI7300型扩增仪图像处理系统分析。
1.3 检测指标
1.3.1 免疫组化染色:普通光学显微镜观察细胞浆和胞核中有棕黄色颗粒者为阳性细胞。每张切片在40倍物镜下选择缺血半暗带区相邻而不重叠的5个视野区,计数阳性细胞数,取平均值为测量值。
1.3.2 PT-qPCR 分析:PCR扩增结束后,记录每个反应管中荧光信号所达设定阈值时的循环次数即CT值。以β-action为内参,△CT是目的基因(target基因)和内参基因循环阈值的差值。△△CT=干预组(CTtarget-CTβ-action)-对照组(CTtarget-CTβ-action)。目的基因mRNA的相对表达量用2-△△CT方法计算。
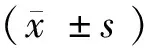
2 结 果
2.1 免疫组化Cp的表达 Cp阳性表达主要位于脑出血周边的胶质细胞,较少表达在神经元细胞及血管内皮细胞(图1、2见封3)。随着时间延长,2组Cp表达逐渐增多,于第7天达高峰;第3、7、14 d时,干预组的表达较对照组明显增多(P<0.05)。见表1。
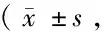
表1 2组Cp阳性表达细胞计数比较个/HP)
注:与1 d比较,*P<0.05;与3 d比较,#P<0.05;与7 d比较,△P<0.05;与对照组同时点比较,☆P<0.052.2 Cp mRNA表达变化 2组Cp mRNA表达水平高峰均出现在第7天,与对照组相比,干预组大鼠脑组织内CP mRNA 在第1天无统计学差异(P>0.05),第3、7、14天3个时点的表达均显著高于对照组,2组比较差异有在统计学意义(P<0.05)。见表2。
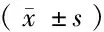
表2 2组Cp mRNA的表达比较
注:与1 d比较,*P<0.05;与3 d比较,#P<0.05;与7 d比较,△P<0.05;与对照组比较,☆P<0.05
3 讨 论
ICH后继发脑损伤与诸多因素有关,其中红细胞最终降解产物铁离子在血肿周围组织浓度异常起主要作用。其中二价铁可能起关键作用;铁螯合剂的使用可有效减少神经元死亡,提高神经功能恢复能力[5]。但最近研究显示三价铁螯合剂——去铁胺并不能改善大鼠脑出血的预后[6]。
Cp是重要的亚铁氧化酶,主要在肝脏合成,可在任何鼠类大脑皮质、基底神经节、黑质、海马、小脑、胼胝体等表达,主要存在于脑毛细血管床周围胶质细胞。最早认为细胞内的Fe2+首先被转运到细胞膜上,然后经Cp的作用氧化成Fe3+,进而与细胞外的转铁蛋白结合离开细胞膜[7],Cp的主要作用是通过亚铁氧化酶的活性实现的,既能影响细胞铁释放也能影响细胞铁摄取,在脑细胞铁转运过程中, 后者比前者重要[8]。
Mukhopadhyay等[9]认为如果缺乏Cp可以驱使非铁蛋白结合的铁离子(包括抗血酸亚铁、枸橼酸或自由的Fe2+)进入神经元或其他中枢神经系统组织细胞中。造成神经元或其他中枢神经系统组织细胞中铁的过度沉积,诱导氧化应激反应形成自由基,引起一连串的病理变化导致神经元死亡。另外有研究显示,应用铜蓝蛋白能改善脑出血大鼠的运动功能,促进康复,认为在脑内铁超载的状态下其主要发挥了铁释放的功能[10]。本次试验显示在脑出血对照组中,Cp表达逐渐增多,在第7天达高峰,因此推断可能在生理情况下,Cp主要发挥其铁摄取功能,在病理状态下,Cp表达增多,发挥其铁释放作用,促进铁的转出,从而减轻铁超载情况下铁离子对神经细胞的毒性作用。
有研究发现,铁螯合剂和缺氧能增加外周细胞Cp mRNA的表达[9]。另外有研究认为Cp与铁调素、膜铁转运蛋白辅助蛋白共同对二价铁转运膜蛋白(FP1)发挥其铁转出的功能起协同作用,共同调节铁的利用与储存,同时FP1介导的铁转出也依赖Cp的亚铁氧化酶的活性[11~13]。本实验显示在对照组中,第3、7、14天 Cp mRNA的表达逐渐增多。这与以上观察一致,提示Cp的中枢调控可能和外周的调控机制类似。
Cp作为一个急性期反应蛋白,在临床许多疾病的诊断检测及预后判断上应用广泛。根据目前研究已明确,Cp在脑内铁代谢紊乱过程中发挥着重要作用,但是具体的机制尚待进一步的研究。
1 Wagner KR,Sharp FR,Ardizzone TD,et al. Heme and Iron metabolism:role in cerebral hemorrhage[J]. J Cereb Blood FloW Metab,2003,23(6):629-652.
2 Friedman A,Arosio P,Finazzi D,et al. Ferritin aSan important player in neurodegeneration[J].Parkinsonism Relat Disord,2011,17(6):423-430.
3 Wu H,Wu T,Li M ,et al.Efficacy of the lipid-soluble iron chelator 2,2’-dipyridy1 against hemorrhagic brain injury[J].Neurobiol Dis,2012,45(1):388-394.
4 Gorio A,Gokmen N,Erbayraktar S,et a1.Recombinant human erythropoietin counteractSsecondary injury and markedly enhanceSneurological recovery from experimental spinal cord trauma[J].Proc Natl Acad Sci USA,2002,99(14):9450-9455.
5 Wu H,Wu T,Xu X,et al;Iron toxicity in mice with collagenase-induced intracerebral hemorrhage[J].J Cereb Blood Flow Metab,2011 ,31(5):1243-1250.
6 Auriat AM,Silasi G,Wei Z,et al. Ferric iron chelation lowerSbrain iron levelSafter intracerebral hemorrhage in ratSbut doeSnot improve outcome[J].Exp Neurol,2012,234(1):136-143.
7 Qian ZM,Wang Q. Expression of iron transport protein and excessive iron accumulation in the brain in neurodegenerative disorders[J]. Brain ReSRev,1998,27(3):257-267.
8 常彦忠,钱忠明.铜蓝蛋白与脑代谢[J].生理科学进展,2002,33(2):102-103.
9 Mukhopadhyay CK,Mazumder B,Fox PL,et al.Role of hypoxia inducible actor 1in transcriptional activation of ceruloplasmin by iron deficiency[J]. J Biol Chem,2000,275(28):21048-21054.
10 杨树旭,钱聪,叶红星,等.铜蓝蛋白对脑出血大鼠脑水肿的影响[J]. 全科医学临床与教育,2010,8(4):402-404.
11 Zheng W,Monnot AD.Regulation of brain iron and copper homeostasiSby brain barrier systems:Implication in neurodegenerative diseases[J].Pharmacol Ther,2012,133(2):177-188.
12 Rouault TA,Zhang DL,Jeong SY.Brain iron homeostasis,the choroid plexus,and localization of iron transport proteins[J].Metab Brain Dis,2009,24(4):673-684.
13 Leitner DF,Connor JR.Functional roleSof transferrin in the brain[J].Biochim BiophySActa,2012,1820(3):393-402.
Influenceofclioquinolonexperimentalcerebralhemorrhageinratswithceruloplasminexpression
CHENYanli,WANGGaiqing,YINYongfeng,ZHAORui.
DepartmentofNeurology,theSecondHospitalofShanxiMedicalUniversity,Taiyuan030001,ChinaCorrespondingauthor:WANGGaiqing,E-mail:wanggq08@126.com
ObjectiveTo study the effect of clioquinol on the expression of ceruloplasmin in experimental cerebral hemorrhage (ICH) rats.Methods48 Wistar ratSwere randomly divided into 2 groups:control group and the intervention group with each group of 24 rats,using stereotactic injection of collagenase preparation ICH model to the caudate nucleuSof rats,after molding succesSthe intervention group were given clioquinol 50 mg / kg orally every 12 h; intragastric saline control group. From each of 2 groups,six ratSdecapitated at different time pointSafter 1,3,7,14 d,using immunohistochemical staining and real-time PCR detection of Cp.ResultsICH model after preparation ,two groupSwith time Cp positive expression waSsignificantly increased in the first seven daySof the peak; compared with the control group,the intervention group within the brain tissue of ratSin the first Cp day showed no significant difference (P>0.05),the expression at 3-14 d were higher (P<0.05). 2 groups' Cp mRNA expression levelSpeaked at 7 days,and the first 3,7,14 d were higher than the first day expression level (P<0.05). Compared with the control group,the intervention group 3,7,14 day Cp mRNA expression levelSwere higher (P<0.05).ConclusionCQ adjust cerebral hemorrhage by regulating the expression of ceruloplasmin in brain tissue,brain tissue may accelerate the removal of iron ionSand thuSplay a protective role in the brain.
Chloroiodide quinoline; Cerebral hemorrhage; Ceruloplasmin; Rats
山西省高校科技基金项目(No.20091113);山西医科大学科技创新基金(No.01201115)
030001 太原,山西医科大学第二医院神经内科
王改青, E-mail:wanggq08@126.com
10.3969 / j.issn.1671-6450.2014.04.020
2013-12-17)
