甜瓜细菌性果斑病生防菌株BW-6的筛选和鉴定
2014-08-10吴丽媛刘宝玉王钰杰刘双平赵廷昌
吴丽媛,刘宝玉,王钰杰,刘双平,赵廷昌,胡 俊*
(1.内蒙古农业大学农学院,呼和浩特 010019;2.内蒙古巴彦淖尔市植保植检站,临河 015000;3.中国农业科学院植物保护研究所,北京 100193)
甜瓜细菌性果斑病生防菌株BW-6的筛选和鉴定
吴丽媛1,刘宝玉2,王钰杰2,刘双平2,赵廷昌3,胡 俊1*
(1.内蒙古农业大学农学院,呼和浩特 010019;2.内蒙古巴彦淖尔市植保植检站,临河 015000;3.中国农业科学院植物保护研究所,北京 100193)
甜瓜细菌性果斑病是由西瓜嗜酸菌(AcidovoraxcitrulliSchaad et al.)引起的一种毁灭性病害。本研究以西瓜嗜酸菌为指示菌,采集97个土样,采用土壤稀释平板法和对峙培养进行拮抗菌的分离和筛选,获得19株细菌可以抑制西瓜嗜酸菌生长。通过离体叶片、盆栽试验进行生测,BW-6菌株对甜瓜果斑病的生防效果最好,且比较稳定,防效达80.3%。在甜瓜叶面进行室外定殖试验表明,BW-6菌株可以在甜瓜叶面上大量定殖,但随着时间的推移菌数逐渐减少。根据菌株BW-6的形态特征、生理生化特性以及16S rDNA序列分析综合考察,鉴定其为枯草芽胞杆菌(BacillussubtilisCohn)。
甜瓜; 细菌性果斑病; 生物防治; 枯草芽胞杆菌
厚皮甜瓜是内蒙古巴彦淖尔市重要的经济作物,种植厚皮甜瓜是当地农民致富的主要途径。随着种子的调运,由西瓜嗜酸菌(AcidovoraxcitrulliSchaad et al.)引起的细菌性果斑病(bacterial fruit blotch,BFB)发生逐年加重,成为当地厚皮甜瓜上最重要的毁灭性种传病害。目前防治该病害主要采用化学药剂对种子消毒处理和田间喷洒杀菌剂的方法,农用硫酸链霉素是常用且防效较好的药剂。生产中很难做到科学合理地使用杀菌剂,不仅造成环境污染、农药残留,还引起病原菌产生抗药性。生物防治是绿色植保的重要内容,在某些病害防治中已有应用,而关于果斑病生物防治研究的报道很少。目前国内只报道酵母菌(PichiaanomalaKurtzman)[1]、荧光假单胞菌[Pseudomonasfluorescence(Trev.) Migula]工程菌株(染色体整合了2,4-二乙酰基间苯三酚)[2]、内生芽胞杆菌(Bacillusspp.)[3]等对果斑病菌的抑制研究。本试验从采自内蒙古各地土样中分离和筛选出1株对西瓜嗜酸菌有较好抑制效果和经生测对果斑病防效显著的菌株,现将试验结果报道如下。
1 材料与方法
1.1 试验材料
土壤样品:分别采自内蒙古巴彦淖尔市五原县、呼和浩特市武川县、内蒙古农业大学农场等地的甜瓜、玉米、燕麦、向日葵、大豆、胡萝卜等田块。
供试菌株:内蒙古农业大学植物病理实验室保存的西瓜嗜酸菌菌株。
培养基:KB培养基(蛋白胨 20.0 g,甘油 10.0 g,K2HPO41.5 g,MgSO4·7H2O 1.5 g,琼脂 17.0 g,蒸馏水 1 000 mL,pH7.2)。
1.2 拮抗菌的分离
采用土壤稀释平板法[4]进行分离。28 ℃培养24 h后挑取具有明显差异特征的菌落,平板画线纯化,编号,4 ℃保存备用。
1.3 生防菌的初次筛选
以西瓜嗜酸菌菌株XJ-1为靶标菌,将其活化后制成菌悬液均匀涂布于KB平板上,再在平板上均匀点种拮抗菌,28 ℃培养,24 h后进行观察,测量并记录抑菌圈直径。然后将具有拮抗效果的菌株进行5次继代培养,选择拮抗效果稳定的菌株进行研究。
1.4 离体叶片测定防效
从实验室盆栽的甜瓜幼苗上取第一片真叶,分别浸没在拮抗菌(供试菌株BW-6、BYP-28、NG-29)菌悬液(菌液浓度为108cfu/mL)中1 min,晾干至表面无水珠,然后将西瓜嗜酸菌菌悬液(菌液浓度为108cfu/mL)均匀喷于处理叶片正、背面,置于灭菌的水琼胶平板上,26 ℃保湿,观察发病情况。以只接种西瓜嗜酸菌的叶片和只喷KB培养液的叶片为对照。每处理各5片叶,3次重复。
1.5 盆栽测定防效
经拮抗性筛选和离体叶片测定,将效果较好的菌株通过盆栽试验进一步测定其稳定性和防病效果。当甜瓜苗长至2~3片真叶时,将拮抗性较好的菌株菌悬液(菌液浓度为108cfu/mL)分别喷施到真叶上,晾干后喷雾法接种西瓜嗜酸菌(菌液浓度为108cfu/mL)于叶片正、背面, 30 ℃下连续保湿24 h后常规管理,观察发病情况,调查病情指数,计算防治效果。本试验供试拮抗菌菌株BW-6、BYP-28、NG-29,以只接种西瓜嗜酸菌和只喷KB培养液的处理为对照。每处理3次重复,每重复15株。反复验证3次。
1.6 拮抗菌株在甜瓜叶面上定殖情况的测定
将防病效果最好且稳定的BW-6菌株用于在甜瓜叶面定殖情况的测定。选择硫酸链霉素作为菌株BW-6抗性标记药剂,把BW-6在KB培养基上画线活化,挑取单菌落转入含硫酸链霉素 5 μg/mL的 KB液体培养基中,于28 ℃、150 r/min 振荡培养24 h,然后在含硫酸链霉素 5 μg/mL 的KB培养基平板上画线培养,待长出单菌落后挑取其转入下一个梯度浓度中,依次经过含10、20、40、80、160、200 μg/mL硫酸链霉素的KB培养基进行抗性筛选,直至筛选出在含有200 μg/mL硫酸链霉素的KB培养基上能够生长、拮抗性以及菌落形态不变的BW-6抗性标记菌株。
将该抗性标记菌株接种于盛有100 mL KB培养液的三角瓶内,加终浓度为200 μg/mL的硫酸链霉素,28 ℃下振荡培养48 h,用无菌水制成108cfu/mL的菌悬液,喷雾于甜瓜叶片,处理20株,以喷KB培养液的处理作对照。自处理后至15 d,每天取样测定。测定方法是称取1 g叶片放入无菌研钵中研碎,定容至10 mL,然后梯度稀释至102、103、104、105、106、107、108、109倍,各浓度分别用移液枪移取100 μL均匀涂布在加有终浓度为200 μg/mL的硫酸链霉素的KB平板上,28 ℃下培养48 h后,统计各平板上能够生长、菌落形态不变的BW-6菌落数量,计算菌株BW-6的定殖数量。
1.7 菌株BW-6的鉴定
1.7.1 形态学和生理生化鉴定
将菌株BW-6在KB平板上于28 ℃培养24 h,观察其菌落形态,并参照东秀珠等《常见细菌系统鉴定手册》[5]的方法进行革兰氏染色,显微镜下观察其菌体形态。
参照《常见细菌系统鉴定手册》[5],对菌株BW-6进行荧光反应、V-P测定、接触酶、硝酸盐还原、明胶液化、淀粉水解、柠檬酸的利用、丙二酸钠的利用、甲基红试验、葡萄糖产酸、耐盐性等生理生化试验。
1.7.2 分子生物学鉴定
菌株BW-6采用CTAB法[6]提取其总基因组。
菌株BW-6的16S rDNA PCR扩增体系、方法及所使用的27F和1 492 r通用引物序为:27F:5′-AGAGTATTGATCATGGCTCAG-3′与1 492 r:5′-TACGGTTCCTTGTTACGACTT-3′。PCR反应体系:DNA(70 ng/μL)模板2 μL;dNTP Mixture(2.5 mmol/L)3.5 μL;27F(20 μmol/L)1.0 μL;1 492 r(20 μmol/L)1.0 μL;10×Buffer(Mg2+plus)5 μL;TaqDNA 聚合酶0.5 μL;补足ddH2O 到50 μL。PCR 条件为:94 ℃预变性5 min;然后94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸2.0 min,共35个循环;最后72 ℃延伸10 min。用1 %琼脂糖凝胶电泳检测扩增产物。
PCR产物测序工作由上海英骏生物技术有限公司完成。所测序列递交GenBank数据库,使用NCBI数据库的Blast程序进行相似性比较。由GenBank中得到相关菌株的序列,与本文所测得序列一起输入MEGA 5.0软件,以Neighbor-Joining(NJ)法构建系统发育树。
2 结果分析
2.1 拮抗菌的分离及筛选
从采集的97个土样中共分离得到2 945株细菌,初筛127株有抑菌效果,经过5次继代培养,19株有抑菌作用,其中8株细菌的抑菌效果较好,结果见表1。
表18株拮抗菌对西瓜嗜酸菌的抑制效果
Table1Inhibitoryeffectsof8strainsonAcidovoraxcitrulli
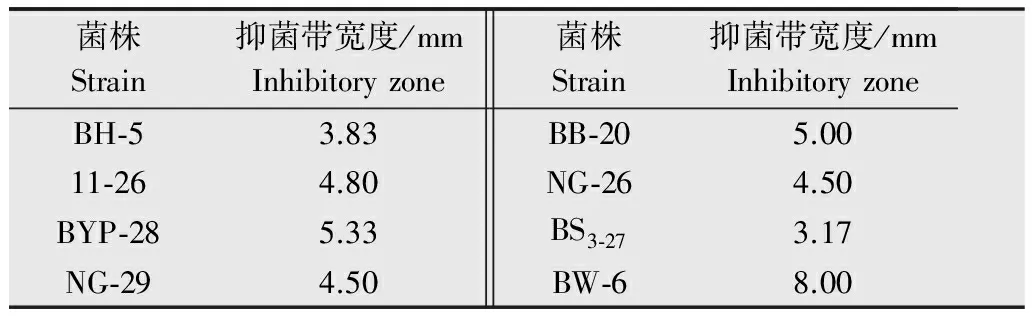
菌株Strain抑菌带宽度/mmInhibitoryzoneBH⁃53.8311⁃264.80BYP⁃285.33NG⁃294.50菌株Strain抑菌带宽度/mmInhibitoryzoneBB⁃205.00NG⁃264.50BS3⁃273.17BW⁃68.00
2.2 离体叶片上的防效
观察在离体叶片的测定结果,各拮抗菌株对甜瓜果斑病的生防效果有差异,其中菌株BW-6、BYP-28、NG-29生防效果较好,如图1所示,上排为未喷拮抗菌对照,下排为喷施拮抗菌处理。菌株NG-26、BS3-27的效果较差。菌株BH-5和11-26对叶片组织表现明显的毒害作用。
暴雨雨日最多发生在夏季,2001—2016年间有47 d的暴雨发生在夏季,占总数的70.1%,其中70 mm以上暴雨雨日19 d,100 mm以上暴雨雨日6 d,春季和秋季次之,分别为11 d、占比16.4%和8 d、占比11.9%,冬季最少仅有1 d,仅占1.5%(图3)。

图1 3株拮抗菌对甜瓜果斑病离体叶片防治效果Fig.1 Inhibitory effects of 3 strains on detached leaves of sweet melon against Acidovorax citrulli
2.3 盆栽条件下的防效
室内盆栽条件下测定BW-6、BYP-28、NG-29菌株对甜瓜细菌性果斑病防治效果表明,用BW-6、BYP-28、NG-29菌株处理后对果斑病的防效分别为80.3%、66.7%、72.9%(表2)。只接种病原菌XJ-1的处理在连续保湿3 d后即发病,而经NG-29、BYP-28菌株处理的在连续保湿5 d后轻微发病,经BW-6菌株处理的在连续保湿7 d时才轻微发病。3次重复试验结果表明,BW-6菌株的防治效果最好、最稳定。
表23株拮抗菌在盆栽条件下对甜瓜苗病情指数的影响1)
Table2Effectsof3antagonisticbacterialstrainsonthediseaseindexofsweetmelon
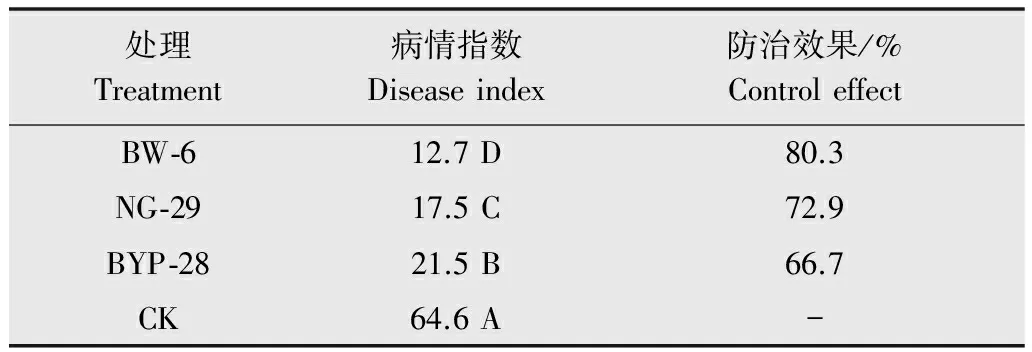
处理Treatment病情指数Diseaseindex防治效果/%ControleffectBW⁃612.7D80.3NG⁃2917.5C72.9BYP⁃2821.5B66.7CK64.6A-
1) A、B、C、D代表在0.01水平上显著差异。 A, B, C and D indicate highly significant difference (P<0.01).
2.4 拮抗菌株在甜瓜叶面上的定殖
室外测定BW-6菌株在甜瓜叶面上的定殖能力,结果见图2。在接种后14 d内,种群数量整体有下降趋势。在接种第3~4天时,BW-6菌株在甜瓜叶片上的生长菌量达到最大,之后呈现下降趋势,直到第14天时叶面上的生长菌量已经非常小,降至1.0×102cfu/mL。

图2 BW-6菌株在甜瓜叶面上的种群动态变化Fig.2 Dynamics of the strain BW-6 on the leaf surface of sweet melon under field condition
2.5 鉴定结果
2.5.1 形态特征和生理生化特性
菌株BW-6在KB固体培养基上菌落白色不透明,边缘不整齐,表面粗糙,革兰氏阳性;细胞直杆状,(0.6~0.8)μm×(2~3)μm;芽胞柱状,大小(0.5~0.7)μm×(1.0~1.5)μm,位于菌体中央或者稍偏一端,芽胞形成后菌体不膨大(见图3)。
表3菌株BW-6生理生化特征
Table3PhysiologicalandbiochemicalcharacteristicsofstrainBW-6

测定项目Itemtested菌株BW⁃6StrainBW⁃6对照菌株BacillussubtilisControlstrain革兰氏染色Gramstain++荧光反应Fluorescencereaction--V⁃P测定(V⁃Ptest)++接触酶Catalase++硝酸盐还原Nitratereduction++明胶液化Gelatinliquefaction++淀粉水解Amylolysis++柠檬酸的利用Utilizationofcitricacid++丙二酸钠的利用Utilizationofmalonicacidsodium--甲基红试验Methylredtest++产酸:葡萄糖Fermentationofglucoseandacidproduction++2%NaCl++5%NaCl++4℃生长Growthat4℃--30℃生长Growthat30℃++50℃生长Growthat50℃++
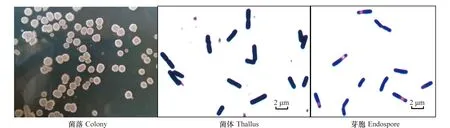
图3 BW-6菌株形态特征Fig.3 The morphology of strain BW-6
2.5.2 菌株BW-6的分子生物学鉴定
以菌株BW-6的总基因组为模板利用27F、1 492 r 引物对其进行扩增,PCR扩增产物进行凝胶电泳分析,得到一条清晰明亮的条带,长约为1 500 bp。经比对结果表明:得到菌株BW-6的16S rDNA核酸序列与枯草芽胞杆菌[Bacillussubtilis(Ehrenberg) Cohn]的相似性最高,为99.00%。根据16S rDNA序列对菌株BW-6及相近菌株进行系统发育分析,结果表明菌株BW-6与枯草芽胞杆菌的亲缘关系最近(图4)。结合BW-6的菌体形态、革兰氏染色反应、培养性状、生理生化测定结果,得出菌株BW-6为枯草芽胞杆菌(B.subtilis)。

图4 菌株BW-6 16S rDNA 系统发育树Fig.4 Phylogenetic tree based on 16S rDNA sequences of strain BW-6 and its relatives
3 讨论
近些年,植物病害化学防治伴随着环境污染、农药残留,病原菌产生抗药性等问题,给生产带来诸多不便,故利用生防菌及其所产生的抑菌物质进行病害防治成为当前国内外研究和应用的热点。国内在病害生物防治研究方面已有很多报道,如李宝庆等[7]用枯草芽胞杆菌防治番茄灰霉病,薛东红等[8]筛选出对黄瓜枯萎病有强烈抑制作用的蜡状芽胞杆菌,但枯草芽胞杆菌防治瓜类果斑病的研究在国内还未见报道。
本研究经过筛选,枯草芽胞杆菌BW-6菌株在固体平板上抑菌带宽达到8 mm,盆栽防效为80.3%,且防治效果稳定。该菌株在甜瓜叶片上易定殖,叶片上的菌量能在较短时间内迅速上升,为以后在田间甜瓜叶片上喷施应用奠定了基础。由于室内和田间的气候、环境条件不同,且田间环境比较复杂,该菌株施用于田间后能否稳定、持久地发挥其抑菌防病作用仍需进一步研究。另外,要进一步优化培养条件,促进其更加有效地抑制西瓜嗜酸菌,同时对西瓜嗜酸菌的抑制机理,需要具体研究。枯草芽胞杆菌能够产生耐热、抗紫外线和有机溶剂的芽胞[9-10],其芽胞可以制成粉剂、可湿性粉剂等剂型用于田间使用或与部分化学农药混用而并不丧失其抑菌活性[11],且对人畜安全,不会造成环境污染,具有成为有效生防菌剂的潜力。
[1] 王晓东.防治哈密瓜细菌性果斑病拮抗酵母菌的筛选及其生防机理研究[D].武汉:华中农业大学,2009.
[2] 周洪友,杨静,宋娟.荧光假单胞工程菌株对甜瓜细菌性果斑病的生物防治[J].中国植保导刊,2009,29(1):9-12.
[3] 蔡学清,鄢凤娇,林玉,等.西瓜细菌性果斑病拮抗内生细菌的分离和筛选[J].福建农林大学学报,2009,38(5):465-470.
[4] 方中达.植病研究方法[M].第三版.北京:中国农业出版社,1996:132-133.
[5] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
[6] Del Sal G, Manfioletti G, Schneider C.A one tube plasmid DNA mini preparation suitable for sequencing[J].Nucleic Acids Research,1988,16:78-98.
[7] 李宝庆,鹿秀云,郭庆港,等.枯草芽胞杆菌BAB-1产脂肪类及挥发性物质的分离和鉴定[J].中国农业科学,2010,43(17):3547-3554.
[8] 薛东红,刘训理,陈凯,等.一株植物病原真菌拮抗细菌的分离与鉴定[J].山东农业大学学报,2006,37(1):1-5.
[9] Obagwu J, Korsten L.Integrated control of citrus green and blue molds usingBacillussubtilisin combination with sodium bicarbonate or hot water[J].Postharvest Biology and Technology,2003,28(1):187-194.
[10]Elizabeth A B E, Handelsman J O.Biocontrol of plant disease: a (Gram-) positive perspective[J].FEMS Microbiology Letters,1999,171:1-9.
[11]Turner J T, Backman P A.Factors relating to peanut yield increases after seed treatment withBacillussubtilis[J].Plant Disease,1991,5(4):347-353.
Isolationandidentificationofbio-controlbacterialstrainBW-6againstbacterialfruitblotchofsweetmelon
Wu Liyuan1,Liu Baoyu2,Wang Yujie2,Liu Shuangping2,Zhao Tingchang3,Hu Jun1
(1.CollegeofAgriculture,AgriculturalUniversityofInnerMongolia,Hohhot010019,China;2.BayannurCityStationofPlantProtection,InnerMongolia,Linhe015000,China;3.InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
Bacterial fruit blotch of sweet melon, caused byAcidovoraxcitrulli, is a devastating bacterial disease.Nineteen strains with highly antagonistic activity were isolated from 97 soil samples using dilution plate and dual culture method.In this study,A.citrulliwas an indicator.Strain BW-6 showed high and stable antagonistic effect both on detached leaves and pot experiment, and its control efficiency was 80.3%.Experiment on leaves of sweet melon indicated that strain BW-6 was able to colonize on leaves, but the quantity of bacteria tended to drop off over time.Strain BW-6 was identified asBacillussubtilisby its morphological, physiological and biochemical characteristics and 16S rDNA sequence analysis.
sweet melon; bacterial fruit blotch; biological control;Bacillussubtilis
2013-04-09
: 2013-06-07
公益性行业(农业)科研专项(201003066)
S 476
: ADOI: 10.3969/j.issn.0529-1542.2014.01.007
* 通信作者 E-mail:hujun6202@126.com
