顶空气相色谱法检测纸浆中羰基含量的研究
2014-08-10宋燕婷胡会超柴欣生
宋燕婷 胡会超 柴欣生,3,*
(1.华南理工大学制浆造纸工程国家重点实验室,广东广州,510640;2.福建农林大学,福建福州,350002;3.国家纸制品质量监督检验中心,广东东莞,523080)
在纸浆漂白过程中,纤维素会被氧化生成羰基基团[1]。由于羰基基团影响纤维素链的稳定性[2]而使其容易发生断裂,导致纸浆以及后续纸制品的各种物理强度性能下降[3]。同时,纸浆中的羰基基团也会影响纸张老化、返黄[4-5]。因此,深入研究纸浆羰基的生成规律,特别是漂白工艺对其生成的影响,对于优化工艺参数,改善和提高产品质量,具有重要的指导意义。显然,快速、准确的羰基检测方法在该研究中是不可缺少的。
传统的羰基基团检测方法是通过化学反应将该基团转化成其他结构形式 (如以氰化物与羰基反应生成氰醇基团[6]或以羟胺为反应剂的肟化反应[7]),然后以光谱法或气体测定法间接检测出纸浆中的羰基基团含量[8-9]。传统方法通常具有实验操作步骤复杂、繁琐,样品处理时间较长的缺点。尽管一些现代仪器的检测手段,如红外光谱、紫外光谱、核磁共振均可应用于纸浆中羰基基团的分析[10],但由于纸浆中羰基基团的含量较低 (以μmol/g计)以及纸浆中其他基团的干扰,对其进行准确的定量检测非常困难。为此,Rohrling等人[2]采用荧光剂标记纤维素上的羰基基团,并以凝胶渗透色谱、红外光谱、多角激光散射系统相结合的手段,提高羰基检测的专一性从而实现检测纸浆中羰基基团含量。但该方法仪器昂贵、运行和维护成本高,另外还需要复杂的样品处理步骤。
基于顶空分析的气相色谱法可以有效地消除样品中非挥发性物质对色谱仪器的损害,是一种特别适合工业样品分析的手段[11]。在前期的工作中,笔者工作组开发了一些基于化学反应的顶空分析方法,即将非挥发的成分转化为挥发性物质,实现对样品中草酸根[12]、过氧化氢[13]、羧酸基团[14]、细菌含量[15]等的间接检测。很显然,基于合适的化学反应,顶空气相色谱可以实现对纸浆中羰基含量的间接检测。
本实验中,笔者工作组开发了一种基于NaBH4为反应试剂、通过用顶空气相色谱 (HS-GC)测定H2来间接测定纸浆中羰基基团含量的方法。该方法以一定量的NaBH4与纸浆在一定条件下反应,重点研究了反应条件 (NaBH4用量、反应温度和反应时间)的选择和优化。并对该方法的重现性和准确性进行了评价。
1 实验
1.1 化学试剂和样品
NaOH、NaBH4、葡萄糖、H2SO4等均为分析纯,实验用水为去离子水。其中,NaBH4溶液、葡萄糖溶液配制时全部以0.1 mo/L NaOH溶液作为溶剂;泰国进口短纤维浆板。
1.2 仪器和操作
顶空自动进样器 (DANI HS 86.50,Italy);带有热电导检测器 (TCD)的气相色谱仪 (Agilent 83 HP-7890,Palo Alto,CA,USA),色谱柱型号J& W Scientific,Folsom,CA.,内径φ=0.53 mm,长度L=30 m;HH-4数显恒温水浴锅;KQ5200超声仪;Sartorius BSA-124SCW,Germany分析天平;101-1电热鼓风干燥箱。
顶空进样器操作条件:平衡温度40℃,样品平衡时间10 min,顶空样品瓶中载气平衡时间12 s,管路充气时间12 s,管路平衡时间3 s,环路平衡时间12 s。
顶空气相色谱 (HS-GC)操作条件:色谱柱温度为 30℃;氮气 (流量 3.1 mL/min)作为载气;TCD检测器温度200℃。
1.3 样品制备过程
称取一定质量的绝干浆板,加入一定量的体积浓度0.1 mol/L NaOH溶液,并用高速打散器打散10 min,制成浆浓为2%的纸浆悬浮液;将打散杯打开、置于电动搅拌器下,并以一定的搅拌速度对纸浆悬浮液进行搅拌,漩涡深度约为液面总高度的1/2。使用移液枪 (枪头顶端切开5 mm的口径)准确量取12 mL纸浆悬浮液到顶空瓶 (21 mL)中,超声2 min后、加入1 mL NaBH4溶液 (0.5 g/L),采用氮气排空气30 s后封盖;在90℃水浴锅中反应3 h后,取出顶空样品瓶并冷却到室温,然后用注射器注入1 mL H2SO4溶液 (0.8 mol/L),摇匀再超声2 min。最后,顶空样品瓶放置于顶空自动进样器中 (炉箱温度40℃,平衡时间10 min)进行HS-GC检测。
2 结果与讨论
2.1 反应条件对NaBH4转化的影响
该方法的检测原理:一定量的NaBH4和纸浆中的羰基基团在碱性介质中反应 (见式 (1)),未参与反应的NaBH4在加热、中性或酸性条件下分解转化成H2,通过定量检测H2(见式 (2)),从而间接检测出纸浆中的羰基基团含量。考察的反应条件包括:未反应的NaBH4降解为H2所需H2SO4的量,以及NaBH4用量、反应温度、反应时间。
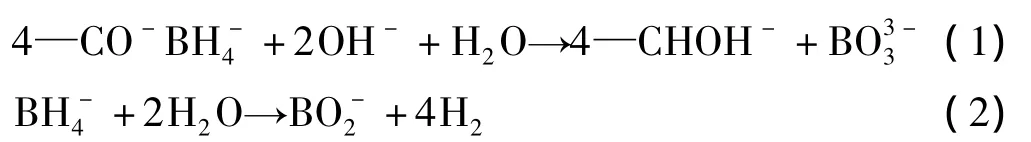
2.1.1 H2SO4摩尔浓度对NaBH4分解的影响
NaBH4在碱性条件下能稳定存在,加入H2SO4中和溶液中的NaOH后,NaBH4发生分解转化为H2。图1为H2SO4摩尔浓度对NaBH4分解的影响。由图1可知,NaBH4的分解程度随H2SO4摩尔浓度的增加而升高;当H2SO4摩尔浓度为0.2 mol/L时,NaBH4溶液中的NaOH全部被中和,此时顶空瓶中的NaBH4亦完全转化为 H2。这说明,当溶液呈中性时,NaBH4即可在顶空进样器的平衡过程中 (40℃,10 min)完全转化为H2;在接下来的实验中,将1 mL 0.8 mol/L H2SO4加入到含有13 mL 0.1 mol/L NaOH反应完的样品瓶中,即可完全中和体系中的NaOH,确保未参与反应的NaBH4全部转化为H2。
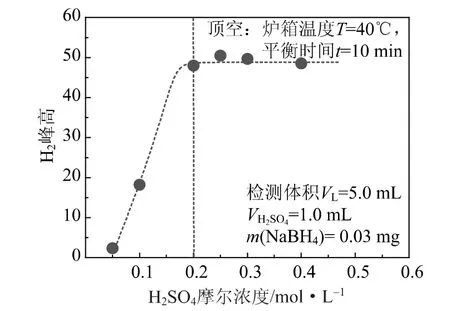
图1 H2SO4摩尔浓度对NaBH4分解的影响
2.1.2 反应温度和时间对葡萄糖与NaBH4反应的影响
葡萄糖分子是含有一个羰基基团的单糖,过量的NaBH4在碱性加热条件下可将葡萄糖分子还原,见式(3)。
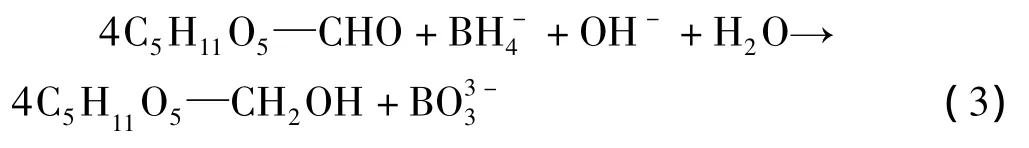
同时,体系中的NaBH4在受热条件下发生分解转化成H2;而未反应的NaBH4在加入H2SO4后则完全降解生成H2。因此,本实验中选取葡糖糖作为标准物质。
在相同葡萄糖与NaBH4加入量的条件下,考察反应温度和反应时间对葡萄糖上醛基还原率的影响,结果如图2所示。由图2(a)可知,反应温度达到75℃以后产生H2的信号不再降低,这说明在75℃下反应4 h即可将葡萄糖完全还原。为加速反应、提高检测效率,后续反应选择90℃为反应温度,见图2(b)。由图2(b)可知,当反应温度为90℃时,反应60 min后葡萄糖与NaBH4可完全反应。
2.1.3 反应温度和时间对纸浆羰基基团与NaBH4反应的影响

图2 反应温度和反应时间对葡萄糖与NaBH4反应的影响

图3 反应温度和反应时间对纸浆羰基基团与NaBH4反应的影响
取一定量NaBH4与纸浆反应,考察反应温度和反应时间对纸浆中羰基基团还原程度的影响,结果如图3所示。由图3(a)可知,随着反应时间的增加产生H2的信号降低;当反应时间为120 min时,纸浆中的羰基基团已被完全反应。由图3(b)可知,随着反应温度的升高H2信号值逐渐降低;当反应温度达到80℃时,纸浆中的羰基基团已被反应完全,而且随着反应温度的升高,产生H2的信号保持不变;这说明反应过程中没有新的羰基生成,即纸浆未发生降解。因此,为了保证反应的完全,本实验选取反应温度和反应时间分别为90℃和180 min。
2.1.4 NaBH4用量对纸浆中羰基基团含量的影响
NaBH4与纸浆中羰基基团反应的同时,NaBH4在受热条件下发生分解而转化成H2。将没有加入纸浆时一定量的NaBH4完全分解成H2的信号值,减去相同量的NaBH4与一定量纸浆中羰基基团反应后所产生的H2信号值,结果如图4所示。由图4可知,当NaBH4的加入体积为0.9 mL时,可将纸浆中的羰基基团反应完全。鉴于此,本实验将NaBH4的用量定为0.5 mg,即0.5 g/L的NaBH4加入体积为1 mL。对于羰基含量高于100 μmol/g的纸浆,建议采取更低的纸浆加入量(如浓度为2%的纸浆悬浮液加入1~5 mL)。
2.2 方法的精确度和准确度校正
方法的校正是通过一定量的NaBH4溶液与不同体积的标准葡萄糖溶液反应后,未参与反应的NaBH4在一定条件下完全转化成H2,然后检测H2信号得到标准曲线 (见式4)。
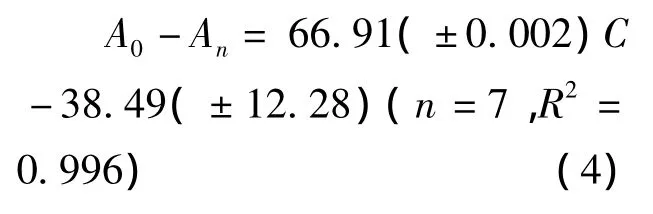
式中,A0和An分别代表未加葡萄糖和加入葡萄糖反应之后所产生的H2信号值;C为标准葡萄糖溶液的摩尔量,μmol。
方法的定量检测极限(LOQ) 是 1.26 μmol,可 通 过式 (5)计算。
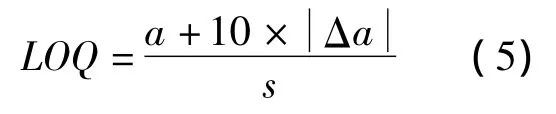
式中,a、Δa、s分别代表式 (4)的截距、截距误差和斜率。
纸浆中羰基基团的含量

图4 NaBH4用量对纸浆中羰基基团反应的影响
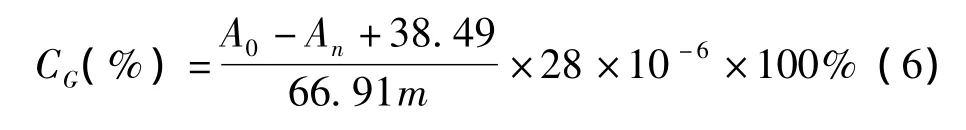
式中,m表示顶空样品瓶中纸浆的质量,g;28为羰基的分子质量,g/mol。
用该方法检测5次纸浆样品中的羰基基团含量,得到结果的重现性相对标准偏差小于1.0%。
为了证实本方法的可行性,添加标准葡萄糖溶液(1~6 μmol)于纸浆样品瓶中按照上述样品制备过程制得一组样品检测,其中每个样品含有5 mL浆浓为2%的纸浆悬浮液,1 mL NaBH4溶液 (0.5 g/L)及1 mL H2SO4溶液 (0.8 mol/L)。以未添加纸浆悬浮液的一组标准葡萄糖溶液和NaBH4的反应作为空白对照。通过标准加入法加入葡萄糖得到的净吸收值可通过式 (6)计算得到。标准葡萄糖的加标回收率见表1。由表1可知,加标葡萄糖的回收率范围为97%~105%,证明了该方法的实用性。(CG)可通过式 (6)计算。
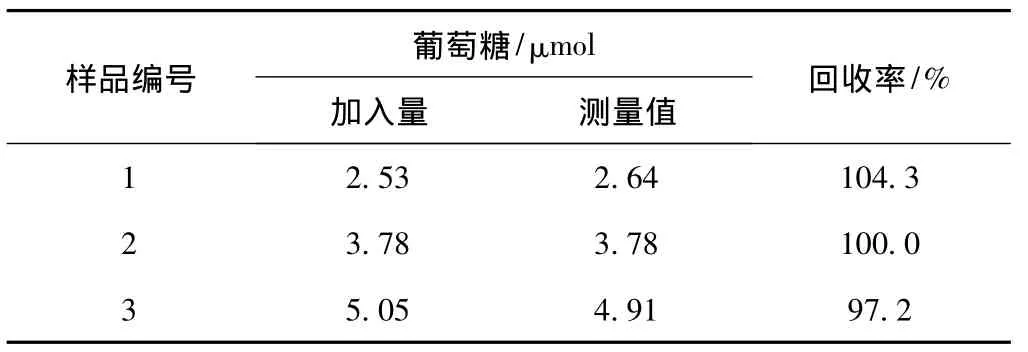
表1 加标回收率
3 结论
实验建立了一种测定纸浆中羰基基团的新方法,即以特定量的NaBH4与纸浆中的羰基基团反应,利用顶空气相色谱 (HS-GC)法检测未参与反应的NaBH4转化成H2的含量实现对纸浆中羰基基团含量的测定。该方法具有很高的检测灵敏度、准确度和重现性,其灵敏度检测最低定量检测限为1.26 μmol,回收率范围为97%~105%,重现性相对标准偏差小于1.0%。在纸浆中羰基基团含量的相关研究方面具有很好的应用前景。
[1] Schleicher H,Lang H.Carbonyl and Carboxyl Groups in Pulps and Cellulose Products[J].Das Papier,1994,48(12):765.
[2] Rohrling J,Potthast A,Rosenau T,et al.A Novel Method for the Determination of Carbonyl Groups in Cellulosics by Fluorescence Labeling.1.Method development[J].Biomacromolecules,2002,3(5):959.
[3] Antje Potthast,Thomas Rosenau,Paul Kosma,et al.On the Nature of Carbonyl Groups in Cellulosic Pulps[J].Cellulose,2005,12(1):43.
[4] Lewin M.Oxidation and Aging of Cellulose[J].Macromol.Symp.,1997,118(1):715.
[5] Chirat C,Lachennal D.Effect of Ozone on Pulp Component.Application to Bleaching of Kraft Pulps[J].Holzforschung,1994,48(s1):133.
[6] Lewin M,Epstein J A.Functional Groups and Degradation of Cotton Oxidized by Hypochlorite[J].Polymer Chemistry,1962,58(166):1023.
[7] Oskar F,Bruno A,Girt Z.Determination of Carbonyl Groups of Six Round Robin Lignins by Modified Oximation and FTIR Spectroscopy[J].Holzfotschung,1998,52(3):268.
[8] Rhrling J,Potthast A,Rosenau T,et al.Synthesis and Testing of a Novel Fluorescence Label for Carbonyls in Carbohydrates and Cellulosics[J].Synlett,2001(5):682.
[9] Rhrling J,Potthast A,Rosenau T,et al.A Novel Method for the Determination of Carbonyl Groups in Cellulosics by Fluorescence Labeling.2.Validation and Applications[J].Biomacromolecules,2003,3(5):969.
[10] Loureiro P,Fernandes A,Carvalho M,et al.The Assessment of Chromophores in Bleached Cellulosic Pulps Employing UV-Raman Spectroscopy[J].Carbohydrate Research,2010,345(10):1442.
[11] Zhu J Y,Chai X S.Some Recent Developments in Headspace Gas Chromatography [J].Current Analytical Chemistry,2005,1(1):79.
[12] Hu H C,Jin H J,Chai X S.A Practical Headspace Gas Chromatographic Method for the Determination of Oxalate in Bleaching Effluents[J].Journal of Industrial and Engineering Chemistry,2014,20(1):13.
[13] Hu H C,Jin H J,Chai X S.Rapid Determination of Hydrogen Peroxide in Pulp Bleaching Effluents by Headspace Gas Chromatography[J].Journal of Chromatography A,2012,1235:182.
[14] Chai X S,Hou Q X,Zhu J Y,et al.Carboxyl groups in wood fibers.1.Determination of carboxyl groups by headspace gas chromatography[J].Industrial& Engineering Chemistry Research,2003,42(22):5440.
[15] Chai X S,Dong C X,Deng Y L.In Situ Determination of Bacterial Growth by Multiple Headspace Extraction Gas Chromatography[J].Analytical Chemistry,2008,80(20):7820. CPP
