持续静脉-静脉血液滤过治疗12例婴幼儿先天性心脏病术后急性肾功能衰竭预后的回顾性分析
2014-08-10符跃强刘成军王文磊
符跃强 刘成军 白 科 李 静 胡 兰 王文磊 周 昉
·论著·
持续静脉-静脉血液滤过治疗12例婴幼儿先天性心脏病术后急性肾功能衰竭预后的回顾性分析
符跃强 刘成军 白 科 李 静 胡 兰 王文磊 周 昉
目的 探讨持续静脉-静脉血液滤过(CVVH)在救治婴幼儿先天性心脏病术后急性肾功能衰竭的疗效和预后。方法 回顾性分析2013年1月至2014年8月于重庆医科大学附属儿童医院经体外循环心脏直视术后发生急性肾功能衰竭进行CVVH治疗的12例婴幼儿临床资料,比较CVVH治疗前后尿量、BUN、SCr、PLT、平均动脉压和血管活性药物使用情况及患儿预后。结果 12例患儿年龄1~24月龄,平均(8.8±6.5)月龄;体重3.5~9.5 kg,平均(6.6±1.9)kg。11例先经腹膜透析治疗,后改为CVVH治疗;1例术后出现腹膜炎,直接行CVVH治疗。①12例行CVVH治疗血流量为15~35 mL·min-1,置换液流量为4~10 mL·min-1。12例均采用肝素抗凝。②经过CVVH治疗后7/12例肾功能和尿量均恢复正常,CVVH治疗前后平均BUN分别为(17.8±8.1)和(5.5±2.2)mmol·L-1(P=0.001),平均SCr分别为(169.6±38.2)和(81.4±25.1)μmol·L-1(P=0.000),正性肌力药物评分分别为(20.3±8.5)和(19.9±12.0)(P=0.858),平均动脉压分别为(59.0±16.2)和(55.2±12.4)mmHg(P=0.273)。PLT在CVVH治疗后[35.0(21.2~83.7)×109·L-1]较治疗前[147.8(100.2~214.2)×109·L-1]明显下降(P=0.001),3例在CVVH治疗后因PLT低,出现了消化道或呼吸道出血。③7/12例(58.3%)死亡。死亡患儿正性肌力药物评分明显高于存活患儿,平均动脉压明显低于存活患儿,差异均有统计学意义(P均<0.05)。结论 对于先天性心脏病术后发生急性肾功能衰竭的婴幼儿,可采用CVVH进行肾脏替代治疗以减轻液体过负荷、改善肾功能,CVVH治疗前正性肌力药物使用强度及平均动脉压可能是影响患儿预后的重要因素,CVVH治疗时需警惕PLT降低。
血液滤过; 先天性心脏病; 婴幼儿; 急性肾功能衰竭
经体外循环手术治疗先天性心脏病(先心病)的患儿术后可出现急性肾功能衰竭,常提示不良的临床预后[1]。腹膜透析(PD)不需血管通路,对血流动力学影响小,能有效减轻液体过负荷,缓慢地清除SCr和BUN[2],是治疗婴幼儿先心病术后急性肾功能衰竭的优先选择[3]。但当存在腹膜炎、PD管堵塞、腹腔感染无法进行PD及PD治疗无效时必须采用持续血液净化治疗。有研究显示约4.9%的先心病术后患儿需要进行持续性肾脏替代治疗(CRRT)[4]。对于无法进行PD或PD治疗效果差的先心病术后急性肾功能衰竭的婴幼儿,若不采取CRRT治疗减轻液体过负荷和改善肾功能,死亡将不可避免。一项多中心临床研究表明与体重>10 kg的患儿相比,在体重≤10 kg的患儿中进行CRRT治疗的难度更大,病死率更高(57%vs36%,P<0.001)[5]。近年来CRRT广泛开展,但因低体重婴幼儿血管管径细小,建立血管通路困难,且血流动力学易受影响,目前在低体重婴幼儿中进行CRRT治疗仍受限。本研究回顾性收集12例先心病术后发生急性肾功能衰竭进行持续静脉-血液滤过(CVVH)治疗的婴幼儿的临床资料,探讨CVVH救治婴幼儿先心病术后急性肾功能衰竭的疗效和预后。
1 方法
1.1 急性肾功能衰竭诊断标准 SCr>106.8 μmol·L-1和(或)在液体治疗、利尿剂及血管活性药物作用下尿量<0.5 mL·kg-1·h-1并持续>4 h[6,7]。
1.2 PD或CVVH治疗的指征 存在急性肾功能衰竭时即给予PD治疗。治疗中出现PD管堵管、腹壁穿孔处大量渗漏、PD液出量明显小于入量、治疗12 h后SCr仍增高时停止PD治疗改用CVVH治疗;对于无法进行PD治疗者(如合并腹膜炎),直接采用CVVH治疗。
1.3 病例纳入标准 ①重庆医科大学附属儿童医院(我院)经体外循环(CPB)心脏直视手术的连续先心病病例;②术后出现急性肾功能衰竭;③符合本文CVVH治疗指征。
1.4 CVVH治疗方法 采用日本旭化成公司ACH-10血液净化机、配套管路及0.3 m2滤器,治疗达20 h时更换1次滤器。参照文献[8]的方法,体重<4 kg和≥4 kg者分别采用ARROW公司4F双侧股静脉单腔管置管和5F双腔管股静脉置管。置换液采用改良Ports方案,后稀释方式,均采用肝素抗凝,首剂肝素量为0.25~0.4 mg·kg-1,肝素静脉维持量为0.1~0.4 mg·kg-1·h-1。采用红细胞悬液、白蛋白等预冲管路和滤器。CVVH治疗期间监测凝血功能,调整肝素用量,使活化部分凝血活酶时间(APTT)维持于正常值的1.5~2.0倍。血泵采血的流速为体重×(3~5)mL·kg-1·min-1,置换液的流速为血泵采血流速的1/5~1/3。
1.5 病例资料截取 ①一般情况:性别、年龄、体重;②临床资料:诊断、CPB时间、升主动脉阻断时间(ACC)、是否存在低心排综合征;③CVVH治疗前2~6 h和治疗后2~6 h的尿量、BUN、SCr、PLT计数、平均动脉压和正性肌力药物评分。正性肌力药物评分值=多巴胺(μg·kg-1·min-1)+米力侬(μg·kg-1·min-1)×10+肾上腺素(μg·kg-1·min-1)×100[9];④预后:存活或死亡。
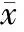
2 结果
2.1 一般情况 2013年1月至2014年8月符合本文纳入标准的先心病术后急性肾功能衰竭并行CVVH治疗的12例患儿纳入分析。年龄1~24月龄,平均(8.8±6.5)月龄;体重3.5~9.5 kg,平均(6.6±1.9)kg。11例首先经PD治疗,治疗中出现PD管堵管4例,腹壁穿孔处大量渗漏3例,PD液出量明显小于入量2例,SCr仍进行性增高2例,均停止PD治疗改为CVVH治疗;1例肺动脉吊带患儿术后出现腹膜炎,直接行CVVH治疗。所有患儿CVVH治疗期间均需机械通气。患儿年龄、体重、诊断、CPB时间、ACC、是否存在低心排综合征、正性肌力药物评分及预后等情况如表1所示。
2.2 CVVH治疗前后观察指标比较 12例进行CVVH治疗血流量为15~35 mL·min-1,置换液流量为4~10 mL·min-1。12例均采用肝素抗凝,例5因凝血功能差,未使用首剂肝素。
表1显示,经过CVVH治疗后7/12例肾功能和尿量均恢复正常,12例CVVH治疗前后平均BUN为(17.8±8.1)和(5.5±2.2)mmol·L-1(P=0.001);CVVH治疗前后平均SCr为(169.6±38.2)和(81.4±25.1)μmol·L-1(P=0.000);PLT计数在CVVH治疗后[35.0(21.2~83.7)×109·L-1]较治疗前[147.8(100.2~214.2)×109·L-1]明显下降(P=0.001),例5、6和11在CVVH治疗后因PLT低,出现了消化道或呼吸道出血表现。所有患儿均使用了血管活性药物,5例(例1~4及8)CVVH治疗前使用多巴胺(7.5~10 μg·kg-1·min-1)和米力农(0.5~0.75 μg·kg-1·min-1)静脉维持 ; 6例(例5~7、9、11和12)患儿在CVVH治疗前除使用多巴胺(10 μg·kg-1·min-1)和米力农(0.75~1.0 μg·kg-1·min-1)外,还使用肾上腺素(0.05~0.1 μg·kg-1·min-1);例10仅使用米力农0.75 μg·kg-1·min-1。12例CVVH治疗前后正性肌力药物评分为(20.3±8.5)和(19.9±12.0)(P=0.858)。CVVH治疗前后平均动脉压为(59.0±16.2)和(55.2±12.4)mmHg(P=0.273)。12例CVVH治疗前后各项观察指标见表1。

2.3预后7/12例(58.3%)死亡。例4和8在CVVH治疗后BUN、SCr和尿量均恢复正常,但例4因严重肺部感染,例8因先心病术后腹膜炎所致多脏器功能衰竭,分别于CVVH治疗8和18 d后放弃治疗而死亡。5例(例5~7、9和11)心功能差存在严重低心排综合征,虽然CVVH有效降低BUN和SCr,减轻液体过负荷,但并未改善低心排综合征和增加患儿尿量,最终死亡。例5、6和11因多脏器功能衰竭加重,于CVVH治疗结束后12 h内死亡。例7和9分别于CVVH治疗结束后2和4 d因多脏器功能衰竭而死亡。
表2显示,死亡患儿正性肌力药物评分明显高于存活患儿,平均动脉压明显低于存活患儿,差异均有统计学意义(P均<0.05)。而死亡患儿和存活患儿在年龄、体重、CPB时间、乳酸、血清K+、HCO3-、BUN、SCr、先心病术后至CVVH时间和CVVH治疗后最低PLT计数指标差异均无统计学意义(P均>0.05)。

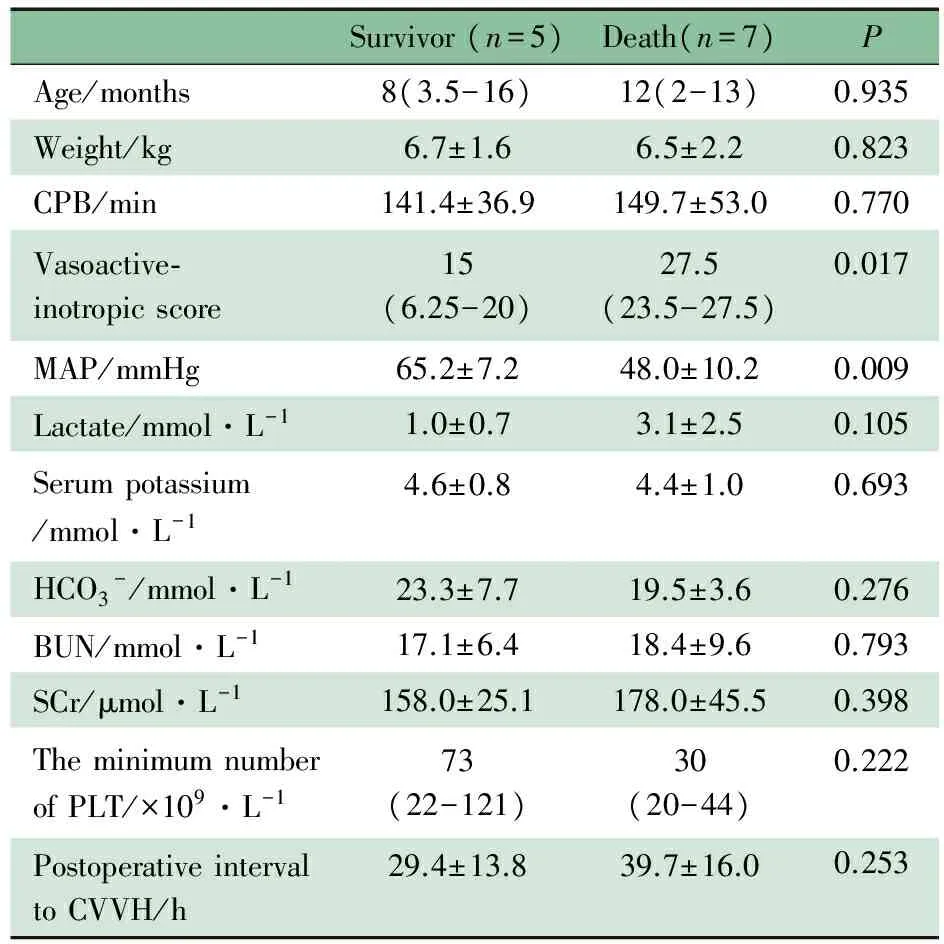
Survivor(n=5)Death(n=7)PAge/months8(3.5-16)12(2-13)0.935Weight/kg6.7±1.66.5±2.20.823CPB/min141.4±36.9149.7±53.00.770Vasoactive⁃inotropicscore15(6.25-20)27.5(23.5-27.5)0.017MAP/mmHg65.2±7.248.0±10.20.009Lactate/mmol·L-11.0±0.73.1±2.50.105Serumpotassium/mmol·L-14.6±0.84.4±1.00.693HCO3-/mmol·L-123.3±7.719.5±3.60.276BUN/mmol·L-117.1±6.418.4±9.60.793SCr/μmol·L-1158.0±25.1178.0±45.50.398TheminimumnumberofPLT/×109·L-173(22-121)30(20-44)0.222PostoperativeintervaltoCVVH/h29.4±13.839.7±16.00.253
Notes y: years; m:months; VPA: valporic acid; PB: phenobarbital; TPM: topiramate; OXC: oxcarbazepine; CBZ: carbamazepine; NZP: nitrazepam; ACTH: adreno-cortico-tropic-hormone
3 讨论
本研究12例先心病术后患儿体重均<10 kg,因PD治疗效果不佳或无法进行PD而行CVVH治疗,CVVH治疗后患儿BUN和SCr水平明显下降,水肿减轻,治疗前后平均动脉压无明显变化。7例BUN、SCr和尿量恢复正常;5例BUN和SCr水平明显下降,但尿量未恢复正常。本研究提示可应用CVVH治疗体重<10 kg的先心病术后急性肾功能衰竭婴幼儿,CVVH治疗能有效清除BUN和SCr,减轻液体过负荷,大部分患儿肾功能和尿量可恢复正常。
本研究发现CVVH治疗后患儿的PLT计数下降,其中3例出现了消化道或呼吸道出血,6例因PLT计数明显降低输注血小板。本文CVVH治疗后PLT下降在死亡和存活患儿间差异无统计学意义,但已有研究表明CVVH治疗伴随严重PLT计数下降的患者其存活率明显下降[10]。连续静脉静脉血液透析滤过(CVVHDF)是连续血液滤过联合连续血液透析的治疗模式,也是CRRT治疗中常用的一种模式。Watanabe等[11]研究发现在CVVHDF治疗期间,7例先心病术后患儿均发生了PLT计数减少,而需要血小板输注治疗。血液净化使用的滤器能导致PLT计数下降[12]。抗凝方式的改进可能有助于减少PLT计数的下降,局部枸橼酸抗凝适用于术后有出血风险的患者[13,14]。Morabito等[15]报道在心脏术后急性肾功能衰竭患者CVVH治疗时采用局部枸橼酸抗凝能有效避免PLT的消耗。对于婴幼儿先心病术后CVVH治疗时PLT的消耗应引起重视,期待将来在滤器性能、抗凝方式和操作技术等方面的改进能有效解决这一问题。
Jander等[16]采用CVVHDF治疗25例先心病术后急性肾功能衰竭患儿(体重8.4~18.0 kg),治疗后BUN和SCr水平明显下降,但病死率仍然较高(76%)。本研究结果亦提示CVVH可显著降低BUN和SCr,并增加尿量,但病死率仍高达58.3%。包括CVVH和CVVHDF在内的持续血液净化均能有效清除BUN和SCr,减轻液体负荷,但是患儿的病死率仍然很高。
本研究11例首先采用了PD治疗,因治疗效果差改为CVVH治疗,可能存在治疗时间窗的延误。成人心脏病术后急性肾功能衰竭的研究表明,早期[从术后至CVVH治疗的时间为(0.78+0.2) d]和晚期[从术后至CVVH治疗的时间为(2.55+2.2) d]进行CVVH治疗患者的病死率分别为22%和43%,提示早期积极CVVH治疗能提高心脏病术后严重急性肾功能衰竭患者的存活率[17]。本研究存活和死亡患儿术后至CVVH治疗时间分别为(29.4±13.8)和(39.7±16.0) h,存活患儿有低于死亡患儿的趋向,但差异无统计学意义(P=0.253)。CVVH治疗时间窗对预后的影响仍有待进一步深入的研究。
Jander等[16]研究发现经CVVHDF治疗的患儿主要死亡原因为低心排综合征和感染所致多脏器功能衰竭。本研究11/12例先心病术后急性肾功能衰竭患儿伴有低心排综合征、多脏器功能衰竭,经CVVH治疗7例死亡。本研究死亡患儿正性肌力药物评分高于存活患儿,而平均动脉压低于存活患儿,提示先心病术后发生严重低心排综合征是导致患儿死亡的重要原因。严重的低心排综合征可导致重要脏器灌注不良,继而发生多脏器功能衰竭,CRRT治疗能改善肾功能和减轻液体过负荷,但若心功能不能及时改善则多脏器功能衰竭无法有效遏制,导致患儿死亡。一项81例先心病术后急性肾功能衰竭患儿(58%的患儿体重<10 kg)采用持续血液净化治疗的研究,其中18例进行了体外膜肺治疗,病死率为43%[4]。成人研究发现心脏病术后发生心源性休克和急性肾功能损伤患者在高剂量[置换液速度4(5.2±7.9) mL·kg·h]或低剂量[置换液速度(18.1 ± 3.6) mL·kg·h]CVVH治疗后相应的院内病死率分别为82.2%和61.8%[18]。因此在治疗中如果能结合其他措施,设置合理的置换液速度,改善患儿心功能状态,可能会提高救治成功率。
总之,对于先心病术后发生急性肾功能衰竭而PD治疗无效或无法进行PD治疗的婴幼儿,可采用CVVH治疗来改善肾功能和减轻液体过负荷,CVVH治疗前正性肌力药物使用强度及平均动脉压是影响患儿预后的重要因素。进行CVVH治疗时必须警惕PLT计数严重减少。
[1]Blinder JJ, Goldstein SL, Lee VV, et al. Congenital heart surgery in infants: Effects of acute kidney injury on outcomes. J Thorac Cardiovasc Surg, 2012, 143(2):368-374
[2]Bonilla-Félix M. Peritoneal dialysis in the pediatric intensive care unit setting. Perit Dial Int, 2009, 29(S2):S183-185
[3]Santos CR, Branco PQ, Gaspar A, et al. Use of peritoneal dialysis after surgery for congenital heart disease in children. Perit Dial Int, 2012, 32(3):273-279
[4]Santiago MJ, López-Herce J, Urbano J, et al. Continuous renal replacement therapy in children after cardiac surgery. J Thorac Cardiovasc Surg, 2013, 146(2):448-454
[5]Askenazi DJ, Goldstein SL, Koralkar R, et al. Continuous renal replacement therapy for children ≤10 kg: a report from the prospective pediatric continuous renal replacement therapy registry. J Pediatr, 2013, 162(3):587-592
[6]Baskin E, Saygili A, Harmanci K, et al. Acute renal failure and mortality after open-heart surgery in infants. Ren fail, 2005, 27(5): 557-560
[7]Baskin E, Gulleroglu KS, Saygili A, et al. Peritoneal dialysis requirements following open-heart surgery in children with congenital heart disease. Ren Fail, 2010, 32(7):784-787
[8]El Masri K, Jackson K, Borasino S, et al. Successful continuous renal replacement therapy using two single-lumen catheters in neonates and infants with cardiac disease. Pediatr Nephrol, 2013, 28(12):2383-2387
[9]Wernovsky G, Wypij D, Jonas RA, et al. Postoperative course and hemodynamic profile after the arterial switch operation in neonates and infants. A comparison of low-flow cardiopulmonary bypass and circulatory arrest. Circulation, 1995, 92(8): 2226-2235
[10]Wu B, Gong D, Xu B, et al. Decreased platelet count in patients receiving continuous veno- venous hemofiltration: a single-center retrospective study. PLoS One, 2014, 9(5): e97286
[11]Watanabe K, Suzuki Y, Goto T, et al. Continuous hemodiafiltration in children after cardiac surgery. Artif Organs, 2011, 35(3):288-293
[12]Mulder J, Tan HK, Bellomo R, et al. Platelet loss across the hemofilter during continuous hemofiltration. Int J Artif Organs, 2003, 26(10):906-912
[13]Davis TK, Neumayr T, Geile K, et al. Citrate anticoagulation during continuous renal replacement therapy in pediatric critical care. Pediatr Crit Care Med, 2014, 15(5):471-485
[14]Tolwani A, Wille KM. Advances in continuous renal replacement therapy: citrate anticoagulation update. Blood Purif, 2012, 34(2):88-93
[15]Morabito S, Pistolesi V, Tritapepe L, et al. Regional citrate anticoagulation in cardiac surgery patients at high risk of bleeding: a continuous veno-venous hemofiltration protocol with a low concentration citrate solution. Crit Care, 2012, 16(3):R111
[16]Jander A, Tkaczyk M, Pagowska-Klimek I, et al. Continuous veno-venous hemodiafiltration in children after cardiac surgery. Eur J Cardiothorac Surg, 2007, 31(6):1022-1028
[17]Elahi MM, Lim MY, Joseph RN, et al. Early hemofiltration improves survival in post-cardiotomy patients with acute renal failure. Eur J Cardiothorac Surg, 2004, 26(5):1027-1031
[18]Li SY, Yang WC, Chuang CL. Effect of early and intensive continuous venovenous hemofiltration on patients with cardiogenic shock and acute kidney injury after cardiac surgery. J Thorac Cardiovasc Surg, 2014, 148(4):1628-1633
(本文编辑:张萍)
Continuous veno-venous hemofiltration for the treatment of acute renal failure in infants after congenital heart surgery
FUYue-qiang,LIUCheng-jun,BAIKe,LIJing,HULan,WANGWen-Lei,ZHOUFang
(DepartmentofCriticalCareMedicine,Children'sHospital,ChongqingMedicalUniversity,Chongqing400014,China)
Corresponding Author:LIU Cheng-jun,E-mail: liucwd@163.com
ObjectiveThe aim of this study was to investigate the use of continuous veno-venous hemodiafiltration (CVVH) in infants with acute renal failure after cardiac surgery.MethodsTwelve infants who
CVVH after cardiac surgery for congenital heart disease from Jan. 2013 to Aug. 2014 were retrospectively studied.ResultsAll infants weighed less than 10 kg. Eleven infants were applied CVVH when peritoneal dialysis (PD) was ineffective and one infant had to rely on CVVH because of peritonitis. The mean age at receiving CVVH was 8.8±6.5 months (ranging from 1 month to 24 months) and the mean body weight was 6.6±1.9 kg (ranging from 3.5 to 9.5 kg). The median duration of renal replacement therapy was 25 hours. Serum and urine creatinine concentration were (17.8±8.1) mmol·L-1and (169.64±38.24) μmol·L-1before, and (5.5±2.2) mmol·L-1and (81.4±25.1) μmol·L-1after CVVH (Ps≤0.001), respectively. The concentration of platelet was decreased after CVVH (P=0.001). The mean artery pressure and vasoactive-inotropic score did not significantly varied before and after CVVH [mean artery pressure: (59.0±16.2) mmHgvs. (55.2±12.4) mmHg,P=0.273; vasoactive-inotropic score: (20.3±8.5)vs. (19.9±12.0),P=0.878]. Seven infants died in the postoperative period, and the mortality rate was 58.3%. Five infants died from MODS caused by low cardiac output syndrome, one infant died from severe pulmonary infection, and one infant died from MODS caused by peritonitis. Compared with the survivors, vasoactive-inotropic score of non-survivors was significantly higher (median 27.5vs. 15.0,P=0.017), while the mean arterial pressure was significantly lower [(48.0±10.2)vs. (65.2±7.2),P=0.009].ConclusionCVVH is an alternative method of renal support to improve renal function for critically ill infants after cardiac surgery. Vasoactive-inotropic score and mean arterial pressure before CVVH treatment may be the important factors influencing the prognosis of patients. CVVH treatment may lead to thrombocytopenia.
Continuous veno-venous hemodiafiltration; Congenital heart disease; Infants; Acute renal failure
重庆医科大学附属儿童医院重症医学科 重庆, 400014
刘成军,E-mail:liucwd@163.com
10.3969/j.issn.1673-5501.2014.06.002
2014-09-03
2014-11-29)
