p110δ突变失活的ApcMin/+结直肠癌癌前病变小鼠模型的建立*
2014-08-09胡曦文章倩倩刘红英周大磊陈佳园王丽京
胡曦文, 章倩倩, 雷 岩, 刘红英, 周大磊, 陈佳园, 王丽京
(广东药学院血管生物学研究所,广东 广州 510006)
遗传学研究中最早也是最重要的哺乳动物实验研究系统就是小鼠模型。它为人类认识自我提供了一面镜子,为生理学、病理学、药理学、毒理学和行为科学的研究提供了无数的优秀实验模型,并触发了免疫学等研究领域中的重要科学发现。这些都充分体现出小鼠模型的可操作性和可干预性,也是其作为模式生物的最重要的价值[1]。
近几年,肠道肿瘤越来越成为威胁人类健康的重要疾病之一,其全球发病率和死亡率仍在不断上升,在我国也不例外。其中结直肠癌是常见的消化道恶性肿瘤,占胃肠道肿瘤的第2位。在我国常见恶性肿瘤死亡中,结直肠癌患者在男性占第5位,女性占第6位。在西方发达国家,结直肠癌是第3位恶性肿瘤。
家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)是结直肠癌发生形成的癌前病变,患者结直肠部位多发上千个腺瘤性息肉,抑癌基因APC的突变失活是结直肠肿瘤的起始因素之一[2]。1990年,Dove实验室在C57BL/6J小鼠的结肠腺瘤性息肉(adenomatous polyposis coli,Apc)基因第850位点进行无义突变失活操作,致使小鼠肠道上皮细胞胞浆β-catenin蛋白积累并入核,与TCF4/LEF转录因子结合,激活Wnt信号通路,启动下游原癌基因,最终导致多发性肠肿瘤(multiple intestinal neoplasia,Min),成功构建了良好的家族性腺瘤性息肉病小鼠模型 ——ApcMin/+小鼠品系[3-4]。如今,ApcMin/+小鼠已是国际公认的研究肠道肿瘤的小鼠模型,具有可遗传性、自发性和稳定性的特点而被广泛应用于包括对肿瘤细胞生长、新生血管形成、凋亡、肿瘤免疫以及肿瘤治疗药物开发等多方面的肿瘤研究工作[5-7]。
现已证实有多种肿瘤的发生、发展与炎症相关,且由炎症细胞和其分泌的细胞因子组成的肿瘤微环境,对肿瘤细胞的增殖、生存、转移起到重要作用,是肿瘤形成的一个必不可少的环节。磷酯酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)是一种与膜磷脂相关的丝苏氨酸蛋白激酶。PI3K最早发现是在细胞内信号转导通路中发挥着重要作用,影响并调控着许多生物学变化。PI3K信号通路的调控较为复杂,共有8个PI3K亚型,而根据它们的亚单位结构、调节方式和底物选择性被分为Ⅰ型、Ⅱ型和Ⅲ型。p110δ属于Ⅰ型PI3K成员,分子量大约为110 kD,作为催化性亚单位和一个与之紧密结合并能调节其活性与定位的调节性亚单位结合并发挥作用。同属成员还有p110α和p110β,但与之不同的是,p110δ更多地高表达于白细胞表面,参与涉及免疫紊乱的发生,这使得p110δ在肿瘤免疫研究中获得了更高的关注度。深入了解p110δ在调控信号通路中发挥的作用,有助于发现它们在病理学中扮演的特殊角色,并可以对相关疾病的进一步研究提供线索[8-10]。
利用基因工程小鼠建立各种肿瘤模型是当今肿瘤学研究的新趋势,也为研究工作的开展开拓了新的道路。随着分子生物学、细胞工程及繁育分析新技术的不断发展,生物学家和医学科研工作者根据各自工作的需求和对象,利用遗传工程技术对实验小鼠基因组进行有目的地改造或修饰,使实验小鼠有特定的生物表型或特性,为研究载体、基因的功能和调控机理、基因相互作用等体内“秘密活动”,或重大疾病和其发病机制以及预防治疗用药物的筛选等研究提供直接有效的实验模型[11]。本实验使用ApcMin/+模型小鼠同p110δD910A/D910A突变失活小鼠进行杂交并成功构建了ApcMin/+;p110δD910A/D910A突变失活小鼠模型,为研究p110δ突变失活在结直肠癌发生发展中的作用提供实验模型。
材 料 和 方 法
1 材料
1.1动物ApcMin/+小鼠购于The Jackson Laboratory)及p110δD910A/D910A小鼠[8]每种品系各6只,雌雄各3只,6~8周龄。C57BL/6小鼠购自广东省医学实验动物中心,生产许可证号为SCXK(粤)2008-0002,共6只(♀),6~8周龄。
1.2饲养环境 实验小鼠饲养于SPF的环境,室温维持在22~28℃,相对湿度50%~70%,光控12 h明/12 h暗,噪音小于60 dB;小鼠饲养盒、垫料、小鼠饮用温开水均经过高温高压灭菌处理;小鼠饲料购自广东省医学实验动物中心,经[60Co]辐照灭菌;实验小鼠饲养室定期紫外灭菌。
1.3仪器及试剂 独立送回风净化笼具/IVC系统(购自苏杭实验动物设备厂);PCR仪(购自美国应用生物系统公司);2×PCR Master Mix(购自Thermo);PCR引物(购自上海英骏生物技术有限公司广州合成部);DNA Ladder DL2000以及细胞/组织DNA提取试剂盒(购自上海捷瑞生物工程有限公司)。
2 方法
2.1ApcMin/+;p110δD910A/D910A小鼠模型的构建 用ApcMin/+雄性小鼠和p110δD910A/D910A雌性小鼠杂交构建ApcMin/+;p110δD910A/D910A小鼠模型,见图1。
2.2小鼠组织DNA提取 剪取小鼠尾尖3~5 mm,置于1.5 mL离心管中,参照上海捷瑞生物工程有限公司细胞/组织DNA提取试剂盒说明书,提取小鼠组织DNA,4 ℃保存。
2.3ApcMin/+小鼠鉴定ApcMin/+小鼠突变基因引物设计:(1) 5’-GCC ATC CCT TCA CGT TAG-3’;(2) 5’-TTC CAC TTT GGC ATA AGG C-3’;(3) 5’-TTC TGA GAA AGA CAG AAG TTA-3’。25 μL反应体系:PCR Mix 12.5 μL,ddH2O 6.5 μL,3种引物各1 μL, DNA 3 μL。反应条件:94 ℃变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 2 min,4 ℃冷却扩增产物。PCR产物于1.2% DNA琼脂糖凝胶进行电泳,150 V、20~30 min,凝胶荧光成像系统观察并分析电泳结果;p110δD910A/D910A小鼠突变基因引物设计: (1) 5’-CTG TCA TCT CAC CTT GCT CC-3’;(2) 5’-AGG GAA CCG CCG TAT GAC-3’;(3) 5’-AAT GCT TTC GTC CCA CGT CC-3’。25 μL反应体系:PCR Mix 12.5 μL,ddH2O 4.5 μL,引物(1) 1 μL,引物(2) 2 μL,引物(3) 1 μL, DMSO 1 μL, DNA 3 μL。反应条件:94 ℃变性3 min; 94 ℃ 30 s,65 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸2 min,4 ℃冷却扩增产物。PCR产物于1.2% DNA琼脂糖凝胶进行电泳,150 V、20~30 min,凝胶荧光成像系统观察并分析电泳结果。
结 果
1 ApcMin/+小鼠与p110δD910A/D910A小鼠的建系及鉴定[12]
ApcMin/+雄性成年小鼠和p110δD910A/D910A雌性成年小鼠以1∶2的比例相杂交2笼,所生小鼠p110δ基因全部为杂合子,ApcMin/+基因阳性的雄性小鼠为所需小鼠,即雄性ApcMin/+;p110δD910A/+小鼠,得1只。再分别用雄性ApcMin/+;p110δD910A/+小鼠以1∶2的比例与雌性p110δD910A/D910A小鼠杂交,所生子代通过鉴定ApcMin/+及p110δD910A/D910A基因,确定ApcMin/+;p110δD910A/D910A小鼠是否构建成功,鉴定结果如图2所示。目前成功构建2只雄性及3只雌性ApcMin/+;p110δD910A/D910A,雄性杂交鼠用于繁殖,雌性杂交鼠取组织观察肠道组织结构。
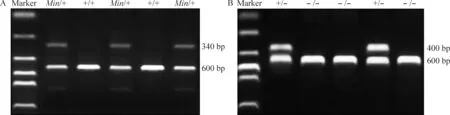
Figure 2. PCR identification of the mouse genotype.A: Apc gene; B: p110δ gene.
2 ApcMin/+;p110δD910A/D910A小鼠肠道组织学观察[13-14]
选取15周的小鼠颈椎脱臼处死,取出肠道进行肠道腺瘤、微腺瘤的数目、体积统计分析。ApcMin/+;p110δD910A/D910A小鼠相对于对照组ApcMin/+模型鼠,肠道腺瘤、微腺瘤的数目和体积大小均有所减少,见图3。

Figure 3. Intestinal methylene blue staining and intestinal adenoma number and volume charts. Mean±SD. **P<0.01 vs ApcMin/+.
讨 论
PI3K信号通路涉及细胞代谢调节、细胞周期调控、细胞生长凋亡、细胞支架重排和迁移、免疫反应,血管生成和心血管稳态等多种生物学过程,也被认为是在癌症中最经常失调的途径之一。多发性骨髓瘤中的p110δ存在高表达,且肿瘤细胞的增殖生长在抑制p110δ后出现明显的抑制[15];亦有报道显示,p110δ在血液恶性肿瘤的发生发展中也扮演着一个诱发者的角色;人体实体瘤组织中也检测到了p110δ的过表达,揭示其在肿瘤发生发展中发挥的促瘤作用[9-10]。本实验利用ApcMin/+结直肠癌癌前病变模型鼠与p110δD910A/D910A小鼠杂交构建的p110δD910A/D910A肿瘤研究小鼠模型,为后续进一步研究p110δ在肠道肿瘤发生发展微环境中发挥的作用提供良好模型工具,具有重要意义。
此外,实验期间我们也发现,ApcMin/+;p110δD910A/D910A杂交小鼠相对不易获得,原因有两点:(1)ApcMin/+结直肠癌癌前病变模型鼠雌鼠不宜受孕,只能靠雄鼠进行繁殖;(2)p110亚基突变小鼠在生殖发育方面存在异常,p110δD910A/D910A小鼠显现为受孕间隔增长,产仔数目减少[16]。为了实验的顺利进行,我们采取如下方法:(1)ApcMin/+雄鼠繁殖,雌鼠用于实验观察;(2)适当引入p110δD910A/+小鼠参与繁殖配种,虽然工作量有所加大,但杂合p110δ突变小鼠的生育情况得到明显提升,实验得以顺利进行。
[参 考 文 献]
[1] Collins FS, Patrinos A, Jordan E, et al. New goals for the U S Human Genome Project: 1998-2003 [J]. Science, 1998, 282(5389):682-689.
[2] Näthke IS. The adenomatous polyposis coli protein: the Achilles heel of the gut epithelium [J]. Annu Rev Cell Dev Biol, 2004, 20:337-366.
[3] Su LK, Kinzler KW, Vogelstein B, et al. Multiple intestinal neoplasia caused by a mutation in the murine homolog of the APC gene[J]. Science, 1992, 256(5057): 668-670.
[4] Taketo MM, Edelmann W. Mouse models of colon cancer [J].Gastroenterology, 2009,136(3):780-798.
[5] McAlpine CA, Barak Y, Matise I, et al. Intestinal-speci-fic PPARgamma deficiency enhances tumorigenesis inApcMin/+mice [J]. Int J Cancer, 2006, 119(10):2339-2346.
[6] Korsisaari N, Kasman IM, Forrest WF, et al. Inhibition of VEGF-A prevents the angiogenic switch and results in increased survival ofApc+/minmice[J]. Proc Natl Acad Sci U S A, 2007, 104(25):10625-10630.
[7] Urbanska AM, Bhathena J, Martoni C, et al. Estimation of the potential antitumor activity of microencapsulated Lactobacillusacidophilusyogurt formulation in the attenuation of tumorigenesis in Apc(Min/+) mice[J]. Dig Dis Sci, 2009, 54(2):264-273.
[8] Okkenhaug K, Bilancio A, Farjot G, et al. Impaired B and T cell antigen receptor signaling in p110delta PI 3-kinase mutant mice [J]. Science, 2002, 297(5583):1031-1034.
[9] Vanhaesebroeck B, Guillermet-Guibert J, Graupera M, et al. The emerging mechanisms of isoform-specific PI3K signaling [J]. Nat Rev Mol Cell Biol, 2010, 11(5):329-341.
[10] Zhao L, Vogt PK. Class I PI3K in oncogenic cellular transformation [J]. Oncogene, 2008, 27(41):5486-5496.
[11] 傅继梁, 王铸钢. 基因工程小鼠[M]. 上海: 上海科学技术出版社, 2006: 1-20.
[12] 郭四美,亓翠玲,叶 杰,等. P-选择素对ApcMin/+小鼠肠道肿瘤的作用[J]. 中国病理生理杂志, 2012, 28(7): 1197-1201.
[13] Yamada T, Mori Y, Hayashi R, et al. Suppression of intestinal polyposis inMdr1-deficientApcMin/+mice [J]. Cancer Res, 2003, 63(5):895-901.
[14] 叶志金, 郑 力, 亓翠玲, 等.ApcMin/+结直肠癌癌前病变小鼠模型的生物学特性[J]. 临床与实验病理学杂志, 2011, 27(4):393-395.
[15] Castillo JJ, Furman M, Winer ES. CAL-101: a phosphatidylinositol-3-kinase p110-delta inhibitor for the treatment of lymphoid malignancies [J]. Expert Opin Investig Drugs, 2012, 21(1):15-22.
[16] Srinivasan L, Sasaki Y, Calado DP, et al. PI3 kinase signals BCR-dependent mature B cell survival [J]. Cell, 2009, 139(3):573-586.
