过表达磷脂转运蛋白对小鼠脂蛋白上鞘氨醇-1-磷酸含量的影响*
2014-08-09冯玉梅郭守东崔英杰宋国华王义维蒋宪成秦树存
于 杨, 冯玉梅, 郭守东, 崔英杰, 宋国华, 冯 蕾, 罗 甜, 陈 超, 王义维, 蒋宪成, 秦树存△
(1山东省高校动脉粥样硬化重点实验室,泰山医学院动脉粥样硬化研究所,山东 泰安 271000;2承德医学院附属医院,河北 承德 067000; 3纽约州立大学下州医学中心解剖学和细胞生物学系,美国 纽约 11203)
心脑血管疾病是现代社会人类的头号杀手,其主要病理学基础是动脉粥样硬化(atherosclerosis,AS)。高密度脂蛋白(high-density lipoprotein,HDL)是体内最重要的抗AS因素[1]。时至今日,越来越多的研究人员证明HDL的水平与其功能几乎同等重要,对AS的发生发展意义重大[1-2]。HDL颗粒成分中,载脂蛋白、酶类和某些重要脂质分子在内的物质对HDL的抗AS功能至关重要。
生理状态下,超过50%的血浆脂质信号分子鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)富集于HDL上,并可通过其特异性受体发挥动脉保护作用[3]。红细胞、内皮细胞、血小板和肥大细胞等均能释放S1P入血液循环[4]。HDL通过S1P特异性载体载脂蛋白M(apolipoprotein M,apoM)将S1P富集[5]。然而,S1P如何从细胞到HDL上的转运机制目前仍不明确,其分布与血浆蛋白的关系及其机制也有待进一步阐明。
磷脂转运蛋白(phospholipid transfer protein,PLTP)是一种多功能蛋白,广泛表达于肝细胞、脂肪细胞及巨噬细胞等。PLTP能介导磷脂、游离胆固醇及其它双性脂质分子从富含甘油三酯(triglyceride, TG)的脂蛋白颗粒向HDL转运[6]。在冠心病患者,血浆HDL水平下降同时伴有PLTP活性增高[7]。另外,冠心病及心肌梗塞患者非HDL(non-HDL)上S1P明显增加,提示血浆脂蛋白上S1P水平及分布与动脉粥样硬化性疾病严重程度关系密切[8]。S1P是鞘氨醇的磷酸化产物,其分子结构特点与其它能够被PLTP转运的双性脂质分子相似,这提示PLTP很有可能具有转运S1P的作用,并通过该机制改变S1P在HDL和其它脂蛋白上的含量和分布。本研究结果表明,PLTP过表达情况下,能够显著降低HDL上S1P的同时升高低密度脂蛋白(low-density lipoprotein, LDL)上S1P,其机制可能与PLTP介导S1P的转运有关。
材 料 和 方 法
1 动物
PLTP转基因小鼠(PLTPtransgenic mouse,PLTP-Tg)和PLTP敲除小鼠(PLTP-/-)由蒋宪成博士赠予。本研究中所用PLTP-Tg、PLTP-/-及野生型(wild-type,WT)小鼠的遗传背景均为C57BL/6并经过9代回交。喂养小鼠的标准饲料购自北京维通利华公司,自由饮水。所有实验动物均喂养于温湿度可控、12/12 h亮暗循环的房间内。本实验经过泰山医学院动物关怀委员会认证,所有动物实验均按照《泰山医学院实验动物关怀与使用指南》进行。
2 抗体和材料
apoM抗体购自Cell Signaling Technology。完全蛋白酶抑制剂混合片剂购自Roche。D-erythro-S1P、离心分离柱 (截流分子量≤3 kD)、分析纯甲酸和甲酸铵购自Sigma-Aldrich。内标D-erythro-C17-鞘氨醇-1-磷酸(C17-S1P)购自Avanti Polar Lipids Inc.。甲醇和乙醇购自SK Chemicals。脂质定量试剂盒购自中生北控公司。蛋白定量试剂盒、透析膜(截流分子量≤ 8 kD)和D-Hanks缓冲液购自Solarbio。
3 血浆分离和脂蛋白制备
第10~11周龄时,禁食后取材,分离WT或PLTP-Tg血浆0.6 mL后进行超速离心以分离脂蛋白[9]。
4 S1P相关检测
4.1制备S1P标准品 S1P标准品浓度为0.1 g/L溶于乙醇后,即分装,并储存于-20 ℃。通过稀释获得系列工作液浓度为50~1 000 g/L。
4.2生物样本制备和脂质提取 20 μL血浆样本与10 μL内标C17-S1P (400 μg/L)与甲醇充分混合后,超声10 min,11 000×g离心10 min。将上清转移至玻璃瓶中进行S1P定量检测。用10 μL内标溶液(400 mg/L)和甲醇校正标准品系列溶液,此刻内标C17-S1P浓度为40 mg/L。
4.3串联质谱分析 Waters Symmetry® 碳18柱(3.5 μm, 2.1 mm 内径×10 mm)色析法线性洗脱(3.5 μm, 2.1 mm 内径×100 mm) 后,流动相成分为2 mol/L 甲酸铵、0.1%甲酸溶解于90%甲醇。上样体积为5 μL,流速为0.2 mL/min。采用阳离子模式操作质谱仪器, 离子喷嘴电压为5 500V,温度为550 ℃,辅助气压力为55 psi。 喷雾气压力55 psi, 气幕压力10 psi,碰撞气压为中等。S1P (碰撞能量29.0 V)离子跃迁产物前体m/z 380.2→264.1,C17-S1P (碰撞能量19.9V) 离子跃迁产物前体 m/z 用于在液质联用-串联质谱(liquid chromatography-tandem mass spectrometry, LC-MS/MS)多反应模式(multiple response model,MRM)下定量,保留时间100 ms。采用Analyst Software 1.6定量分析。通过标准曲线上S1P标准品和内标标准品浓度以及S1P峰面积与内标峰面积比值最终计算出样本中S1P浓度。
4.4S1P转运实验 为明确PLTP转运S1P的作用,本研究采用一种供体-接受体转运体系。首先,新鲜分离的PLTP-/-红细胞(red blood cell, RBC)经冰冷的D-Hanks缓冲液重悬后,600×g4 ℃离心5 min, 弃上清。重复洗涤1次以除去残存血浆。RBC悬液细胞密度调整至1010~1011/L,该溶液作为S1P供体,平均S1P含量为(900.67±6.68) ng/L。参照Yoshino方法制备重组HDL作为S1P接受体。取自PLTP-/-和WT新鲜血浆分别作为转运实验的阴性对照或PLTP来源。D-Hanks缓冲液作为转运实验的空白对照。20 μL的供体、50 μL接受体和2 μL 含PLTP的WT血浆或PLTP-/-血浆或D-Hanks液在Eppendorf管内轻柔混合,并用D-Hanks液调整体积至100 μL。转运实验混合物在37 ℃孵育60 min,孵育后300×g4 ℃离心2 min分离上清HDL和RBC沉淀。分别检测上清中和沉淀内S1P含量。为明确转运实验中S1P以何种形式存在,本研究采用离心分离柱(截流分子量≤ 3 kD)将转运实验结束后的上清进行处理。结果表明分子量<3 kD的流出液中并未检测到S1P。这证明本系统中S1P基本以结合型存在。
5 蛋白分离、电泳及免疫印迹
参照文献[10]每孔2 μg血浆或脂蛋白样本加入十二烷基硫酸钠凝胶中进行电泳和免疫印迹检测apoM含量,采用Image-Pro Plus 6.0分析。
6 统计学处理
数据用均数±标准差(mean±SD)表示,2 组间比较用t检验,多组间比较用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 PLTP过表达降低血浆S1P含量
收集PLTP-Tg与WT小鼠血浆后检测血脂和S1P含量。血浆脂质水平见表1。可见PLTP-Tg小鼠血浆总胆固醇(total cholesterol, TC)、HDL胆固醇(HDL cholesterol, HDL-C)和非HDL胆固醇(non-HDL-C)均显著低于WT小鼠。如图1A所示,PLTP-Tg小鼠血浆S1P含量显著低于WT小鼠。由于血浆中超过60%的S1P富集于脂蛋白上,脂蛋白上脂质含量变化可能对血浆S1P产生影响,所以将血浆S1P含量采用TC进行校正。结果表明,经过TC校正后,PLTP-Tg小鼠血浆S1P含量显著高于WT,见图1B。这说明PLTP对血浆S1P含量和分布有显著影响。

表1 血浆脂质含量
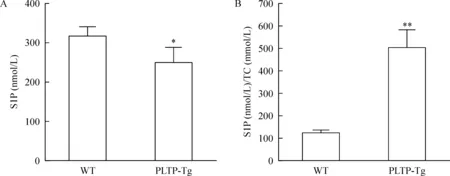
Figure 1. Plasma S1P content (A) and total cholesterol (TC)-normalized plasma S1P content (B) in PLTP-Tg mice. Mean±SD.n=8.*P<0.05,**P<0.01 vs WT group.
2 PLTP过表达显著升高LDL上S1P比例
如图2所示,PLTP-Tg小鼠HDL和极低密度脂蛋白(very low-density lipoprotein,VLDL)上S1P含量较WT小鼠明显减少,而LDL上S1P则显著增加127.4%,提示过表达PLTP很可能促进LDL上S1P含量的增加。
3 PLTP从红细胞将S1P转运至重组脂质体
如图3所示,与不含PLTP的血浆相比,WT血浆能够增加重组脂质体上S1P含量超过350%,说明PLTP能够将S1P转运至重组脂质体。
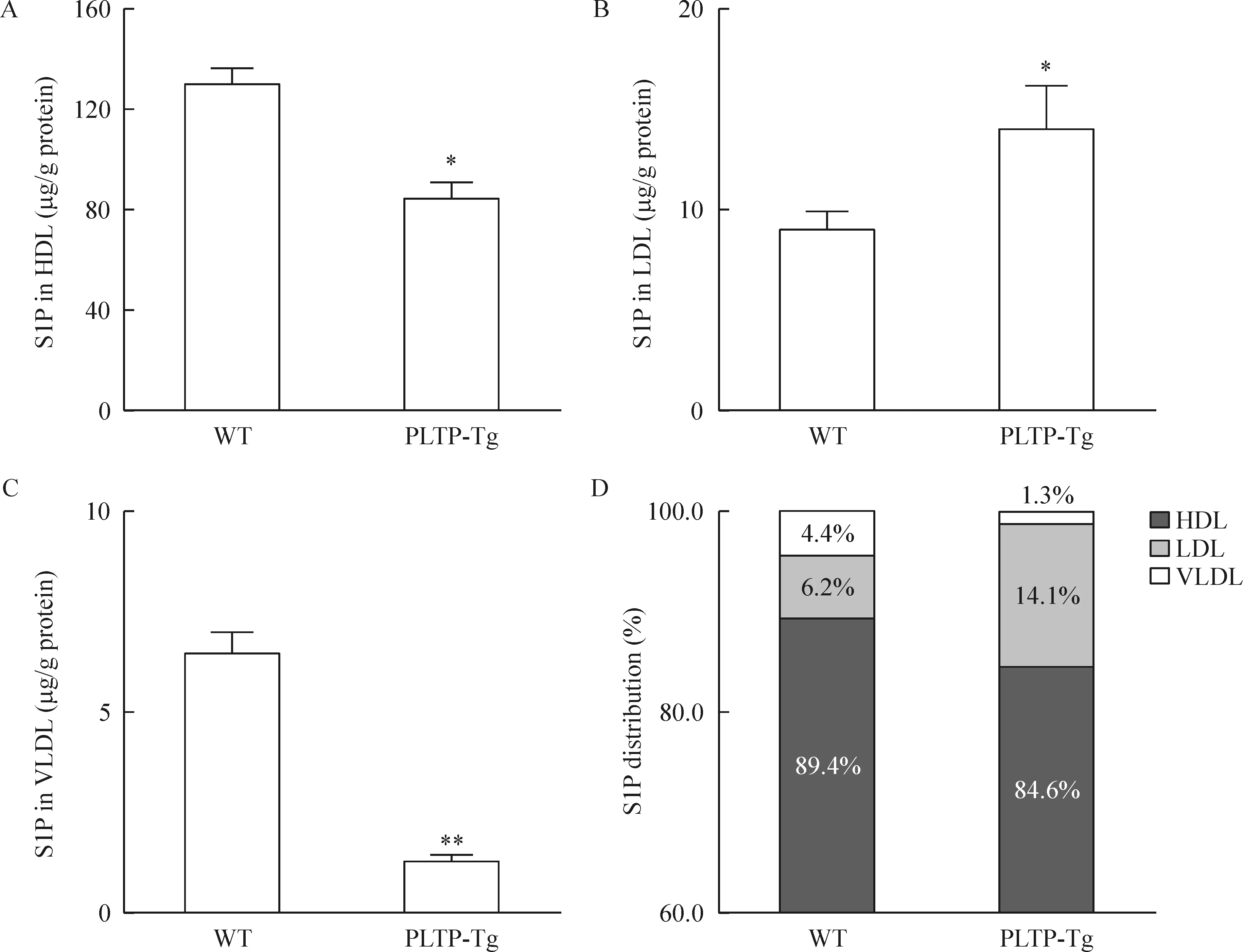
Figure 2. S1P content in lipoprotein was affected by PLTP overexpression.A~C: S1P content in HDL,LDL and VLDL, respectively; D: S1P distribution. Mean±SD.n=4.*P<0.05,**P<0.01 vs WT group.

Figure 3. PLTP transferred S1P from RBC to recombinant liposome.Mean±SD.n=4.**P<0.01 vs blank; △△P<0.01 vs negative control.
4 PLTP过表达不影响血浆apoM含量
如图4A和B所示,PLTP-Tq与WT小鼠比较,apoM含量无论是血浆中还是HDL组分中均无明显差别。图4C显示,PLTP过表达不影响血浆中和脂蛋白上apoM的含量和分布。
讨 论
S1P是HDL上与血管保护作用有关的重要信号分子[5]。在动脉粥样硬化性疾病时S1P在脂蛋白上分布有明显变化[8]。为阐明该机制,我们开展如下研究并首次发现:(1)PLTP过表达能升高经胆固醇校正后血浆S1P含量;(2)血浆中高水平PLTP能显著增加LDL组分中S1P含量;(3)其机制与PLTP能够介导S1P从细胞向脂蛋白类颗粒转运这一机制有关;(4)血浆apoM含量与PLTP表达无关。
由于S1P在HDL上和非HDL上表现出相反的作用,提示S1P在HDL与非HDL上的分布变化可能是AS性疾病的重要致病因素。因此明确血浆S1P分布对于研究冠心病和中风等AS性疾病的发病机制有重要意义。血浆中S1P的主要载体是HDL,HDL-S1P具有增强内皮细胞屏障作用和促进内皮源性一氧化氮分泌等作用,也是HDL动脉保护功能的重要组成部分[5]。因此,血浆S1P的含量和分布对于HDL功能有重要意义。本研究结果表明参与HDL代谢的酶或蛋白能够改变S1P分布,并参与AS性疾病的发生发展。
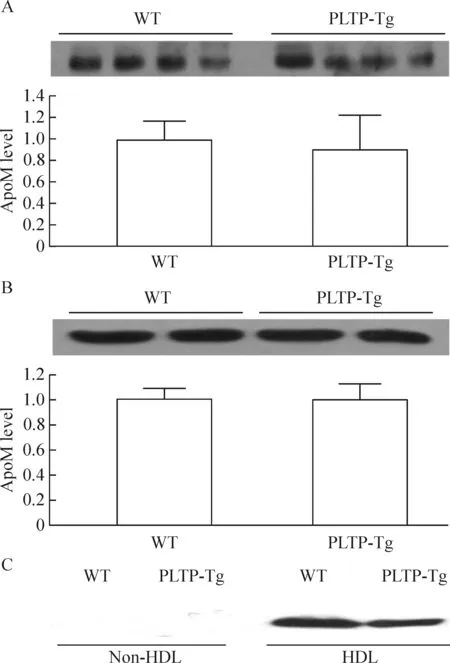
Figure 4. ApoM content in plasma and lipoprotein was not affec-ted by PLTP overexpression in mice. A: plasma apoM content in PLTP-Tg and WT mice; B: HDL apoM content in PLTP-Tg and WT mice; C: apoM content in non-HDL (combined VLDL and LDL) and HDL from PLTP-Tg or WT mice. Mean±SD.n=3.
PLTP属于脂质转运家族并能介导脂蛋白和细胞间双性分子的转运[11]。PLTP-Tg小鼠血浆TC和HDL-C显著下降提示其脂蛋白颗粒上蛋白和脂质含量均发生明显变化。PLTP过表达可加重载脂蛋白E敲除鼠AS进程,而PLTP缺乏能减轻多种AS模型的斑块形成,提示PLTP与AS的发生发展有密切关系[6]。然而关于PLTP表达水平对血浆S1P的含量和作用的影响尚无报道。本研究首次发现PLTP过表达能降低血浆和HDL上S1P的含量,提示PLTP对维持HDL上S1P含量有重要作用。除此之外,本团队即将发表的数据表明PLTP能够促进S1P从红细胞向HDL转移,在此基础上,本研究采用重组脂质体作为S1P接受体,进一步证实PLTP有助于S1P从红细胞向脂质体转移这一重要作用。
PLTP能够介导诸如磷脂、维生素E等一些类型的脂质分子以“脂蛋白到脂蛋白”或“细胞到脂蛋白”等形式的转移[11]。PLTP的结构与功能研究表明其能够转运的分子均属于双性分子,两端分别带有亲水和疏水基团。S1P属于鞘氨醇的磷酸化产物,亦属于双性分子,具有与其它能够被PLTP转运的分子相似的结构。因此本研究采用红细胞作为S1P供体,重组脂质体作为S1P接受体,检测PLTP转运S1P的作用。该方法采用的转运缓冲体系与广泛报道的PLTP活性检测采用的“供体-接受体”系统相同[7]。本研究发现PLTP能够介导S1P自红细胞向脂质体转运,这一结果阐明了PLTP过表达通过其直接转运S1P的作用影响S1P含量和分布。
另一个影响HDL上S1P含量的决定性因素是S1P的内源性特异载体apoM,apoM主要富集于HDL[5, 12]。在LDL受体敲除鼠和apoE敲除鼠体内,apoM可发生从HDL向非HDL迁移的现象[12]。而本研究结果表明,PLTP过表达不影响小鼠血浆apoM含量,也未造成apoM从HDL上向其它脂蛋白的迁移。这从另一角度证明与其它基因修饰小鼠不同,PLTP过表达升高LDL上S1P含量的机制与向non-HDL上转运游离S1P有关,而不是通过影响apoM分布产生的间接作用。
LDL除了能通过结缔组织生长因子(connective tissue growth factor,CTGF) -细胞外信号调节激酶(extracellular signal-regulated kinases,ERK) 1/2-c-Jun N末端激酶(c-Jun N-terminal kinases,JNK)途径反式激活S1P受体外,还具有很强的S1P结合能力,该能力与apoM无关[11-12]。本研究结果表明在非HDL上检测不到apoM,提示LDL可能通过某种未知机制俘获S1P。另外,HDL能增加基础水平上心肌灌流,而S1P则可通过S1P3受体抑制该机制,说明S1P活性与HDL的生物学效应并非始终保持一致,这可能与S1P的受体分布和转运形式有关[12-13]。心梗及稳定性心绞痛等AS性疾病患者非HDL上S1P含量增加提示该现象很可能与上述疾病的发生发展关系密切。同时冠心病等患者血浆PLTP活性明显高于正常人群,那PLTP是否通过影响S1P的分布对AS性疾病产生影响,有待于进一步研究[13]。
综上所述,本研究进一步明确了PLTP在血浆脂蛋白上S1P分布的作用,其机制与PLTP直接转运S1P有关。该结果为PLTP参与AS性疾病的病理生理机制提供了新的实验依据。
[参 考 文 献]
[1] Kontush A, Chapman MJ. Functionally defective high-density lipoprotein: a new therapeutic target at the crossroads of dyslipidemia, inflammation, and atherosclerosis[J]. Pharmacol Rev, 2006, 58(3):342-374.
[2] Takuwa Y, Okamoto Y, Yoshioka K, et al. Sphingosine-1-phosphate signaling in physiology and diseases[J]. Biofactors, 2012, 38(5):329-337.
[3] 韦淑萍, 孙慧燕, 刘 未,等. ZNF580在1-磷酸鞘氨醇诱导内皮细胞迁移和增殖中的作用[J]. 中国病理生理杂志, 2012, 28(12): 2119-2124.
[4] Levkau B. Cardiovascular effects of sphingosine-1-phosphate (S1P)[J]. Handb Exp Pharmacol, 2013, 216(6):147-170.
[5] Christoffersen C, Obinata H, Kumaraswamy SB, et al. Endothelium-protective sphingosine-1-phosphate provided by HDL-associated apolipoprotein M[J]. Proc Natl Acad Sci U S A, 2011, 108(23):9613-9618.
[6] Jiang XC, Qin S, Qiao C, et al. Apolipoprotein B secretion and atherosclerosis are decreased in mice with phospholipid-transfer protein deficiency[J]. Nat Med, 2001, 7(7):847-852.
[7] Attia N, Nakbi A, Smaoui M, et al. Increased phospholipid transfer protein activity associated with the impaired cellular cholesterol efflux in type 2 diabetic subjects with coronary artery disease[J]. Tohoku J Exp Med, 2007, 213(2):129-137.
[8] Sattler KJ, Elbasan S, Keul P, et al. Sphingosine 1-phosphate levels in plasma and HDL are altered in coronary artery disease[J]. Basic Res Cardiol, 2010, 105(6):821-832.
[9] 徐 丹, 孟 宇, 胡 波, 等. 基于HPLC-MS/MS Q-TOF分析糖尿病肾病维持性血透患者含糖透析的代谢特征[J]. 中国病理生理杂志, 2013, 29(3): 455-461.
[10] 臧婵媛, 康 毅, 温 克, 等. 1-磷酸鞘氨醇对血小板活化因子所致大鼠肠系膜微血管通透性增高的影响[J]. 中国病理生理杂志, 2010, 26(4): 681-685.
[11] Faber K, Axler O, Dahlback B, et al. Characterization of apoM in normal and genetically modified mice[J]. J Lipid Res, 2004, 45(7):1272-1278.
[12] Oram JF, Wolfbauer G, Tang C, et al. An amphipathic helical region of the N-terminal barrel of phospholipid transfer protein is critical for ABCA1-dependent cholesterol efflux[J]. J Biol Chem, 2008, 283(17):11541-11549.
[13] Robins SJ, Lyass A, Brocia RW, et al. Plasma lipid transfer proteins and cardiovascular disease. The Framingham Heart Study[J]. Atherosclerosis,2013,228(1):230-236.
