乙肝病毒X蛋白通过激活JAK2/STAT3信号通路调节肾小管上皮细胞凋亡
2014-08-09李德天冯国和
何 平, 李 丹, 李德天, 冯国和
(中国医科大学附属盛京医院 1肾内科, 2感染科, 辽宁 沈阳 110004)
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球范围内重要的公共卫生问题之一。据估计全球范围内约有3.5亿人是慢性HBV携带者[1]。长期以来中国、东南亚和热带非洲为高流行区。自1971年Combes等首先描述了第1例具有持续HBsAg血症的患者发生了膜性肾病以来,肾小球肾炎已被公认为是HBV感染引起的最常见肝外病变,又称乙型病毒肝炎相关性肾炎(HBV-associated glomerulonephritis,HBVGN)。既往认为,HBVGN的发病机制是HBV抗原和抗体形成的循环免疫复合物和原位免疫复合物在肾组织的沉积。但目前认为,HBV因其泛嗜性而直接感染肾组织细胞,产生病毒杀细胞效应,也是HBVGN重要的发病机制之一[2]。
HBV X蛋白(HBV X protein,HBx)基因是HBV基因组中最小的开放性读码框,编码长度为154个氨基酸的蛋白。X蛋白是一种多功能蛋白,能够激活多种细胞的信号转导通路,调节凋亡等。然而,针对不同种类的细胞及不同的外界条件,HBx调节细胞凋亡的作用及机制也各不相同[3]。大量研究表明HBx可以激活JAK/STAT、Ras-Raf-MAPK、p38 MAPK、JNK、PI3K、Src酪氨酸激酶、Pyk-2等信号通路[4-5],诱导宿主细胞凋亡[6-8]。
细胞凋亡是基因控制和酶促反应下按一定程序进行的细胞主动性死亡。天冬氨酸半胱氨酸蛋白酶3(caspase-3)是凋亡产生的最终效应酶。凋亡相关蛋白Bcl-2和Bax位于caspase-3的上游,Bax和Bcl-2二者的表达水平及Bcl-2/Bax比值是影响细胞生存的重要因素[9-11]。而Bcl-2和Bax的表达又受到JAK/STAT信号通路的调控[12]。JAK/STAT信号通路是一条重要的细胞因子信号转导通路,与细胞的增殖、分化、凋亡等密切相关。JAK是内源性蛋白酪氨酸激酶,它可在细胞因子受体与相应配基结合后活化,进而使胞浆中的STAT分子磷酸化,2个磷酸化的STAT分子形成二聚体进入细胞核,在核内它们与靶基因启动子中特异的DNA序列结合而诱导目的基因表达。研究表明,多种急、慢性肾脏疾病的发生和发展都与细胞凋亡有着密切关系[13-16]。既往在针对HBVGN肾组织的研究中发现,细胞凋亡的主要发生部位是近端及远端肾小管上皮细胞,肾小球少见,同时凋亡相关蛋白Bax/Bcl-2比值也发生了相应的变化;但JAK/STAT信号通路的活化情况及其在凋亡中的作用并不清楚[17-19]。为了进一步明确HBVGN中HBx的致病机制及JAK/STAT信号通路的活化在肾小管上皮细胞凋亡中的作用,我们将HBx基因真核表达载体转染至人肾近曲小管上皮细胞(HK-2细胞)中,检测JAK/STAT信号通路的激活及对HK-2细胞增殖和凋亡的影响,为HBVGN发病机制的研究提供新的实验依据。
材 料 和 方 法
1 细胞培养和分组
HK-2细胞购自北京中原公司(ATCC中国大陆总代理)。用Keratinocyte-SFM培养基在37 ℃、饱和湿度、5% CO2的培养箱中培养。细胞呈单层贴壁生长,实验均取对数生长期细胞。待细胞长满培养瓶瓶底(一般2~3 d)后,无菌条件下用0.25%胰酶消化传代。
实验分两部分。第一部分实验分5组: (1)对照组,(2)转染空质粒pcDNA3.1(+)组(空质粒组),(3)转染质粒pcDNA3.1(+)-HBx 24 h组(HBx 24 h组),(4)转染质粒pcDNA3.1(+)-HBx 48 h组(HBx 48 h组)和(5)转染质粒pc-DNA3.1(+)HBx 72 h组(HBx 72 h组)。第二部分实验分6组: (1)对照组,(2)转染空质粒pcDNA3.1(+)组,(3)转染质粒pcDNA3.1(+)-HBx组,(4)对照组+AG490组,(5)转染空质粒pcDNA3.1(+)+AG490组,(6)转染质粒pcDNA3.1(+)-HBx +AG490组,其中(4)~(6)组的细胞用AG490(Sigma)孵育24 h。
2 主要方法
2.1质粒转染 用Lipofectamine® LTX & Plus转染试剂(Invitrogen),按照说明书步骤进行转染。在实验中,用与pcDNA3.1(+)-HBx大小接近的pEGFP-C1荧光质粒(Clontech)共转染,间接评估目的质粒转染效率。
2.2Western blotting法检测目标蛋白 收获细胞后,用含有PMSF的RIPA裂解液提取细胞总蛋白。细胞提取物用BCA法测定浓度。等量上样,用8%及12% SDS-PAGE分离。之后将蛋白转移至PVDF膜上。封闭后,分别加入 Ⅰ 抗:HBx(1∶1 000,Chemicon)、JAK2(1∶2 000,CST)、p-JAK2(1∶1 500,CST)、STAT3(1∶1 000,CST)和p-STAT(1∶2 000,CST),4 ℃摇床孵育过夜。加入相应Ⅱ抗,进行ECL反应。一次性完成定影、显影及图像分析系统测定条带的灰度值。
2.3荧光显微镜和透射电镜观察细胞凋亡 通过Hoechst 33342(Sigma)对细胞核染色观察凋亡细胞的形态学变化。HK-2细胞以5×105的密度接种于6孔板中爬片过夜, 分别转染空质粒pcDNA3.1(+)及pcDNA3.1(+)-HBx,并设对照组。分别于37 ℃、饱和湿度、5% CO2的培养箱中培养24 h、48 h和72 h。取出细胞爬片,PBS洗3次,4%多聚甲醛固定20 min,PBS再洗3次,加入Hoechst 33342荧光染料(5 mg/L)37 ℃避光孵育8 min,再用PBS洗3次。尽快于荧光显微镜下观察、照相。
应用透射电镜观察HK-2细胞的超微结构。细胞以5×105的密度接种于6孔板中过夜,分别转染空质粒pcDNA3.1(+)及pcDNA3.1(+)-HBx,并设对照组。分别于37 ℃、饱和湿度、5% CO2的培养箱中培养24 h、48 h和72 h。后胰酶消化,收集细胞,置于2.5%戊二醛(4 ℃保存)中固定。固定后的组织经0.1 mol/L磷酸缓冲液中充分漂洗,用1%锇酸(OsO4)双固定24 h,漂洗后乙醇梯度脱水,丙酮置换、浸透,环氧树脂Epon812浸透、包埋、聚合,LKB超薄切片机制成超薄切片,于透射电镜下观察肾小管上皮细胞超微结构。
2.4Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率 Annexin V-FITC/PI流式双染试剂盒购自中国南京凯基生物科技发展有限公司。HK-2细胞以5×108/L接种于6孔板中培养24 h贴壁后, 分别转染空质粒pcDNA3.1(+)及pcDNA3.1(+)-HBx,并设对照组。分别于37 ℃、饱和湿度、5% CO2的培养箱中培养24 h、48 h和72 h。用无EDTA胰酶消化收集细胞。离心、PBS洗涤细胞3次。用500 μL 1× binding buffer悬浮细胞,浓度大约为1×109/L。在细胞悬浮液中加入5 μL Annexin V-FITC轻轻混匀,4 ℃冰箱避光孵育30 min。加入5 μL PI后轻轻混匀,4 ℃避光孵育5 min。随即用流式细胞仪检测(最迟1 h内)。结果用CellQuest专业软件获取分析数据。Annexin V-FITC/PI双标记流式细胞术可将实验样本中正常、坏死和凋亡细胞区分开。以FITC和PI荧光作双参数点图,细胞分为4个象限,左下象限为 Annexin V-FITC-、PI-,代表正常活细胞;左上象限为 Annexin V-FITC-、PI+,代表机械损伤细胞;右下象限为Annexin V-FITC+、PI-,代表早期凋亡细胞;右上象限为Annexin V-FITC+、PI+,代表晚期凋亡/坏死细胞。分别计数各组细胞凋亡率并进行组间比较。实验重复3次。
2.5细胞增殖的测定 CCK-8(中国南京凯基生物科技发展有限公司)法检测HBx对HK-2细胞增殖的作用:消化收集对数增殖期细胞并调整成浓度为1×108/L的细胞悬液,接种于3张96孔板,每孔100 μL。接种过夜后,镜下观察确认细胞贴壁良好。细胞分3组:分别为对照组、转染空质粒组和转染pcDNA3.1(+)-HBx组。实验设不加细胞只有全培养基的空白对照,比色时以空白对照校零。细胞在37 ℃、饱和湿度、5% CO2的培养箱中培养24 h、48 h和72 h。结束培养前2 h每孔加CCK-8 10 μL。于450 nm波长处检测每孔吸光度值(A值)。实验重复3次。细胞生存率及增殖抑制率按如 下公式计算:生存率(%)=(实验组A值/对照组A值)×100%;抑制率(%)=(1-生存率)×100%。
2.6免疫荧光观察 各组细胞在盖玻片上生长融合到95%~100%时,从孵箱中取出;用PBS洗后,4%甲醛固定;0.5%Triton X-100在37 ℃温箱透化20 min;血清封闭后,分别加Ⅰ抗STAT3(1∶50)和p-STAT3(1∶100),湿盒里4 ℃过夜;加Ⅱ抗后,DAPI复染,95%甘油封片;共聚焦荧光显微镜下观察拍照。
3 统计学处理
数据以均数±标准差(mean±SD)表示,使用SPSS 13.0统计软件处理,组间比较用单因素方差分析(ANOVA);相关分析采用直线相关。以P<0.05为差异有统计学意义。
和地下潜流,它劈开群山峻岭,奔涌不息,横穿祁连山脉,在这里留下了一条大峡谷——黑河大峡谷,其原始神奇的峡谷风光正等待着大家前去游览、欣赏。
结 果
1 目的质粒pcDNA3.1(+)-HBx的转染效率及HBx在HK-2细胞中的表达
利用共聚焦显微镜观察到pcDNA3.1(+)-HBx的转染效率大概在45%~55%左右,见图1。转染pcDNA3.1(+)HBx 24 h、48 h及72 h组在17 kD出现一条明显条带,表明HBx在HK-2细胞有阳性表达。转染目的基因24 h及48 h,蛋白表达量无明显区别(P>0.05)。转染目的基因72 h后,蛋白表达水平最高,与24 h、48 h比较,差异显著(P<0.05)。空质粒转染及未转染组未见相应蛋白条带,见图2A。
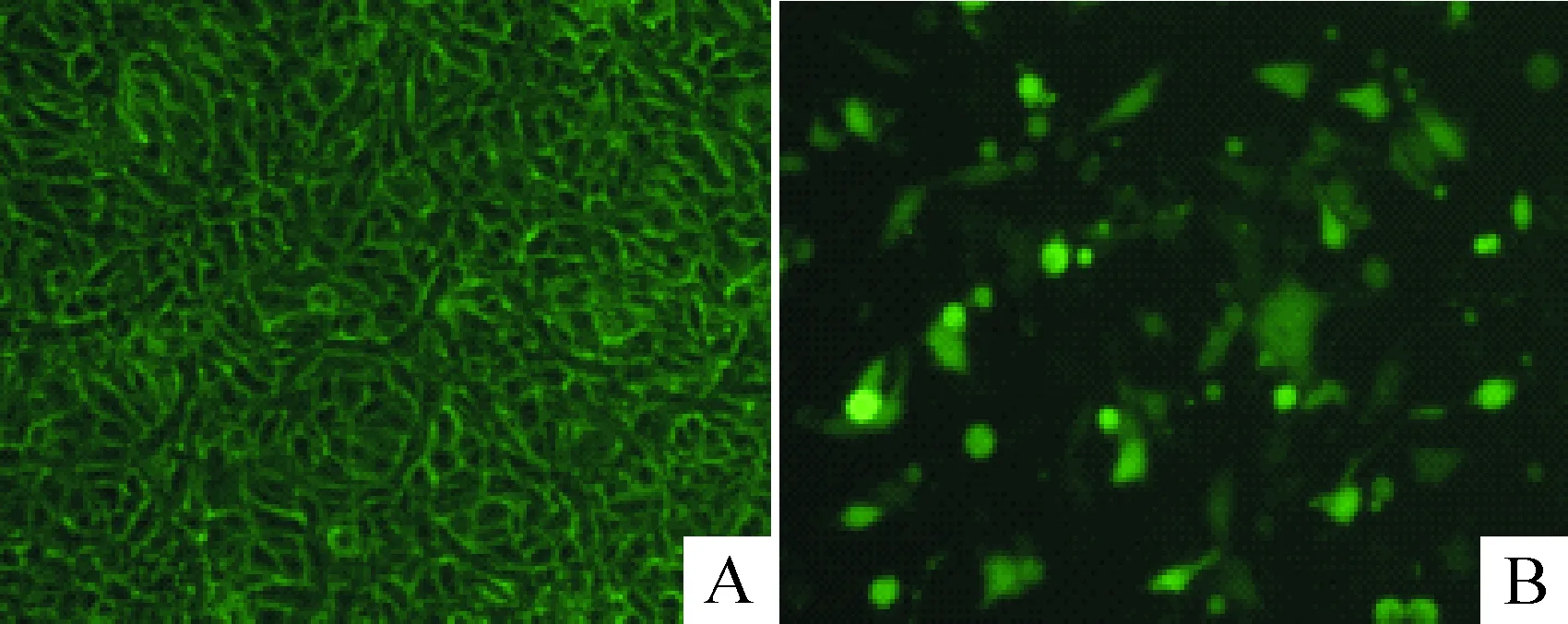
Figure 1. Plasmid transfection efficiency in HK-2 cells observed under confocal microscope (×100). A: fluorescence microscopy; B:confocal microscopy.
对照组、空质粒组及pcDNA3.1(+)-HBx组转染24 h后,加用AG490再孵育24 h。转染质粒pc-DNA3.1(+)-HBx组及转染质粒pcDNA3.1(+)-HBx+AG490组均有HBx表达,且表达量无明显差异(P>0.05),见图2B。这说明AG490不影响HBx蛋白的表达。
2 倒置显微镜观察各组细胞形态变化
对照组细胞及转染空质粒组细胞密度较大,形态基本正常;而转染pcDNA3.1(+)-HBx后各时点各组出现细胞增殖受抑,细胞密度变小,凋亡细胞的体积变小、变圆;细胞出现皱缩、脱落,见图3。
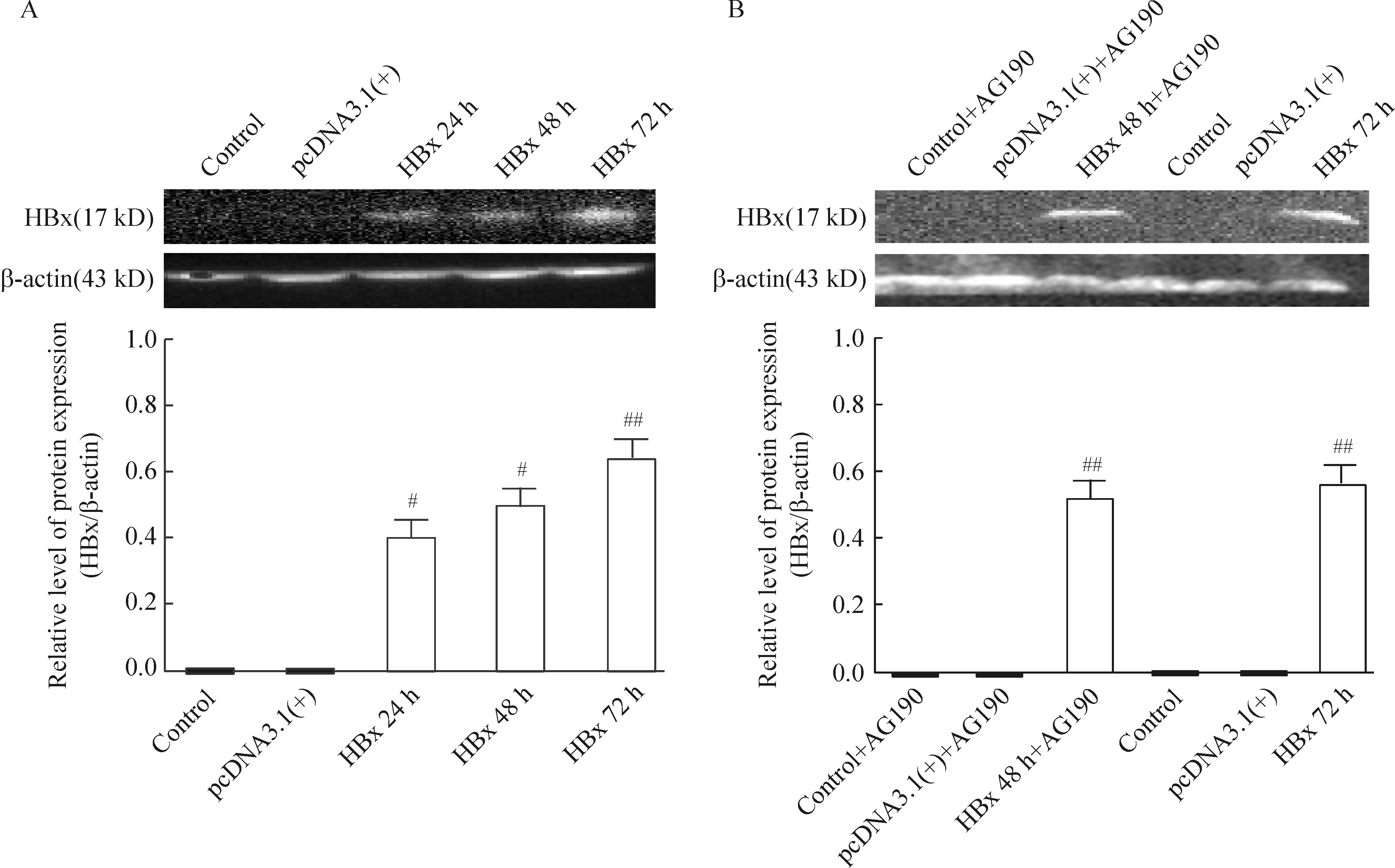
Figure 2. Protein expression of HBx in HK-2 cells at different time points after transfection (A) and in the presence or absence of AG490 (B) detected by Western blotting. Mean±SD. n=5. #P<0.05, ##P<0.01 vs control.

Figure 3. Morphological changes of the HK-2 cells with different treatments observed under inverted microscope (×100).
3 转染目的基因HBx后,p-JAK2及p-STAT3水平明显增高;加用AG490后,p-JAK2及p-STAT3水平较前明显下降
Western blotting分析显示对照组细胞中JAK2和STAT3均有表达,且JAK2及STAT3有少量磷酸化,转染空质粒组与对照组无明显差异(P>0.05)。转染pcDNA3.1(+)-HBx 后24 h,p-JAK2及p-STAT3的表达均明显增高,至转染72 h达到高峰;转染pc-DNA3.1(+)-HBx后各组间及与对照组间均有显著差异(P<0.05)。JAK2及STAT3在转染后24 h表达也明显增高,随着转染时间延长,蛋白表达呈现逐渐增强趋势,转染72 h,达到高峰。各组间及与对照组比较,均有显著差异(P<0.05),见图4。
细胞免疫荧光观察结果显示STAT3和 p-STAT3 2种信号蛋白在各组肾小管上皮细胞均有表达。在对照组中STAT3和p-STAT3 蛋白均主要表达于胞浆,且p-STAT3 蛋白表达很弱;转染pcDNA3.1(+)-HBx后各组p-STAT3 蛋白水平均明显增加,并且随时间延长表达增强;在 72 h 时表达水平最高,在胞浆及胞核均有较高表达。转染pcDNA3.1(+)-HBx 24 h后,STAT3蛋白水平亦明显增加,并且随时间延长表达增强,在72 h达高峰,主要在胞浆表达,见图5、6。
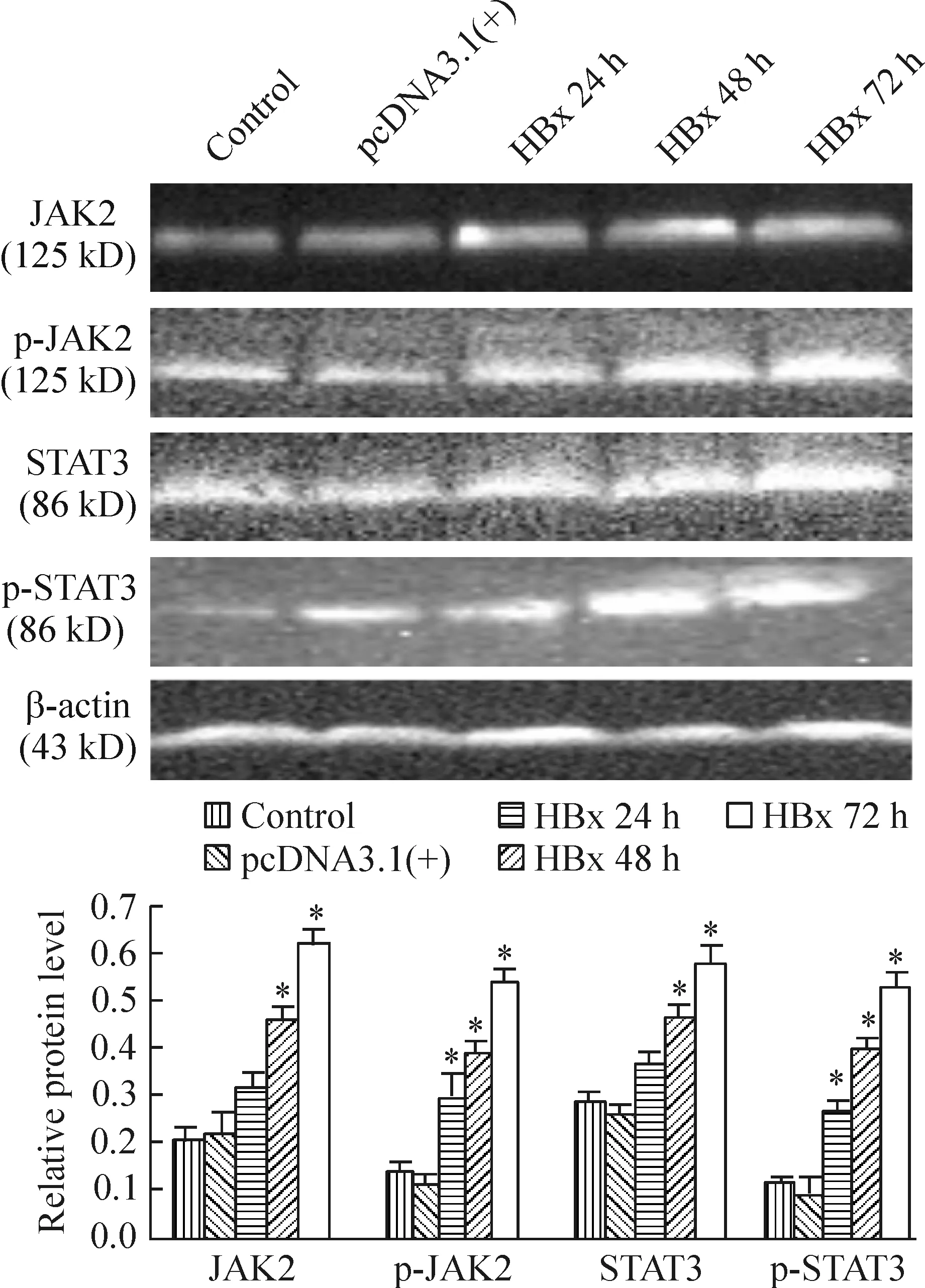
Figure 4. The protein expression of JAK2, p-JAK2, STAT3 and p-STAT3 in HK-2 cells at different time points after transfection with HBx (detected by Western blotting). Mean±SD. n=4. *P<0.05 vs control.
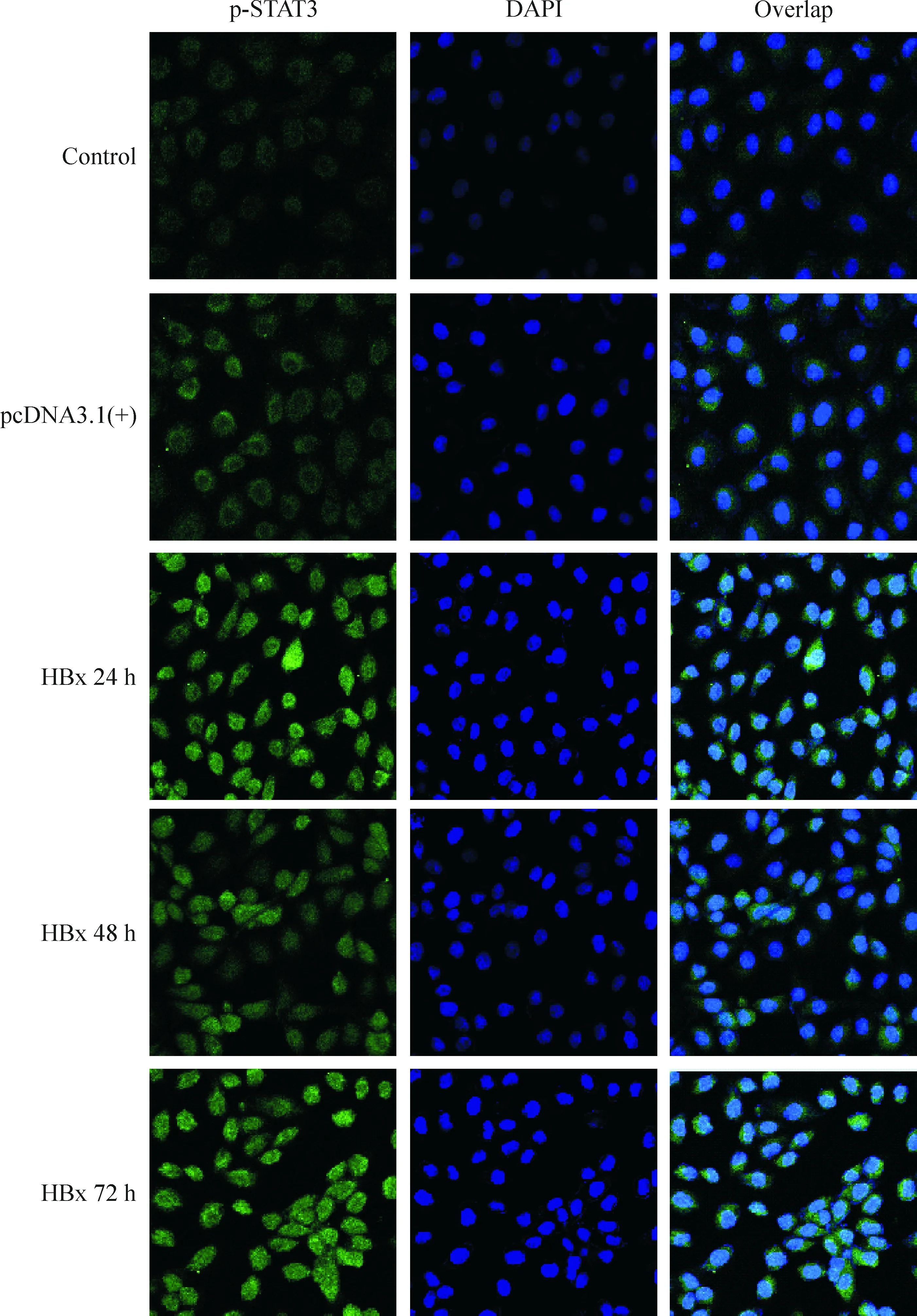
Figure 5. Immunofluorescence observation of p-STAT3 expression in HK-2 cells at different time points after transfection with HBx (×400).
加用AG490孵育后(HBx 48 h+AG490组),与未加入组(HBx 48 h组)相比, p-JAK2、p-STAT3、JAK2及STAT3的表达均有所下降(P<0.05)。而对照组、转染空质粒组、对照组+AG490组及转染空质粒+AG490组上述4种信号蛋白的表达无明显差异(P>0.05),见图7。
4 转染目的基因HBx对HK-2细胞增殖的作用
设对照组细胞生存率为100%。转染空质粒组细胞生存率与对照组无明显差别(P>0.05),提示对细胞无明显增殖抑制作用。转染pcDNA3.1(+)-HBx 24 h 后,细胞生存率明显下降,提示HBx对细胞增殖有抑制作用,抑制率为(14.08±2.14)%,与对照组相比,差异显著(P<0.05)。转染pcDNA3.1-(+)HBx 48 h 后,细胞的增殖抑制率显著增加,达到(31.33±2.24)%,与对照组和转染pcDNA3.1(+)-HBx 24 h组比较,差异显著(P<0.05)。转染72 h后,细胞的增殖抑制率达到(35.27%±1.10)%,与对照组和转染pcDNA3.1(+)-HBx 24 h组比较,差异显著(P<0.05);但与转染48 h组比较无明显差异(P>0.05),见图8。
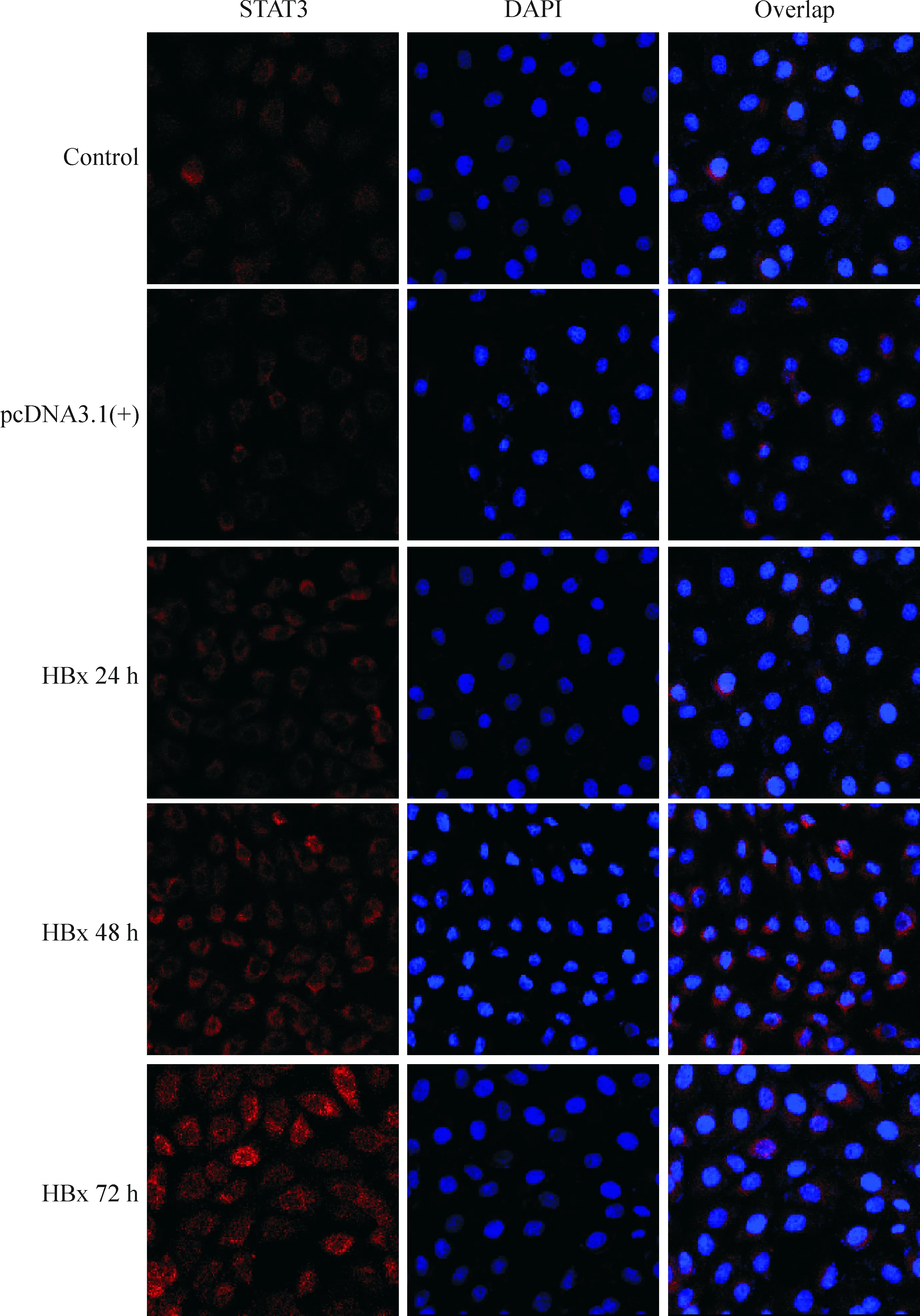
Figure 6. Immunofluorescence observation of STAT3 expression in HK-2 cells at different time points after transfection with HBx (×400).
5 转染目的基因HBx引起肾小管上皮细胞凋亡
应用Hoechst 33342染色、透射电镜及流式细胞术等方法检测转染pcDNA3.1(+)及pcDNA3.1(+)-HBx后HK-2细胞的凋亡。图9显示,应用透射电镜观察各组细胞的超微结构。对照组及转染空质粒组的细胞核近于圆形,核仁偏位存在,核膜清晰,胞质内有大量核糖体,线粒体和一些粗面内质网,细胞表面见有微绒毛。转染目的基因HBx后24 h组、48 h组和72 h组可见核仁不规则,有凹陷,核膜水肿,核内异染色质凝聚、边集。凋亡晚期有核膜溶解,核碎裂。应用Hoechst 33342染色观察各组细胞转染后凋亡形态学改变,见图10A。对照组及转染空质粒的HK-2细胞核轮廓清晰,细胞核正常,可见核分裂。pcDNA3.1(+)-HBx 转染24 h组、48 h组和72 h组HK-2可见核碎裂、固缩,部分核溶解,染色质边集等,并且随着转染时间延长,细胞数量明显减少,细胞核改变加重。图10A中的白色椭圆形圈出典型的凋亡核改变,其放大图像见图10B。
流式细胞术结果显示,对照组HK-2细胞的凋亡率为 (5.81±1.62)%;转染空质粒组细胞的凋亡率为 (5.92±1.09)%;转染pcDNA3.1(+)-HBx 24 h组细胞的凋亡率为(15.18±1.98)%;转染pcDNA3.1(+)-HBx 48 h组细胞的凋亡率为(20.62±2.23)%;转染pcDNA3.1(+)-HBx 72 h组细胞的凋亡率为 (23.83±2.16)%。转染空质粒组凋亡率较对照组无明显变化。转染pcDNA3.1(+)-HBx 24 h后细胞的凋亡率较对照组显著增高,差异显著(P<0.05)。其中,转染48 h组较转染24 h组凋亡率显著增高,差异显著(P<0.05)。但转染后48 h与转染后72 h无显著差异(P>0.05),见图11。
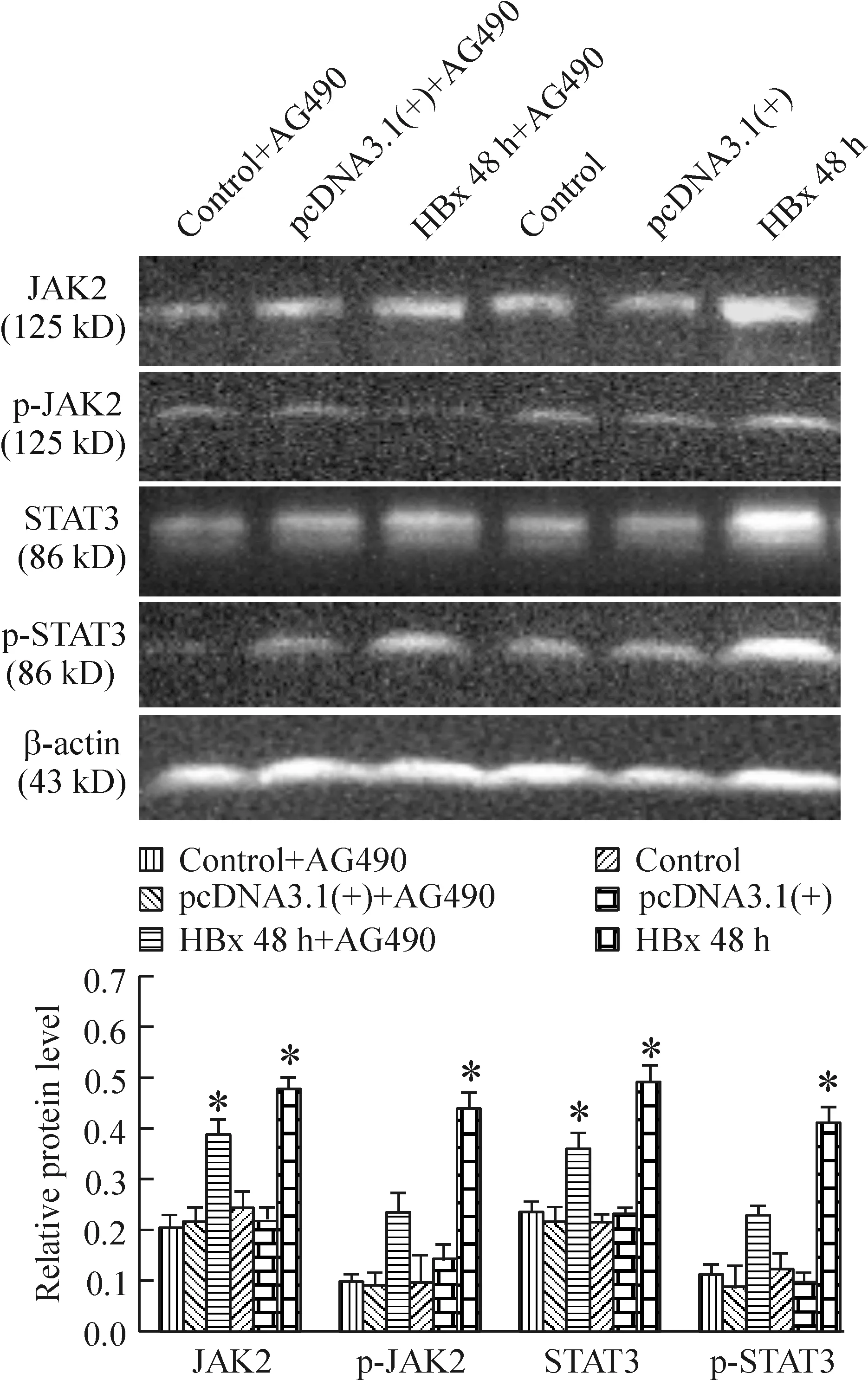
Figure 7. The effects of AG490 on the protein expression of JAK2, p-JAK2, STAT3 and p-STAT3 in HK-2 cells at 48 h after transfection with HBx. Mean±SD. n=6. *P<0.05 vs control.
图12显示,对照组细胞的凋亡率为(8.62±1.58)%;转染空质粒组细胞的凋亡率为(8.34±1.25)%;对照组+AG490组细胞的凋亡率为(6.30±2.01)%;转染空质粒组+AG490组细胞的凋亡率为(7.39±1.74)%;对照组及转染空质粒组加与不加AG490凋亡率无明显差异(P>0.05)。转染pcDNA3.1(+)HBx 48 h后细胞的凋亡率显著增加,为(23.85±1.42)%;加用AG490孵育后细胞凋亡率显著下降为(14.34±2.63)%,但与对照组相比凋亡率仍明显增高,均有显著差异(P<0.05)。
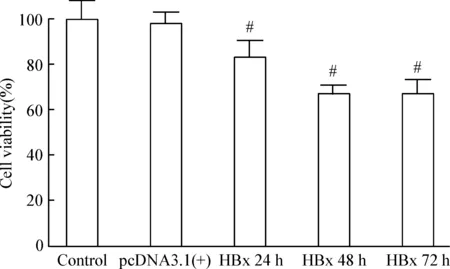
Figure 8. Effect of HBx gene transfection on the viability of HK-2 cells. Mean±SD. n=5. #P<0.05 vs control.
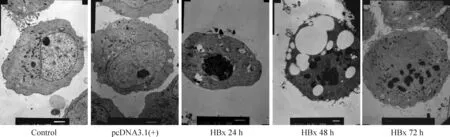
Figure 9. Ultrastructural changes of the HK-2 cells at different time points after transfection with HBx observed under transmission electronic microscope (×4 000).
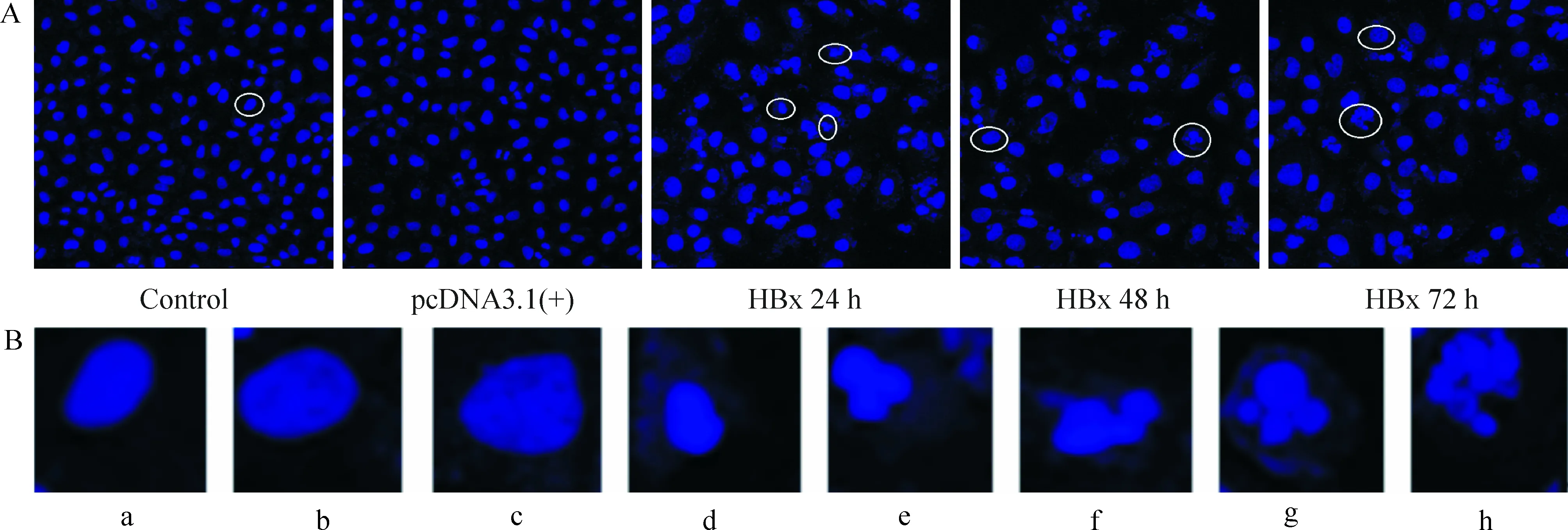
Figure 10. Hoechst 33342 staning revealed apoptotic morphologic variations in the HK-2 cells transfected with HBx gene. A:the white ovals indicate the typical apoptotic changes of the nuclear morphology (×400); B: image amplification of the areas in the white ovals from A. a: normal nucleus; b~h: apoptotic nuclei.
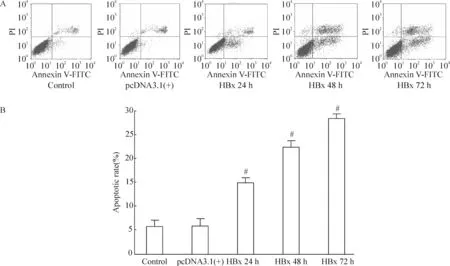
Figure 11. The apoptotic rates of the HK-2 cells at different time points after transfection with HBx gene determined by flow cytometry. Mean±SD. n=5. #P<0.05 vs control.
讨 论
HBVGN已被公认为是HBV感染引起的最常见肝外病变, 其发病机制至今尚未完全阐明。近年来有较多研究报道HBV相关核酸分子在肾组织病变的关系,发现HBVGN患者肾脏中存在HBV-DNA,HBV-RNA 和闭合环状双链DNA(cccDNA),甚至完整的病毒颗粒[20-22],进一步支持了HBV可直接感染肾脏并原位复制而致病的观点。
既往Clippinger等[3,23]利用原代培养肝细胞,先后研究HBx蛋白在线粒体的定位及对肝细胞凋亡的影响。结果发现,在肝细胞中,HBx既能抗凋亡又能刺激凋亡,主要是根据NF-κB信号通路的状态。但针对肾小管上皮细胞,HBx蛋白与肾小管上皮细胞凋亡之间的关系及其信号通路迄今为止尚未明确。
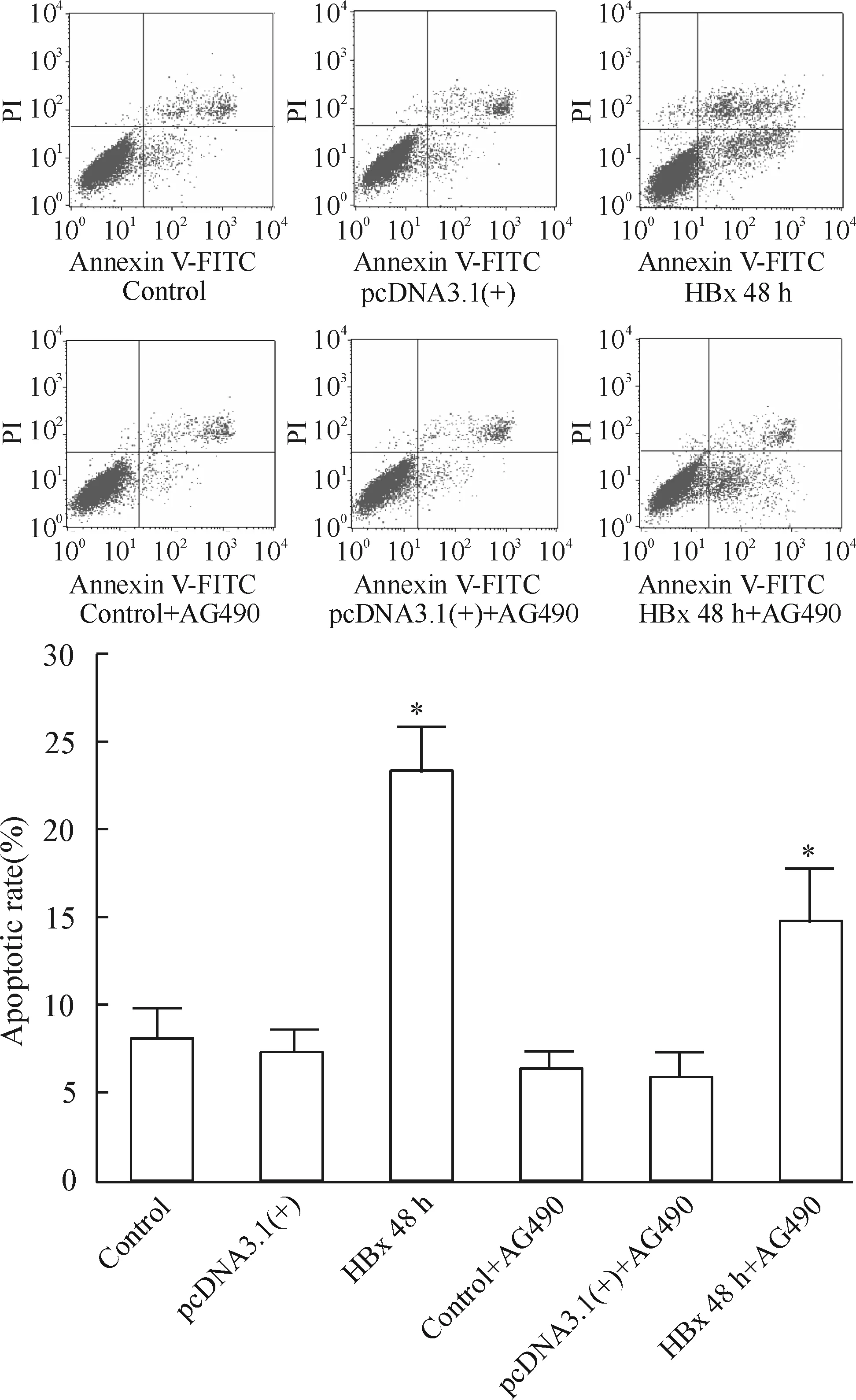
Figure 12. The effect of AG490 on the cell apoptotic rates in the HK-2 cells tranfected with HBx gene. Mean±SD. n=6. *P<0.05 vs control.
凋亡是由体内外因素触发细胞内预存的死亡程序而导致的细胞程序性死亡,是从细胞外信号短-细胞内信号通路短-凋亡相关基因和酶作用的复杂过程[25]。各种细胞外因素对细胞行为的调节主要与细胞内多种信号转导通路的活化密切相关,其中JAK/STAT途径近年来倍受关注。JAK/STAT信号途径是细胞因子转导的重要通路之一,对细胞的生理和病理反应发挥着重要的调控作用[25]。
为了验证JAK2/STAT3信号通路活化与HBx蛋白之间的关系,我们将HBx基因转染至体外培养的肾小管上皮细胞(HK2细胞株)中,应用免疫细胞化学及Western blotting方法检测JAK2/STAT3信号通路活化。结果显示,在体外,HBx可以增加p-STAT3表达,活化JAK2/STAT3信号通路。进一步验证了JAK2/STAT3信号通路活化参与了HBVGN的发生发展。
Deng等[26-27]用HBV-DNA阳性血清体外培养人肾小管上皮细胞,可诱导其凋亡;且细胞凋亡比例与HBV的DNA水平呈正相关。不可控制的肾小管上皮细胞凋亡会引起肾脏损伤进而可能导致肾间质纤维化的发生[28]。在本研究中,质粒转染 体外培养细胞实验更深入证实了HBx能够导致HK2细胞凋亡,且凋亡与JAK2/STAT3信号通路活化有关。最近,一些学者认为细胞的密度或者融合状态可能会影响不同细胞的生物学行为和反应,包括细胞凋亡等[29-30]。而在本研究中,所有实验均在细胞亚融合状态下完成(约70%融合度),且设置了空载体转染对照组,所以我们得出的结果是可信的。
为了进一步证明JAK2/STAT3信号通路活化确实参与了肾小管上皮细胞的凋亡,我们在实验中使用了JAK/STAT信号通路阻断剂AG490。AG490是JAK2特异性抑制剂,可有效抑制JAK2酪氨酸磷酸化并且阻断其下游的信号转导和转录活化因子STAT的活化[31]。AG490处理后,HBx基因转染所致HK-2细胞凋亡率明显下降;与此同时,p-JAK2及p-STAT3表达水平均有所降低。这些结果说明JAK/STAT信号通路活化参与了HBV感染所致肾脏损伤中。
总之,我们的研究表明,JAK2/STAT3信号通路活化参与到HBx致肾小管上皮细胞凋亡过程中。并为HBVGN发病机制中病毒直接损伤作用提供了实验依据。
[参 考 文 献]
[1] He P, Zhang D, Li H, et al. Hepatitis B virus X protein modulates apoptosis in human renal proximal tubular epithelial cells by activating the JAK2/STAT3 signaling pathway[J]. Int J Mol Med, 2013, 31(5):1017-1029.
[2] 何 平,冯国和. 乙型肝炎病毒相关性肾炎中病毒直接损伤肾组织作用机制研究现状[J]. 中华传染病杂志, 2012, 30(2):123-126.
[3] Clippinger AJ, Gearhart TL, Bouchard MJ. Hepatitis B virus X protein modulates apoptosis in primary rat hepatocytes by regulating both NF-κB and the mitochondrial permeability transition pore[J]. J Virol, 2009, 83(10):4718-4731.
[4] Tang RX, Kong FY, Fan BF, et al. HBx activates FasL and mediates HepG2 cell apoptosis through MLK3-MKK7-JNKs signal module[J]. World J Gastroenterol, 2012, 18(13):1485-1495.
[5] Bouehard MJ, Sehneider RJ. The enigmatic X gene of hepatitis B virus[J]. J Virol, 2004, 78(23):12725-12734.
[6] 崔利园,张钊瑞,费洪荣,等. 乙肝病毒蛋白相互作用蛋白促进HepG2细胞迁移并调节β-catenin表达[J]. 中国病理生理杂志, 2012, 28(6):1128-1131.
[7] 陈林林,谢 青,单晓亮,等. 乙型肝炎病毒X蛋白抑制SFRP5启动子的活性[J]. 中国病理生理杂志, 2013, 29(2):200-204.
[8] Lee YI, Kang-Parks, Do SI, et al. The hepatitis B virus-X protein activates a phosphatidylinositol 3-kinase-dependent survival signaling cascade[J]. J Biol Chem, 2001, 276(20):16969-16977.
[9] Cheng ZD,Liu MY,Chen G, et al.Anti-vascular permeability of the cleaved reactive center loop within the car-boxyl-terminal domain of C1 inhibitor[J]. Mol Immunol, 2008, 45(6):1743-1751.
[10] Fu J, Lin G,Wu Z, et al. Anti-apoptotic role for C1 inhibitor in ischemia/reperfusion-induced myocardial cell injury[J]. Biochem Biophys Res Commun, 2006, 349(2):504-512.
[11] Davis AE, Cai S, Liu D. C1 inhibitor:biologic activities that are independent of protease inhibiology[J]. Immunobilolgy, 2007, 212(4-5):313-323.
[12] Kaushal GP, Basnakian AG, Shah SV. Apoptotic pathways in ischemic acute failure[J]. Kidney Int, 2004, 66(2):500-506.
[13] Kang BP, Urbonas A,Baddoo A, et al. IGF-1 inhibits the mitochondrial apoptosis program in mesangial cells exposed to high glucose[J]. Am J Physiol Renal Physiol, 2003, 285(5):F1013-F1024.
[14] Qiu LQ, Sinniah R, I-Hong Hsu S. Downregulation of Bcl-2 by podocytes is associated with progressive glomerular injury and clinical indices of poor renal prognosis in human IgA nephropathy[J]. J Am Soc Nephrol, 2004, 15(1):79-90.
[15] Ortiz A, Justo P, Sanz A, et al. Tubular cell apoptosis and cidofovir-induced acute renal failure[J]. Antivir Ther, 2005, 10(1): 185-190.
[16] Nestoridi E, Kushak RI, Duguerre D, et al. Up-regulation of tissue factor activity on human proximal tubular epithelial cells in response to Shiga toxin[J]. Kidney Int, 2005, 67(6):2254-2266.
[17] 于 艳,王汉民,张 静,等. NF-κB/IκB信号通路在乙型肝炎病毒相关性肾炎肾组织中的表达[J]. 细胞与分子免疫学杂志,2006, 22(3): 327-329.
[18] 孙莉静,于建平,袁伟杰,等. Bcl-2和Bax在乙型肝病病毒相关性肾炎患者肾组织中的表达[J].第二军医大学学报,2007, 28(5):492-494.
[19] 张 瑜, 周建华. 乙型肝炎病毒相关性膜性肾病肾组织细胞凋亡的意义[J]. 华中科技大学学报: 医学版, 2008, 37(1):77-80,96.
[20] Venkataseshan VS, Lieberman K, Kim DU, et al. Hepatitis-B-associated glomerulonephritis: pathology, pathogenesis, and clinical course[J]. Medicine (Baltimore), 1990, 69(4):200-216.
[21] He XY, Fang LJ, Zhang YE, et al. In situ hybridization of hepatitis B DNA in hepatitis B-associated glomerulonephritis[J]. Pediatr Nephrol, 1998, 12(2):117-120.
[22] Lai KN, Ho RT, Tam JS, et al. Detection of hepatitis B virus DNA and RNA in kidneys of HBV-related glomerulonephritis[J]. Kidney Int, 1996, 50(6):1965-1977.
[23] Clippinger AJ, Bouchard MJ. Hepatitis B virus HBx protein localizes to mitochondria in primary rat hepatocytes and modulates mitochondrial membrane potential[J]. J Virol, 2008, 82(14):6798-6811.
[24] Wyllie AH, Kerr JF, Currie AR. Cell death: the significance of apoptosis[J]. Int Rev Cytol, 1980, 68:251-306.
[25] Gough DJ,Levy DE,Johnstone RW, et al. IFNγ signaling: dose it mean JAK/STAT?[J]. Cytokine Growth Factor Rev, 2008, 19(5-6):383-394.
[26] 邓存良,宋新文,盛云健,等. HBV-DNA阳性血清对体外肾小管上皮细胞表型转化的影响[J].寄生虫病与感染性疾病, 2004, 2(4):152-154.
[27] Deng CL, Song XW, Liang HJ, et al. Chronic hepatitis B serum promotes apoptotic damage in human renal tubular cells[J]. World J Gastroenterol, 2006, 12(11):1752-1756.
[28] Huang H, Ma C, Yang M, et al. Adrenomedullin impairs the profibrotic effects of transforming growth factor-beta1 through recruiting Smad6 protein in human renal tubular cells[J]. Cell Physiol Biochem, 2005, 15(1-4):117-124.
[29] Hneino M, Bouazza L, Bricca G, et al. Density-depen-dent shift of transforming growth factor-beta-1 from inhibition to stimulation of vascular smooth muscle cell growth is based on unconventional regulation of proliferation, apoptosis and contact inhibition[J]. J Vasc Res, 2009, 46(2):85-97.
[30] Bar J, Cohen-Noyman E, Geiger B, et al. Attenuation of the p53 response to DNA damage by high cell density[J]. Oncogene, 2004, 23(12):2128-2137.
[31] Banes AK, Shaw S, Jenkins J, et al. Angiotensin II blockade prevents hyperglycemia-induced activation of JAK and STAT proteins in diabetic rat kidney glomeruli[J]. Am J Physiol Renal Physiol, 2004, 286(4):F653-F659.
