miRNA-24对内皮型一氧化氮合酶表达调节及血管内皮细胞增殖的影响*
2014-08-09张文宇李玉媚欧和生
张文宇, 王 辉, 李玉媚, 陈 伟, 胡 楠, 欧和生
(广西医科大学药学院, 广西 南宁 530021)
微小RNA(miRNA)是长约22 nt的一类高度保守的内源性非编码单链小RNA,其通过序列特异性方式调控mRNA的降解或抑制蛋白质翻译。约有30%人类基因的表达受到miRNAs的精细调控[1]。近年来研究表明,某些miRNAs参与血管内皮细胞分化、增殖与凋亡的过程[2-3];更重要的是,这类miRNAs不但与内皮细胞的生理功能密切相关,而且参与心血管疾病的发生与发展[4-5]。
内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)作为限速酶介导内皮细胞生成NO,后者在维持血管正常舒张功能、内皮损伤后的修复以及血小板聚集的抑制等方面起着至关重要的作用[6-8]。人类eNOS基因位于7q35~36,其核心启动子区域包含多个顺式作用元件,其中就包括了一些核转录因子的高亲和力结合位点,例如Sp1。作为重要的核转录因子,Sp1通过增强eNOS基因的转录活性诱导内皮细胞增殖[9]。令人感兴趣的是, 新近有研究提示miRNA-24参与Sp1的表达调控[10]。为探讨miRNA-24 对内皮细胞增殖的影响及其对eNOS表达调控作用,本实验利用脂质体将构建的miRNA-24高表达质粒转染人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),观测HUVECs的增殖情况,并检测核转录因子Sp1与eNOS mRNA及蛋白表达的变化情况。
材 料 和 方 法
1 材料
人类脐静脉内皮细胞购自美国标准生物品收藏中心(ATCC);改良型RPMI-1640 细胞培养基[海克隆生物化学制品(北京)有限公司];Gibco 公司胎牛血清(天津灏洋生物有限公司);载体miRNASelectTMpEGP-miR(Cell Biolabs);质粒提取试剂盒[天根生化科技(北京)有限公司];LipofectamineTM2000 转染试剂盒(Invitrogen);总RNA 提取试剂盒(TRIzol法;北京百泰克生物技术有限公司);RT试剂盒(MBI);PCR 试剂盒(天根生化科技有限公司);引物合成及Sp1高表达质粒[宝成生物工程(大连)有限公司];eNOS兔源单克隆抗体(Cell Signaling)。
2 方法
2.1miRNA-24的构建和鉴定 miRNA-24序列(来自http://www. miRbase.org)为5’-UGGCUCAGUUCAGCAGGAACAG-3’;通过DNA合成技术得到第1链DNA,利用DNA连接反应合成相应的双链DNA,最后将扩增后体外重组的DNA插入pEGP-miR载体转化入E.coliDH5α宿主菌,将1.5 mL菌液(经酶切初步证实插入正确的单克隆菌落)提取质粒DNA寄上海生工进行DNA 序列测定。
2.2HUVECs的培养和转染 HUVECs用含有1×105U/L青霉素、100 mg/L链霉素、10%胎牛血清的RPMI-1640培养液培养,置于37 ℃、5% CO2、饱和湿度培养箱中。选用LipofectamineTM2000脂质体作为介质,转染4 h后更换含有10%胎牛血清的RPMI-1640培养液,培养24 h观察免疫荧光。根据转染质粒将实验细胞分为miRNA-24表达组、 miRNA-24抑制(anti-miRNA-24)组和质粒对照组。
2.3MTT法检测细胞增殖 取对数生长期的HUVECs至96孔板,分别在每孔接种2×103个细胞,待细胞达到50%融合时更换无血清培养基培养24 h实现细胞同步生长。分别于不同时段加入MTT继续培养4 h,使用酶联免疫检测仪在570 nm的波长下测定吸光度,按生长抑制率(%)=(1-实验组A570值/对照组A570值)×100% 的公式计算细胞生长抑制率。
2.4免疫组化检测转染前后eNOS和Sp1的表达 将无菌玻片放入24孔板,加入细胞(每孔2×104个HUVECs)培养24 h,更换转染剂培养4 h,转染成功后取爬片,PBS冲洗3次,中性树脂粘片,4%甲醛固定。用TritonX-100(10 min)和3%过氧化氢(30 min)处理后双蒸水冲洗3次,敷Ⅰ抗、Ⅱ抗后显色剂显色。
2.5RT-PCR检测转染前后eNOS和Sp1 mRNA的表达 按照TRIzol试剂盒说明书提取各实验组的细胞总RNA。利用Primer 5.0软件设计合成人eNOS、Sp1以及β-actin的引物,序列见表1。 取细胞总RNA 1 μg,加入1.0 μL(0.5 g/L)Oligo(dT)18引物,70 ℃变性5 min,迅速置于冰上冷却。加入4 μL 5×reaction buffer,1 μL RiboLockTMRibonuclease Inhibitor (20 U/μL),2 μL 10 mmol/L dNTP Mix,37 ℃温育5 min,加入1 μL 逆转录酶,42 ℃ 1 h,之后70 ℃ 10 min终止反应,合成cDNA第1条链。PCR 扩增反应:94 ℃预变性5 min后,开始30 个循环:94 ℃ 30 s、56 ℃ 1 min、72 ℃ 1 min;最后72 ℃ 5 min,终止反应。取5 μL PCR产物进行1.5%琼脂糖凝胶电泳分析。
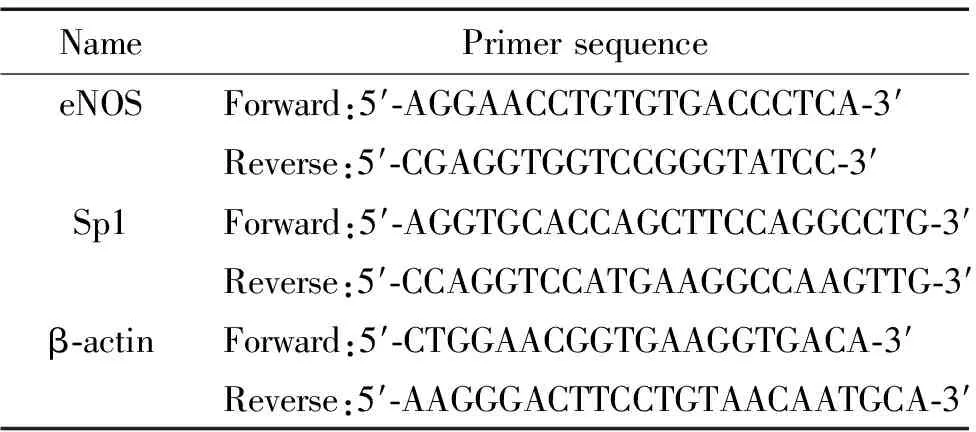
表1 引物序列
2.6Western blotting检测eNOS和Sp1蛋白的表达 将成功转染的细胞裂解,12 000 r/min、4 ℃离心15 min,取上清。各实验组分别取蛋白30 μg进行SDS-PAGE(8%)分离并转至PVDF膜上。经脱脂奶粉封闭1 h后加入eNOS和Sp1 Ⅰ抗过夜(4 ℃)。TBST冲洗3次(每次10 min),加入Ⅱ抗(辣根过氧化物酶标记)孵育,1 h后重复用TBST冲洗(方法同上)。利用LI-COR公司的Odyssey红外荧光扫描成像系统分析。
3 统计学处理
实验重复3次,数据以均数±标准差(mean±SD)表示,采用SPSS 16.0统计软件进行t检验。以P<0.05为差异有统计学意义。
结 果
1 miRNA-24对HUVECs增殖的影响
与对照组比较,miRNA-24表达组细胞数目72 h明显减少54.06% (7.97±0.15vs17.35±0.40,P<0.01),miRNA-24抑制组细胞数目降低29.56% (12.22±0.22vs17.35±0.40,P<0.01);而与miRNA-24表达组比较,miRNA-24抑制组细胞数目则增加34.77%(12.22±0.22vs7.97±0.15,P<0.01)。转染12 h、24 h及48 h后的结果与上述结果类似,见图1。
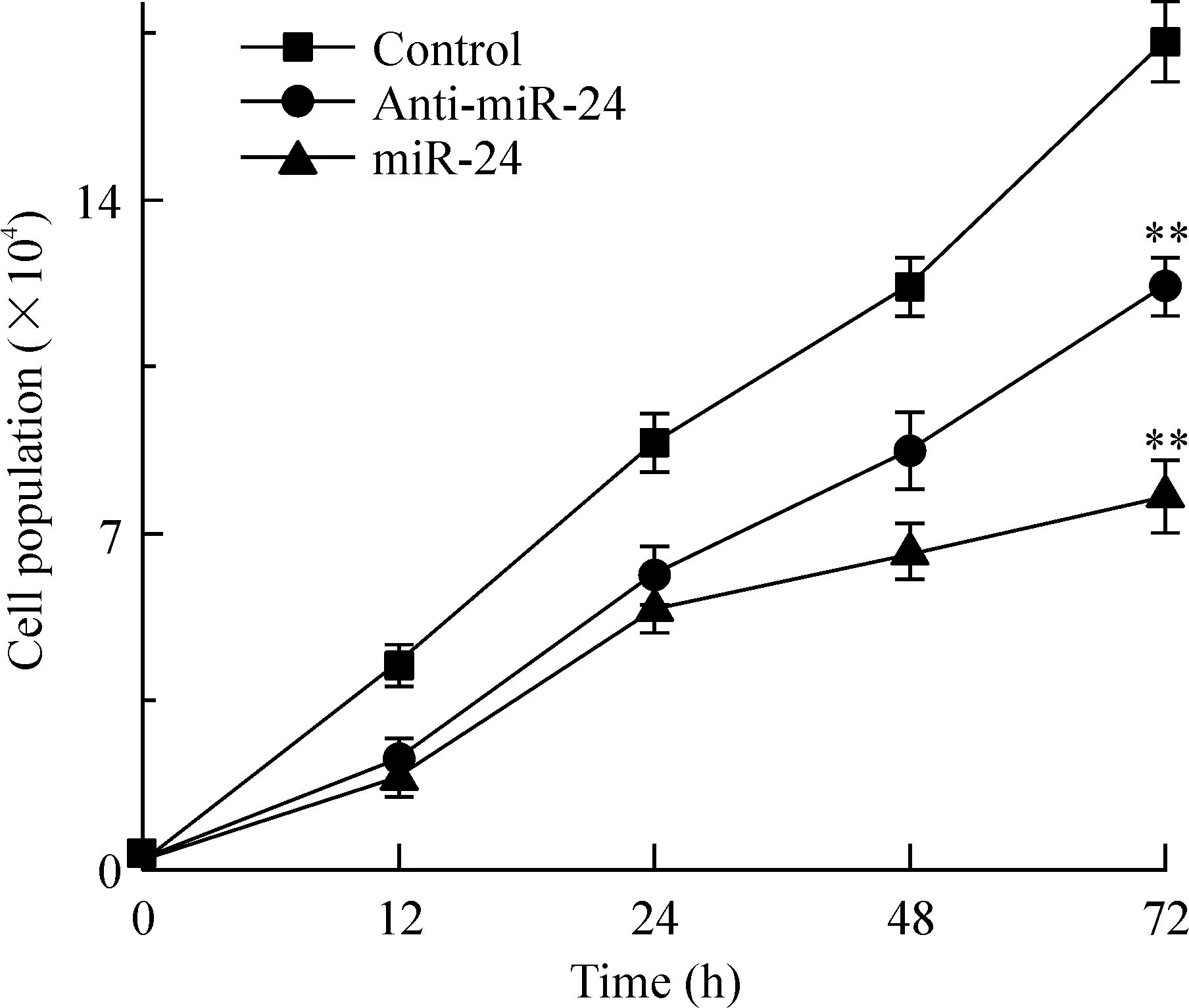
Figure 1. Effect of miR-24 on endothelial cell growth. The number of endothelial cells was obtained by blood cell counting chamber.Mean±SD.n=3.**P<0.01 vs control group.
用MTT法分别检测以上3组细胞在转染后不同时间段细胞增殖的情况如图2所示,miRNA-24表达组细胞增殖明显受到抑制,72 h miRNA-24表达组的细胞抑制率最大,与对照组相比降低41.97%(0.47±0.04vs0.81±0.03,P<0.05),miRNA-24抑制组降低17.28%(0.67±0.04vs0.81±0.03,P<0.05)。结果表明,miRNA-24参与抑制HUVECs的增殖。
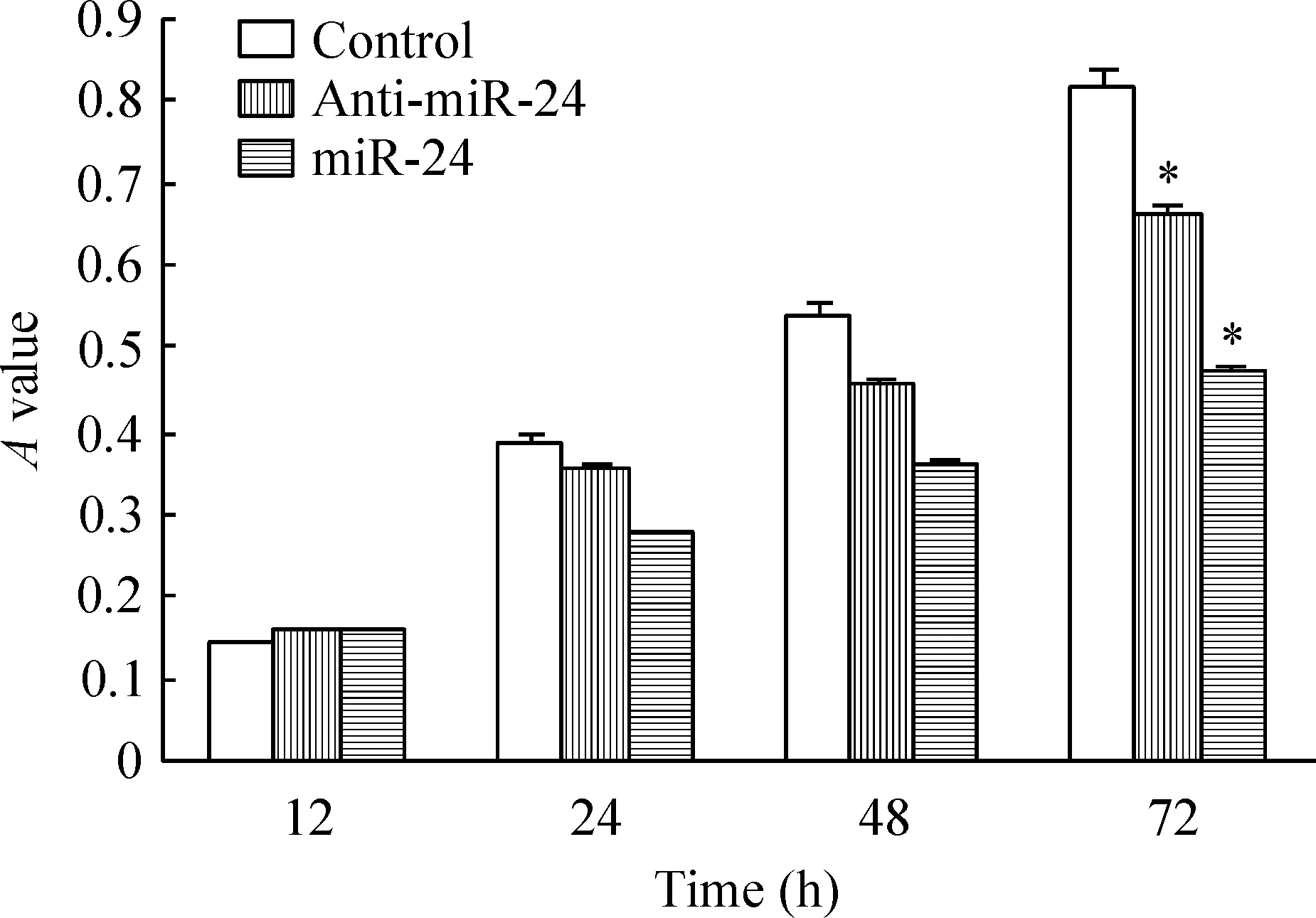
Figure 2. Effect of miR-24 on the proliferation of endothelial cells measured by MTT assay at different time points (12 h, 24 h, 48 h and 72 h). Mean±SD.n=3.*P<0.05 vs control group.
2 miRNA-24对eNOS蛋白表达的影响
免疫组化的结果判定是以棕黄色为阳性,eNOS蛋白表达于细胞浆,eNOS蛋白表达量以对照组最高而miRNA-24表达组则最低,见图3。Western blotting的检测结果显示,与对照组比较,miRNA-24表达组的eNOS蛋白表达量下降71.92% (0.16±0.06vs0.57±0.08,P<0.05),miRNA-24抑制组下降36.84%(0.36±0.07vs0.57±0.08,P<0.05);而与miRNA-24表达组比较,miRNA-24抑制组增加55.56%(0.36±0.07vs0.16±0.06)。以上实验结果显示,miRNA-24对eNOS蛋白表达有影响,见图4。
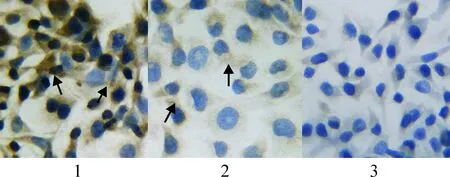
Figure 3. Effect of miRNA-24 on the protein expression of eNOS (immunohistochemical staining,×400).1: control; 2: miRNA-24 inhibitor; 3: miRNA-24. The protein of eNOS was showed in color of brown by the arrows.
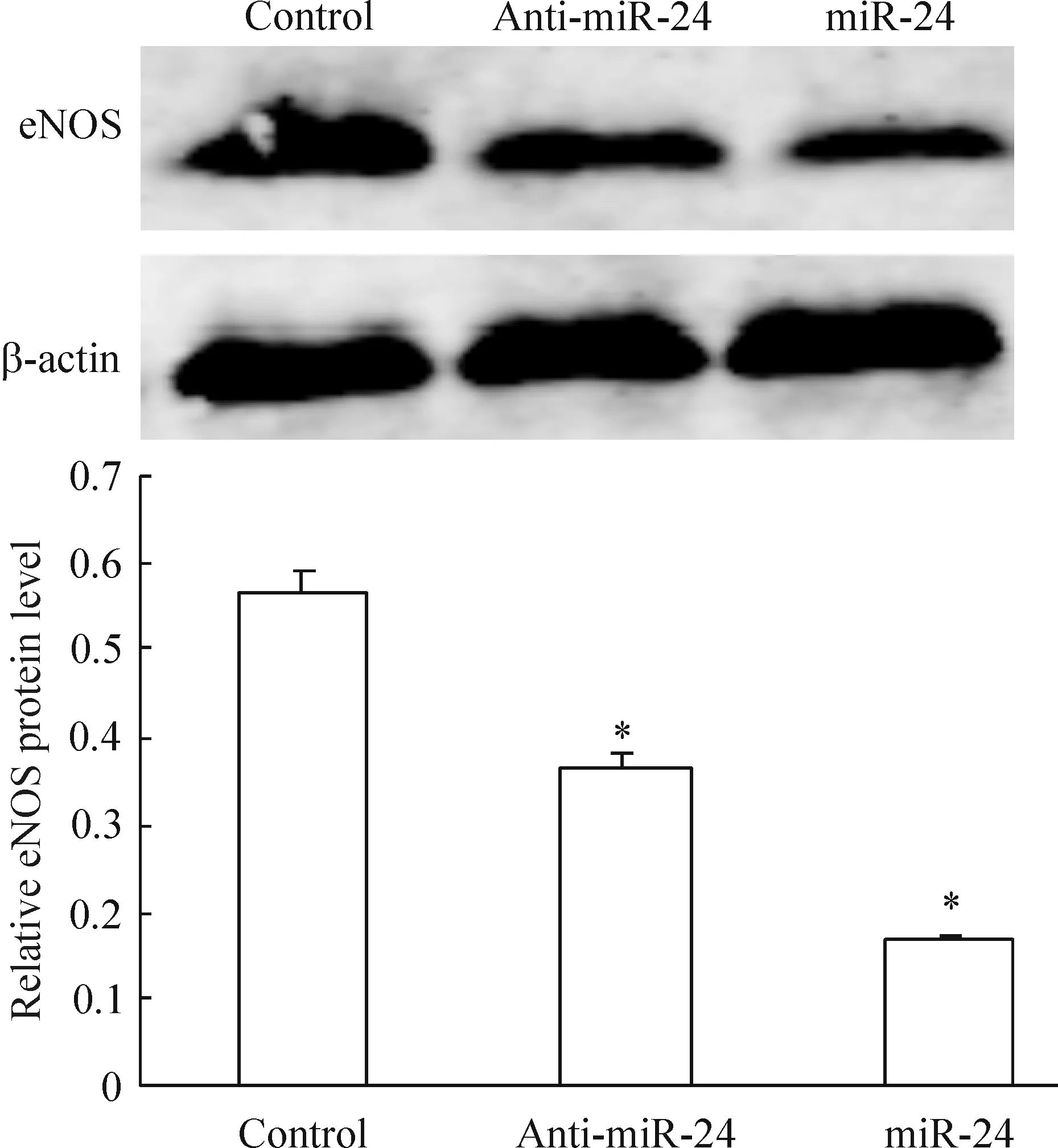
Figure 4. Effect of miR-24 on the protein expression of eNOS detected by Western blotting.Mean±SD.n=3.*P<0.05 vs control group.
3 miRNA-24对eNOS mRNA水平的影响
与对照组比较,miRNA-24高表达组的eNOS mRNA表达量降低44.8% (0.48±0.01vs0.87±0.03,P<0.05),miRNA-24抑制组的eNOS mRNA表达量降低21.8%(0.68±0.02vs0.87±0.03,P<0.05),miRNA-24抑制组则比高表达组增加29.4%(0.68±0.02vs0.48±0.01,P<0.05),见图5。结果显示,miRNA-24抑制eNOS的转录。
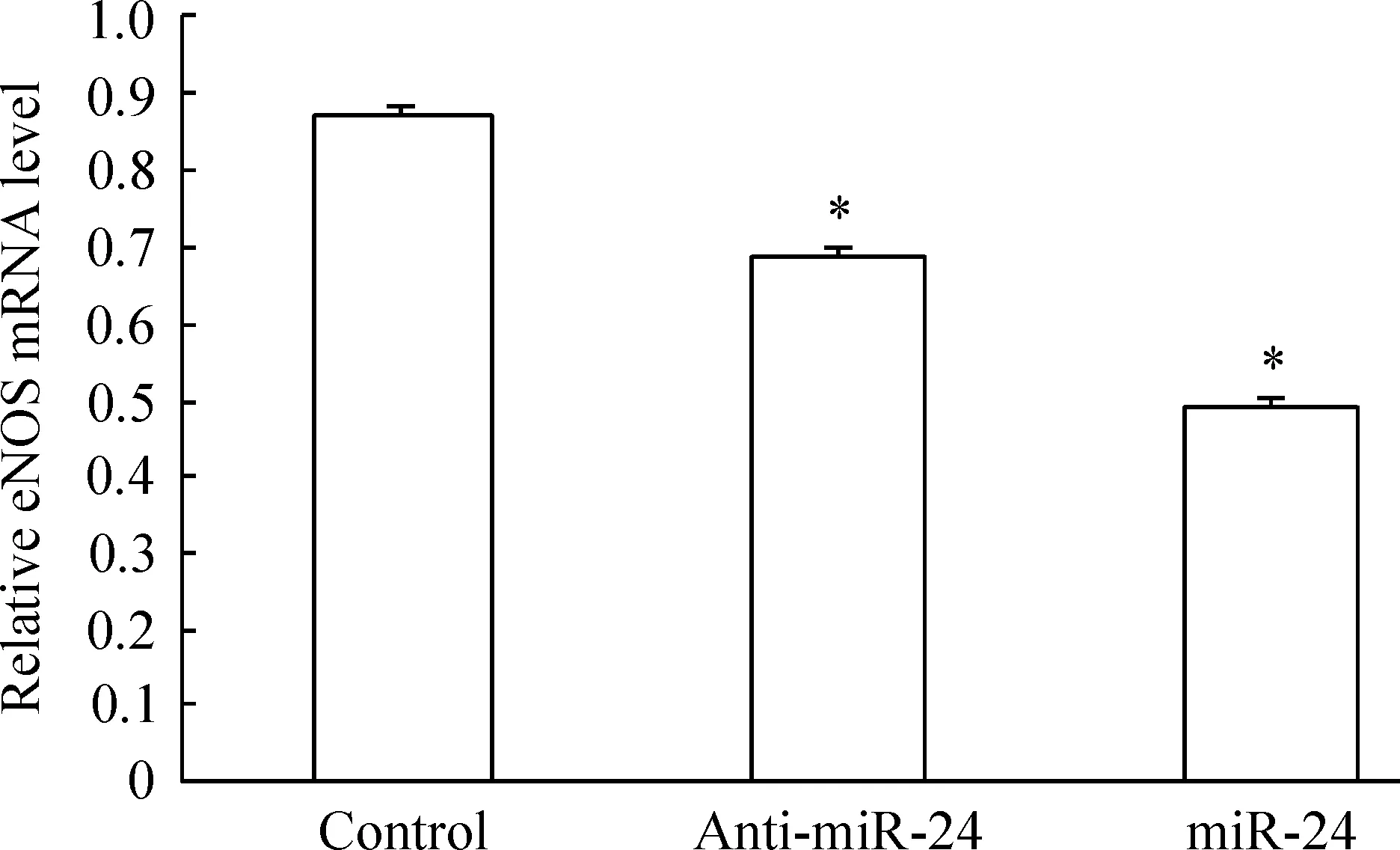
Figure 5. The effect of miRNA-24 on the mRNA expression of eNOS measured by PT-PCR.Mean±SD.n=3.*P<0.05 vs control group.
4 miRNA-24对Sp1蛋白表达的影响
对照组Sp1的表达量最高,相反,miRNA-24表达组的Sp1表达量最低。通过Western blotting对Sp1蛋白表达量进行分析,miRNA-24表达组转录因子Sp1的表达量比对照组下调58.1%(0.13±0.07vs0.31±0.09,P<0.05);miRNA-24抑制组转录因子Sp1的表达量比对照组下调22.6% (0.24±0.06vs0.31±0.09,P<0.05),与miRNA-24表达组比较,抑制组蛋白表达量则增加45.8%(0.24±0.06vs0.13±0.09,P<0.05),见图6、7。结果显示,miRNA-24明显抑制转录因子Sp1的表达。
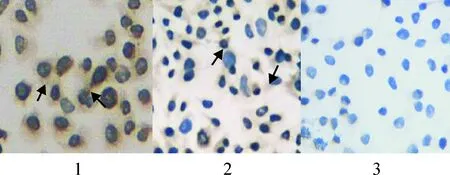
Figure 6. Effect of miR-24 on the protein expression of Sp1 (immunohistochemical staining,×400). 1: control; 2: miR-24 inhibitor; 3: miR-24. The protein expression of Sp1 was showed in color of brown by the arrow.
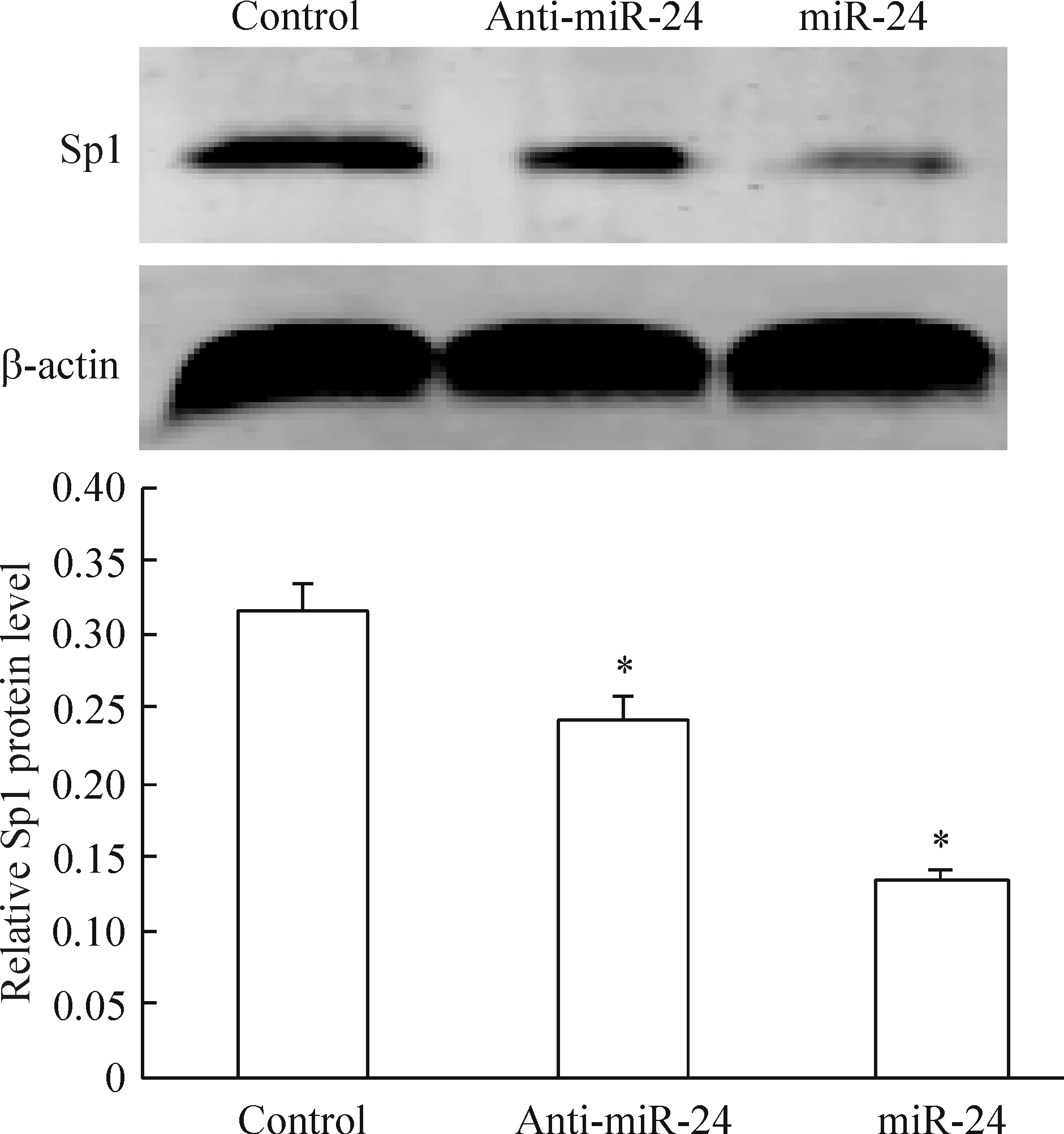
Figure 7. Effect of miR-24 on the protein expression of Sp1 detected by Western blotting.Mean±SD.n=3.*P<0.05 vs control group.
4 miR-24对Sp1 mRNA表达的影响
与对照组比较,miRNA-24高表达组的Sp1 mRNA表达量降低53.00%(0.45±0.02vs0.93±0.01,P<0.05),miRNA-2抑制组的 Sp1 mRNA表达量降低33.33%(0.62±0.03vs0.93±0.01,P<0.05),miRNA-24抑制则比高表达组增加29.00%(0.62±0.03vs0.93±0.01,P<0.05),见图8。结果显示,miRNA-24抑制Sp1的转录。
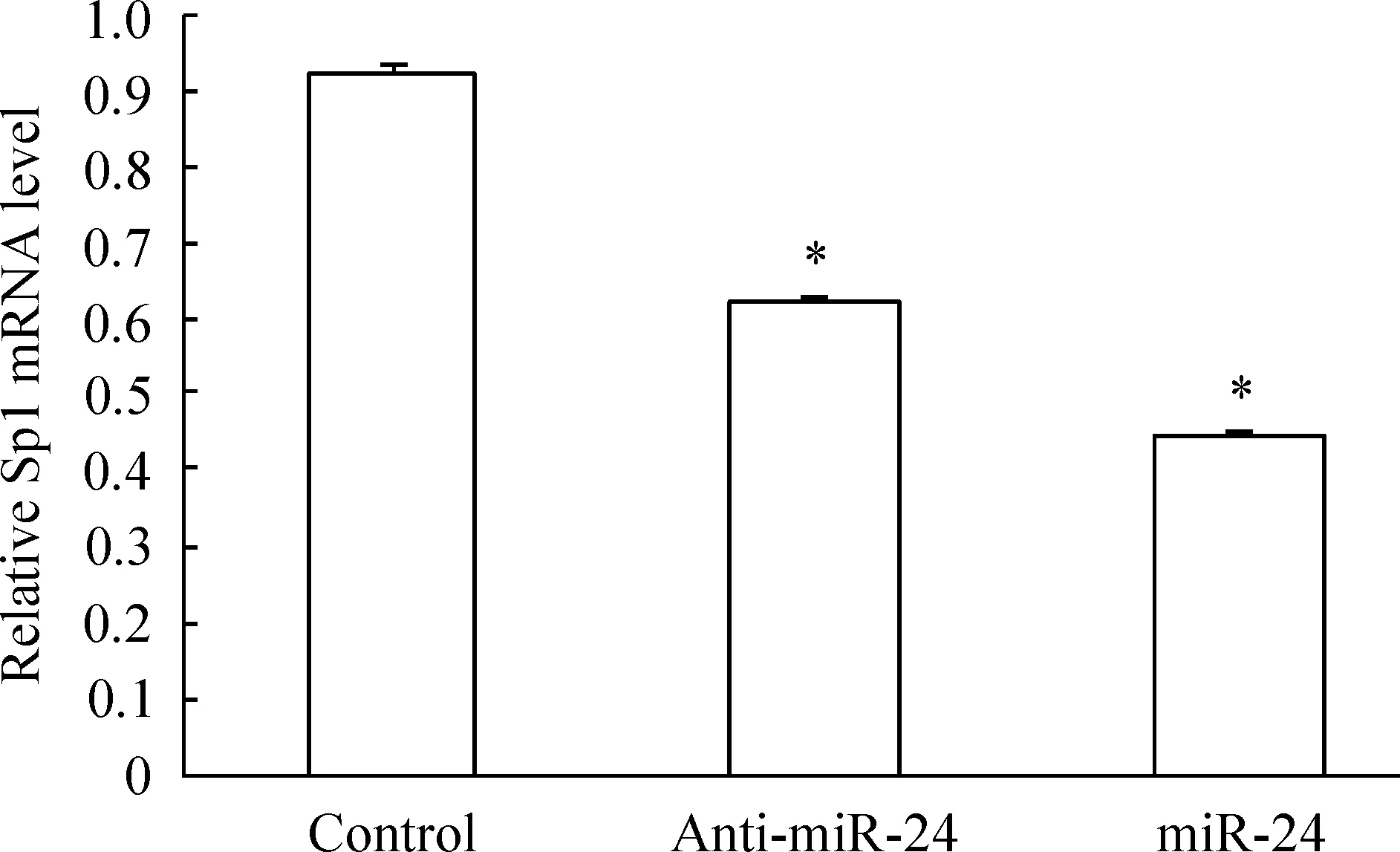
Figure 8. Effect of miR-24 on the mRNA expression of Sp1 measured by PT-PCR.Mean±SD.n=3. *P<0.05 vs control group.
讨 论
本文通过研究miRNA-24对eNOS表达及血管内皮细胞增殖的影响,主要有以下3个方面的发现:首先,eNOS基因是miRNA-24调控的重要分子靶标,miRNA-24对调控eNOS的表达具有明显的调节作用;其次,miRNA-24抑制eNOS表达的同时,也抑制血管内皮细胞的增殖;第三,转录因子Sp1可能作为一个重要因子与miRNA-24对eNOS的表达和血管内皮细胞的增殖的调节。据我们所知,这是第1次报道miRNA-24参与内皮特异性基因eNOS的表达调控; 同时,核转录因子Sp1作为重要的调节分子与miRNA-24共同参与对eNOS的表达调控。
作为生成NO的关键酶,eNOS具有组织特异性,即主要在血管内皮细胞中表达,其表达异常与许多心血管系统疾病的发生发展密切相关[11-12];而众多的研究表明,miRNA的特异性改变参与了人类重大疾病(如癌症、糖尿病、心血管疾病等)的发生发展进程[13]。因此,miRNA是否对eNOS的表达有调节作用,以及是否对血管内皮细胞的生理功能产生影响,是一个很重要的研究课题。Wang等[14]在2008年发现敲除miRNA-216的小鼠出现血管破裂、出血甚至部分胚胎死亡,其原因在于血管完整性的破坏以及内皮细胞增殖和迁移能力的改变;miRNA-132通过抑制p120 RASGAP的表达,实现对内皮细胞增殖、生存与移行的调节[15]。此外,miRNA-223作为另外一个抗血管新生的miRNA,可以通过结合于整合素β1部分抑制内皮细胞增殖[16]。氧化应激时,miRNA-24过表达于血管内皮细胞,通过furin-TGF-β通道miRNA-24参与心肌的纤维化过程,此外,miRNA-24可以减少缺血、缺氧条件下的细胞凋亡并改善心肌梗死引起的心脏重塑[17]。本研究发现,miRNA-24高表达组内皮细胞增殖速度降低,eNOS蛋白显著减少,而miRNA-24抑制组则与高表达组相反,这一结果强烈提示,miRNA-24参与内皮特异性eNOS基因调控,并抑制HUVECs增殖。值得注意的是,大多数miRNAs通常是在转录水平抑制或者降解靶基因,然而我们的前期研究发现,一些内含子源性的miRNAs可能在转录水平对基因的表达进行调控[18]。因此,我们进一步对eNOS mRNA改变情况进行检测,结果显示,eNOS mRNA的表达被miRNA-24明显抑制,这提示,miRNA-24可能在eNOS基因转录的阶段就对其进行了调控;这一过程可能与一些核转录因子有关,如Sp1。
血管内皮细胞的增殖在许多心血管疾病的病理生理过程都起着十分重要的作用[19-20]。eNOS表达的改变与相关心血管疾病的发生紧密相关。有证据显示,miRNA与核转录因子作为2类主要的反式作用因子,在调控真核细胞基因组的过程中有着广泛的联系[21-22]。定位于7q35~36的eNOS基因,其启动子下游区域有许多与其转录密切相关的顺式作用元件,尤其是-104位到-95位的正向调控区Ι则是转录因子Sp1的高亲和位点[7]。本研究还发现,核转录因子Sp1伴随着miRNA-24的高表达而降低。Sp1作为结合于eNOS增强子元件的重要转录因子[23]增强eNOS启动子的活性,促进eNOS的转录,随着HUVECs转染了miRNA-24高表达质粒以后,eNOS表达减少,内皮细胞增殖减慢,Sp1表达量也下降,这说明Sp1参与了miRNA-24对eNOS表达的调控,我们推测其可能的分子机制是核转录因子Sp1表达量的减少,影响了其正向调控eNOS表达以及NO的合成,最终导致内皮细胞的增殖受到抑制。
根据生物信息学分析显示,Sp1与miRNA-24之间也存在互补序列。这提示Sp1可能就是miRNA-24的分子靶标,我们进一步通过RT-PCR检测3个实验组中Sp1 mRNA的表达情况,发现miRNA-24能明显抑制Sp1 mRNA的表达,而miRNA-24抑制物则能够部分抵消这种效应。值得指出的是,由于Sp1和eNOS都是miRNA-24的靶标,在逻辑上, miRNA-24的抑制物似乎能完全抵消二者对细胞增殖的调节;然而本实验的结果显示, miRNA-24抑制物只能部分抵消miRNA-24高表达对细胞增殖的抑制作用;这一效应在Sp1和eNOS表达的调节也有类似情况。造成这一效应的原因至少有以下3个方面:第一,血管内皮细胞的增殖是多因素调节的过程,而不是单一分子或基因所调控;第二,miRNA-24对eNOS表达的调控可能存在2种机制,一种是miRNA-24在转录阶段直接抑制eNOS的表达,另外一种则通过调控eNOS基因的反式作用因子Sp1间接调控其表达。此外,Sp1和miRNA-24在对eNOS表达调控过程中所显示出相反作用,进一步提示,Sp1与miRNA-24可能作为一种协同机制维持eNOS在机体的正常表达;第三, 由于Sp1是eNOS的正性转录调节因子之一,而我们的结果显示miRNA-24抑制组的eNOS表达高于miRNA-24组,我们认为miRNA-24抑制物对eNOS的抑制程度高于Sp1,考虑到eNOS是内皮细胞的组织特异性蛋白,相对内皮细胞增殖的调控而言,这一结论更为合理。然而miRNA-24对Sp1的调控是否依赖其它因素,两者是否有剂量依赖关系,尤其是这种关联是否在其它的组织细胞中存在普遍性?这些问题有待进一步研究。
[参 考 文 献]
[1] Jamaluddin S, Liang Z, Lü JM, et al. Roles of cardiovascular risk factors in endothelial nitric oxide synthase regulation: an update [J]. Curr Pharm Des, 2014, 20(22): 3563-3578
[2] 莫 倩,李 丹,凌文华. miR-18a对人主动脉内皮细胞血管生成能力的影响[J]. 中国病理生理杂志,2012, 28(7):1187-1191.
[3] Costa A, Afonso J, Osório C, et al. miR-363-5p regulates endothelial cell properties and their communication with hematopoietic precursor cells[J]. J Hematol Oncol, 2013, 6:87.
[4] Bao MH, Feng X, Zhang YW, et al. Let-7 in cardiovascular diseases, heart development and cardiovascular differentiation from stem cells[J]. Int J Mol Sci, 2013, 14(11):23086-23102.
[5] Roncarati R, Anselmi CV, Losi MA, et al. Circulating miR-29a, among other up-regulated microRNAs, is the only biomarker for both hypertrophy and fibrosis in patients with hypertrophic cardiomyopathy[J]. J Am Coll Cardiol, 2014, 63(9):920-927.
[6] Wang B, Xing F, Liu N, et al. p38α subtype is a potential target to inhibit eNOS activity and NO production in human endothelial cells [J]. Microvasc Res, 2014, 91:58-65.
[7] Yang P, Zhang Y, Pang J, et al. Loss of Jak2 impairs endothelial function by attenuating Raf-1/MEK1/Sp-1 signaling along with altered eNOS activities [J]. Am J Pathol, 2013, 183(2):617-625.
[8] Huang PL. eNOS, metabolic syndrome and cardiovascular disease [J]. Trends Endocrinol Metab, 2009, 20(6):295-302.
[9] Kumar S, Sun X, Wiseman DA, et al. Hydrogen peroxide decreases endothelial nitric oxide synthase promoter activity through the inhibition of Sp1 activity[J]. DNA Cell Biol, 2009, 28(3):119-129.
[10] Ma Y, Wang B, Gong B, et al. miR-24 improves β-like globin gene expression through targeting Sp1[J]. Chin J Biotech, 2013, 29(7):946-954.
[11] Qian J, Fulton D. Post-translational regulation of endothelial nitric oxide synthase in vascular endothelium[J]. Front Physiol, 2013, 4:347.
[12] Galluccio E, Cassina L, Russo I, et al. A novel truncated form of eNOS associates with altered vascular function[J]. Cardiovasc Res, 2014, 101(3):492-502.
[13] Bandiera S, Hatem E, Lyonnet S, et al. microRNAs in diseases: from candidate to modifier genes[J]. Clin Genet, 2010, 77(4):306-313.
[14] Wang S, Aurora AB, Johnson BA, et al. The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis [J]. Dev Cell, 2008, 15(2):261-271.
[15] Anand S, Majeti BK, Acevedo LM, et al. MicroRNA-132-mediated loss of p120RasGAP activates the endothelium to facilitate pathological angiogenesis[J]. Nat Med, 2010, 16(8):909-914.
[16] Shi L, Fisslthaler B, Zippel N,et al. MicroRNAs-223 antagonises angiogenesis by targeting β1 integrin and preventing growth factor signaling in endothelial cells[J]. Circ Res, 2013, 113(12):1320-1330.
[17] Wang J, Huang W, Xu R, et al. MicroRNA-24 regulates cardiac fibrosis after myocardial infarction[J]. J Cell Mol Med, 2012, 16(9):2150-2160.
[18] 严丽梅,王荣娇,吴建永,等. 内含子源性microRNA对内皮型一氧化氮合酶表达及血管内皮细胞增殖的作用[J]. 生物化学与生物物理进展, 2010, 337(7): 747-753.
[19] Liu HF, Qi XW, Ma LL, et al. Atorvastatin improves endothelial progenitor cell function and reduces pulmonary hypertension in patients with chronic pulmonary heart di-sease[J]. Exp Clin Cardiol, 2013, 18(1):e40-e43.
[20] Bai X, Wang X, Xu Q. Endothelial damage and stem cell repair in atherosclerosis[J]. Vascul Pharmacol, 2010, 52(5-6):224-229.
[21] Hobert O.Gene regulation by transcription factors and microRNAs[J]. Science, 2008, 319(5871):1785-1786.
[22] Makeyev EV, Maniatis T. Multilevel regulation of gene expression by microRNAs[J]. Science, 2008, 319(5871):1789-1790.
[23] Searles CD. Transcriptional and posttranscriptional regulation of endothelial nitric oxide synthase expression[J]. Am J Physiol Cell Physiol, 2006, 291(5):C803-C816.
