siRNA对预分化骨髓间充质干细胞β2M表达的影响*
2014-08-09范时洋金海东蔡建武
戴 兵, 范时洋, 陈 龙, 金海东, 蔡建武, 潘 骏
(温州医科大学附属第二医院骨科, 浙江 温州 325027)
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)具有多向分化潜能,特定培养条件下可分化为成骨细胞、软骨细胞、肌腱细胞、内皮细胞、真皮细胞、神经细胞等中胚层组织[1],是组织工程理想的种子细胞。鉴于自体细胞临床大范围应用的限制,异体种子细胞的免疫逃逸问题是组织工程发展无法回避的问题之一。MSCs随具有低免疫原性,但植入体内的干细胞可以分化为多种类型的细胞,干细胞的分化是否影响其免疫原性的表达,这是我们要考虑的问题。对影响细胞移植成功的主要障碍是T细胞介导的免疫应答。MHC I分子和CD8+T细胞的相互作用在同种异体或异种移植的排斥反应中起到重要作用[2-3]。BMSCs只表达MHCⅠ,不表达MHCⅡ, MHCⅠ在免疫系统中占有极其重要的地位,广泛表达于一切有核细胞表面,由重链α链和轻链β2-微球蛋白(beta 2-microglobulin, β2M)组成。 β2M是一种低分子量的蛋白质,与重链ɑ链以非共价键连接方式相连,使MHCⅠ在细胞表面能够稳定表达,并能促进抗原肽与MHCⅠ结合[4-6]。RNAi技术是特异性降解与其序列相应的单个内源基因的mRNA[7]。近年来,使用RNAi技术阻断特定基因的表达比反义寡核苷酸等更特异、高效、稳定和低浓度[8-9]。通过RNAi减少或下调MHC I分子蛋白的表达,成功克服了一些限制细胞治疗的免疫反应[10]。我们拟通过RNAi技术使预分化BMSCs的β2M沉默,降低β2M蛋白的表达,为软骨组织工程提供低免疫原性的种子细胞。
材 料 和 方 法
1 动物和材料
健康雄性清洁级4周龄SD大鼠10只,体质量200~240 g,购自温州医科大学实验动物中心,有关动物实验的相关内容通过了温州医科大学伦理委员会的审批。
低糖DMEM和胎牛血清购自Sigma;SD大鼠骨髓间充质干细胞成软骨诱导液购自广州赛业;抗生素和抗真菌剂溶液购自Life Technologies;Lipofectamine 2000购自Gibco;FAM-siRNA及转染相关试剂均购自上海吉玛公司;siRNA的序列见表1;β2M 抗体和兔抗羊 IgG-HRP均购自 Santa Cruz;GAPDH antibody购自Bioworld;总RNA快速提取试剂盒购自Generay;逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit购自Fermentas;qPCR试剂IQ SYBR Green Supermix购自Bio-Rad。所用引物由上海英潍捷基(Invitrogen)有限公司根据设计合成,见表2。
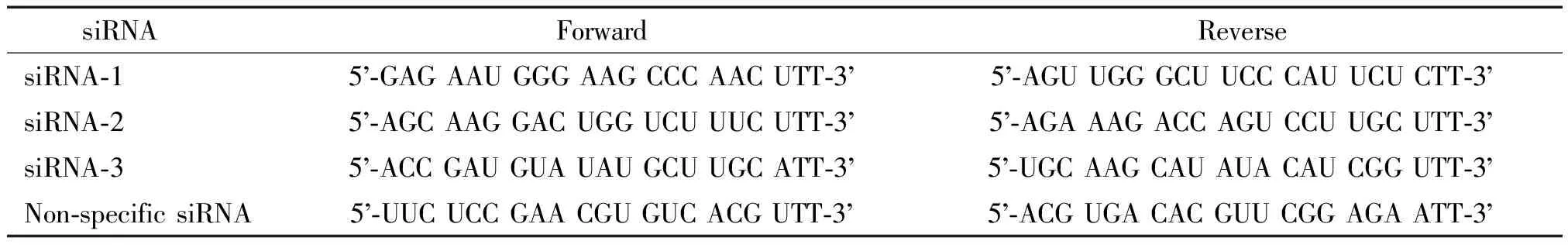
表1 siRNA序列
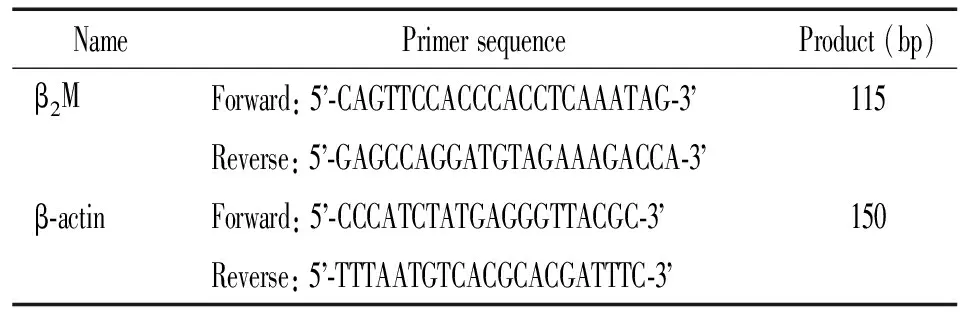
表2 引物序列
2 主要方法
2.1骨髓间充质干细胞的分离培养 无菌操作下取4周龄SD大鼠股骨及胫骨干,用一次性注射器吸取无血清DMEM培养基反复冲洗骨髓腔,1 000 r/min离心5 min,弃上清,加入含10% FBS、1%双抗的DMEM培养基吹打混匀后移入25 cm2培养瓶内,置37 ℃、5% CO2、饱和湿度培养箱内培养,24 h后除去未贴壁细胞,以后每3~4 d更换培养基,待细胞铺满瓶底80%以上,0.25%胰酶/0.1% EDTA消化细胞,1 000 r/min离心5 min,按1∶3传代培养。
2.2细胞成软骨诱导 取第3代MSCs加入含10% FBS成软骨诱导液(含基本培养基97 mL, 地塞米松10 μL, 抗坏血酸盐300 μL, 胰岛素-转铁蛋白-硒1 mL, 丙酮酸钠盐100 μL, 脯氨酸100 μL, TGF-β31 mL),置37 ℃、5% CO2、饱和湿度培养箱内培养,3 d更换培养基,诱导21 d,终止诱导。
2.3细胞转染 实验所需β2MsiRNA由上海吉玛公司设计合成,实验分为5组:实验组3组,分为siRNA-1、siRNA-2和siRNA-3组;对照组2组,分为空白对照组 (negative control,NC)和非特异siRNA组(non-specific siRNA,NS)。取成软骨诱导21 d的MSCs,种植于放置细胞爬片的24孔板中(5×104cells/well),培养24 h后进行转染。实验组和非特异siRNA组每孔转染体积100 μL(转染方法参照Lipofectamine 2000说明书),对照组每孔加等体积的无血清opti-MEM I培养基,避光培养。
2.4Western blotting法检测β2M蛋白表达 冷的PBS洗涤细胞2遍,冰上裂解细胞、离心并收集上清后行蛋白定量,采用10% SDS-PAGE凝胶电泳。蛋白分离后经恒流电转移到PVDF膜,使用含5%脱脂牛奶的封闭液室温封闭1 h,与β2M抗体4 ℃孵育过夜,次日加入Ⅱ抗室温孵育1 h,TBST洗膜3次,取出膜后加入ECL发光液,移入凝胶成像分析仪,化学光敏模式曝光显影。
2.5实时荧光定量PCR 收集各组细胞,总RNA抽提按Trizol试剂说明书操作,分光光度计测量RNA的纯度及浓度,使用RevertAid First Strand cDNA Synthesis Kit逆转录为cDNA,采用SYBR Green染色法,以各组cDNA为模板,加入缓冲液、引物等进行PCR,各样本重复3次。反应条件如下:95 ℃变性2 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,循环40次。
2.6激光共聚焦显微镜下观察β2M 取对照组和siRNA-3组细胞用PBS洗2遍,5% BSA 室温封闭1 h,PBS洗3遍。孵育β2M荧光Ⅰ抗, 37 ℃避光1 h, PBS洗2遍。10 μL DiI染色, 室温, 避光15 min, PBS洗2遍,30%甘油封片。
2.7甲苯胺蓝染色检测蛋白聚糖多聚体 转染24 h后,吸去原液, PBS 洗细胞3遍,4%多聚甲醛固定30 min,PBS洗细胞2遍,加入 1 mL 甲苯胺蓝染液覆盖细胞表面,室温下孵育 30 min,PBS 洗细胞2遍,常规乙醇脱水、透明及30%甘油封片。倒置显微镜下观察细胞,拍照。
2.8Ⅱ型胶原(collagen type Ⅱ,Col Ⅱ)免疫荧光 转染12 h后,吸去原液, PBS 洗细胞3遍,4%多聚甲醛固定30 min,PBS洗细胞2遍,0.2% Triton X-100破膜30 min,PBS 洗细胞2遍;5% BSA固定1 h,PBS洗细胞2遍;以0.1% Triton X-100稀释Col II Ⅰ抗(1∶100),37 ℃孵育细胞1 h,PBS洗细胞2遍;以0.1% Triton X-100 稀释FITC荧光Ⅱ抗(1∶500),37 ℃孵育细胞1 h,PBS洗细胞2遍;以10 μg/L的DAPI标记孵育15 min,标记细胞核,PBS洗细胞2遍;荧光显微镜下观察细胞,拍照。
3 统计学处理
采用SPSS 18.0软件分析。数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 不同siRNA对 β2M mRNA表达的影响
将MSCs成软骨诱导21 d后,进行siRNA干扰。siRNA-1、siRNA-2和siRNA-3各转染组均比对照组细胞的β2M mRNA表达有不同程度降低。siRNA-3组细胞的目的基因表达减少最明显,siRNA-2和siRNA-1次之(P<0.01),见图1。
2 不同siRNA对 β2M蛋白表达的影响
Western blotting结果表明,siRNA-1、siRNA-2和siRNA-3各转染组均比对照组细胞的β2M蛋白表达有不同程度降低。siRNA-3组细胞目的蛋白含量减少最明显,siRNA-2和siRNA-1次之(P<0.01),表明用3种siRNA均成功沉默BMSCs的β2M基因表达,siRNA-3的沉默效果最佳,见图2。
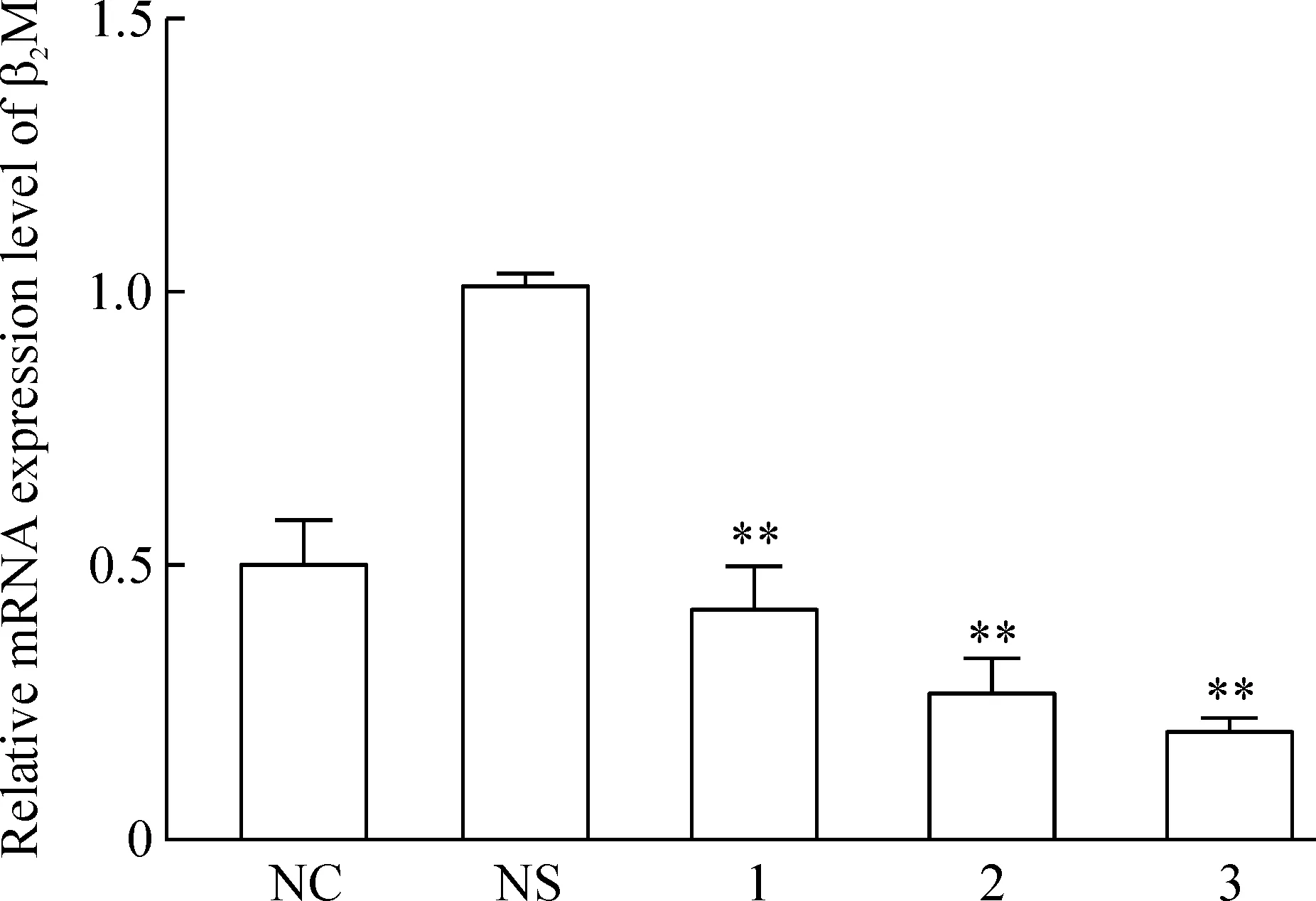
Figure 1. The mRNA expression of β2M in the pre-differentiated (21 d) BMSCs determined by real-time qPCR analysis.NC: negative control; NS: non-specific siRNA; 1: siRNA-1; 2: siRNA-2; 3: siRNA-3.Mean±SD.n=3. **P<0.01 vs NC or NS.
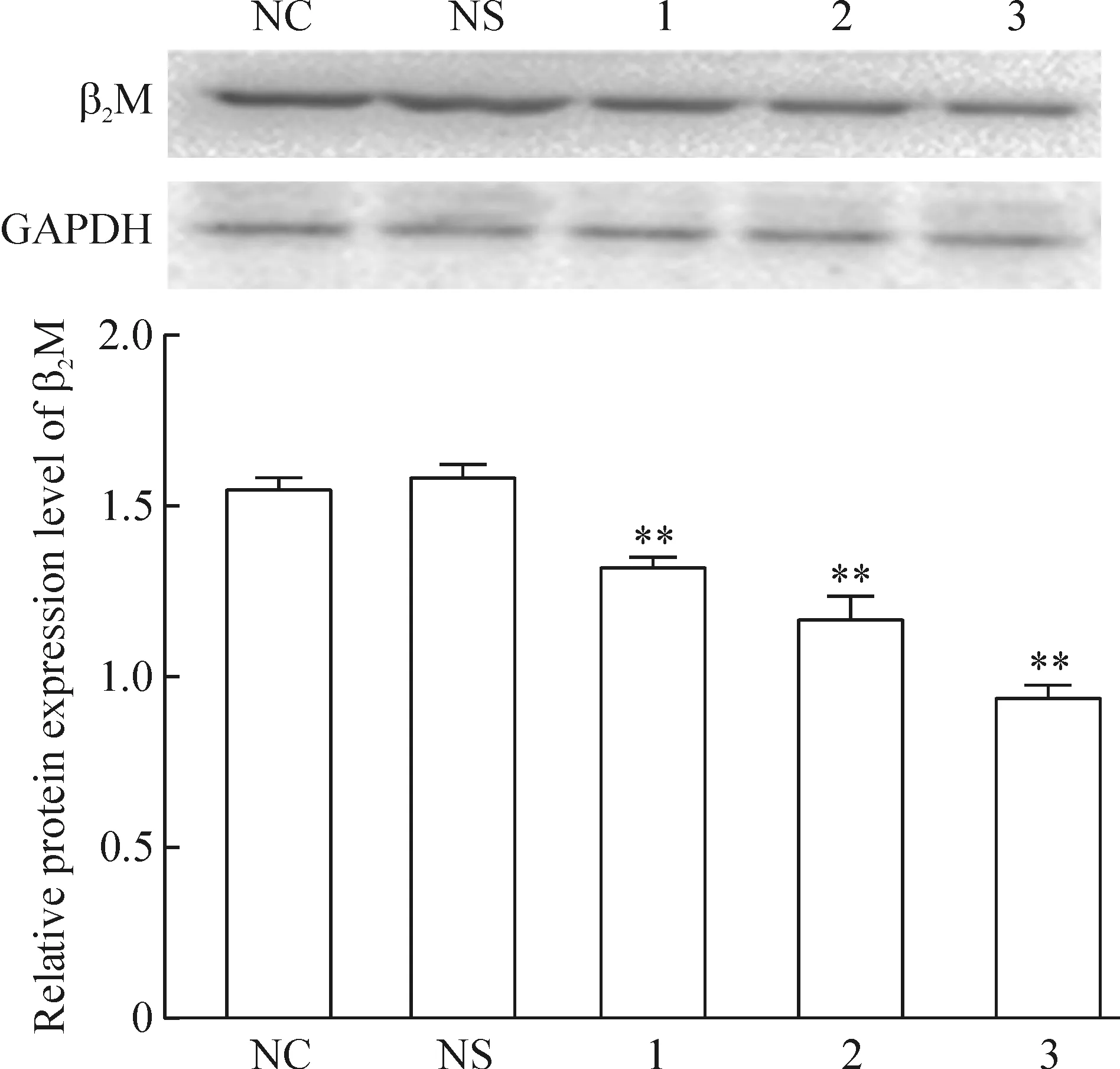
Figure 2. The protein expression of β2M in the pre-differentiated (21 d) BMSCs determined by Western blotting.NC: negative control; NS: non-specific siRNA; 1: siRNA-1; 2: siRNA-2; 3: siRNA-3.Mean±SD.n=3. **P<0.01 vs NC or NS.
3 激光共聚焦显微镜下观察β2M
成软骨诱导液中培养21 d后,对照组和siRNA-3 转染组细胞的β2M分布均比较均匀, siRNA-3 转染组的BMSCs相比未转染组β2M明显减少,表明β2MsiRNA可有效沉默β2M基因的表达,见图3。
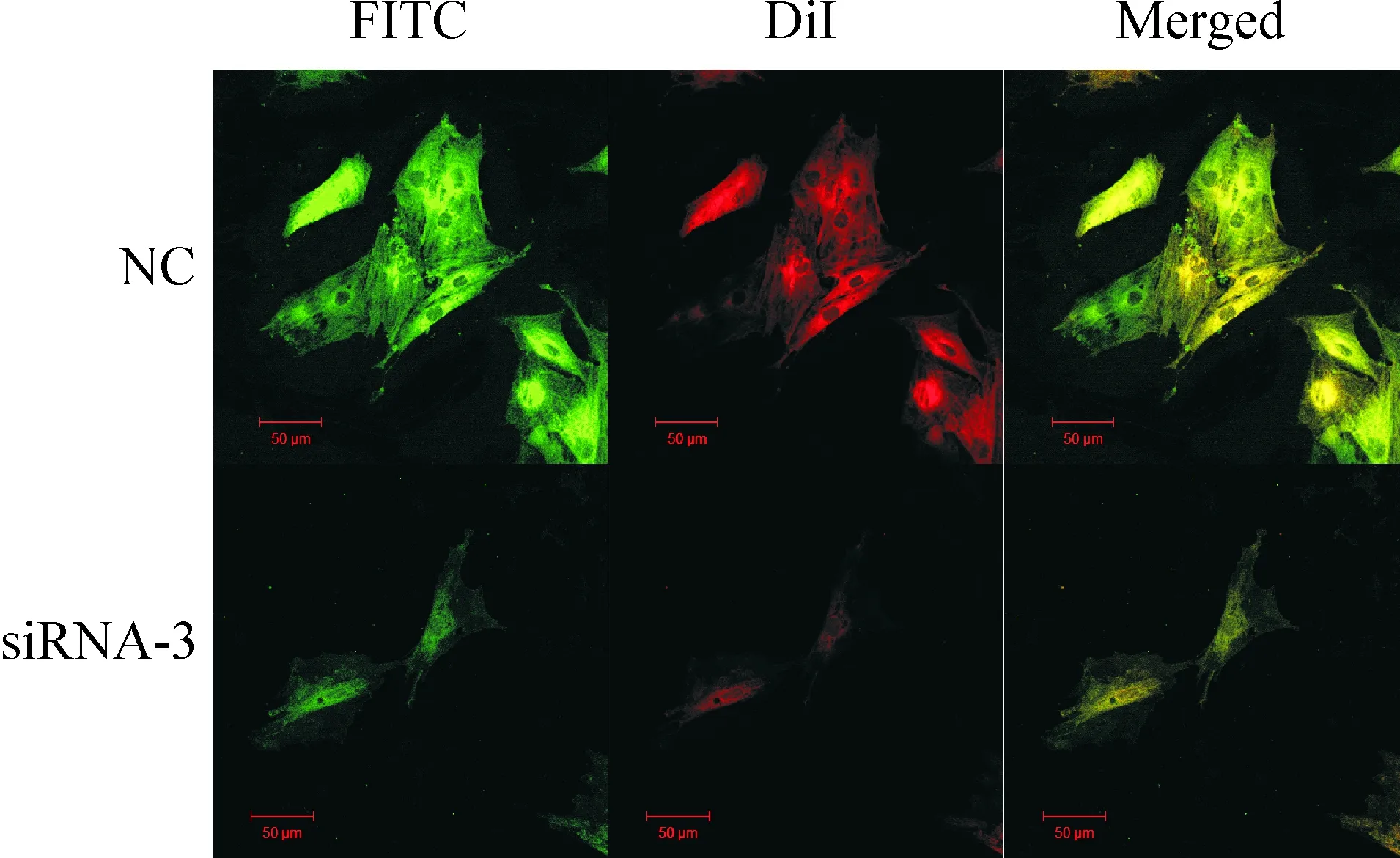
Figure 3. The protein expression of β2M in the pre-differentiated (21 d) BMSCs observed by laser confocal microscopy.Scale bar = 50 μm.
4 甲苯胺蓝法染色观察
甲苯胺蓝法染色显示:成软骨诱导21 d后,NC组和siRNA-3组的BMSCs蛋白聚糖多聚体染色均呈阳性反应,差异无统计学意义(P>0.05),见图4。

Figure 4. Aggrecan production in the pre-differentiated (21 d) BMSCs detected by toluidine blue staining. Scale bar = 50 μm.A: NC; B: siRNA-3.
5 Ⅱ型胶原免疫荧光
Ⅱ型胶原免疫荧光显示:成软骨预诱导21 d后,BMSCs呈多角形,细胞形态清晰,NC组预诱导BMSCs细胞的Ⅱ型胶原免疫荧光强度较siRNA-3转染组的细胞略低,但差异无统计学意义(P>0.05),见图5。
讨 论
在长期移植过程中,考虑到免疫反应,自体细胞是理想的移植供体细胞。其中,BMSCs因其在哺乳动物体中含量丰富,具有显著的优势。BMSCs因其取材方便、体外扩增能力强,具有多向分化潜能、不涉及伦理道德问题等优点,受到广泛关注[11]。然而自体移植前,细胞的分离、扩增往往十分耗时。这种情况下,同种异体BMSCs因其低免疫原性而成为软骨移植较好的种子来源。BMSCs移植应用于临床将是一个漫长的过程,一旦应用于临床,那么对患者来说有很大好处。充足的种子细胞储存,避免了不必要的自体细胞分离扩增,更能满足不适合自体BMSCs移植的老人的需求。近年来越来越多的研究主要集中在同种异体BMSCs的使用上。

Figure 5. Collagen type II in the pre-differentiated (21 d) BMSCs detected by immunofluorescence. Scale bar = 50 μm.A: NC; B: siRNA-3.
来源于成人的BMSCs已被证明具有免疫调节活性。比如可以抑制T细胞增殖,调节B细胞功能和树突状细胞的成熟[12]。但是移植的异体BMSCs在特定环境分化过程中,免疫原性是否发生变化呢?Huang等[13]发现预分化的骨髓间充质干细胞相比未分化的骨髓间充质干细胞,增加了免疫原性。其他研究小组证实,将异体间充质干细胞移植到幼龄小鼠[14-15]和猪[16]体内会引起免疫反应。这说明植入的同种异体BMSCs虽然具有低免疫原性,但在体内分化过程中,其免疫原性是增加的,使得它们更易受到免疫排斥。
Isakova等[17]发现将MHCⅠ阳性的雄性猕猴的骨髓间充质干细胞移植到雌性幼龄猕猴中枢系统,引起急性移植排斥反应。但是敲除MHCⅠ或MHCⅡ或两者同时敲除的小鼠胚胎神经元,其免疫原性降低,移植到大鼠脑中可长期存活[18-19],这些证据说明,抑制MHCⅠ的表达对于BMSCs移植的安全性至关重要。MHCⅠ分子存在于所有有核细胞,包括重链α链和轻链β2M,α链和β2M都是MHCⅠ分子折叠、加工所必须的。有研究表明在缺乏β2M的情况下,细胞的表面不能有效表达MHC I分子[20-21],这为降低细胞免疫原性提供了新的途径。
siRNA具有高效、特异、低毒、周期短、操作简单等特点,作用于哺乳动物细胞蛋白表达上游的mRNA,是传统的基因敲除技术所不能比拟的。本研究针对β2M mRNA序列,设计了3对β2MsiRNA。Lipofectamine 2000因其转染效率高、安全等特点,目前得到了广泛应用。我们使用Lipofectamine 2000作为载体成功将siRNA安全、完整地转入到BMSCs。通过Western blotting、实时定量PCR和激光共聚焦显微镜观察分析发现转染的预分化BMSCs,其β2M的表达明显下降,其中以siRNA-3的抑制效果最佳。
那么β2MsiRNA转染后对预分化的BMSCs是否有影响呢?基于这方面的考虑,我们选取转染24 h的细胞进行甲苯胺蓝和Ⅱ型胶原免疫荧光检测蛋白聚糖多聚体及Ⅱ型胶原蛋白的分泌情况,实验组和对照组无明显差别。
我们利用RNAi技术下调β2M对体外预分化为软骨细胞的BMSCs的免疫原性进行了初步研究。但是,在体内特定条件下,在BMSCs分化过程中沉默β2M基因的表达对免疫排斥反应的抑制效果还有待进一步研究。
[参 考 文 献]
[1] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893):41-49.
[2] Ramirez-Victorino F, Beilke JN, Gill RG. Both innate and adaptive major histocompatibility complex class I-dependent immunity impair long-term islet xenograft survival[J]. Transplant Proc, 2008, 40(2):557-558.
[3] Markmann JF, Bassiri H, Desai NM, et al. Indefinite survival of MHC class I-deficient murine pancreatic islet allografts[J]. Transplantation, 1992, 54(6): 1085-1089.
[4] Townsed AR, Gotch FM, Davey J. Cytotoxic T cells recognize fragments of the influenza nucleoprotein[J]. Cell, 1985, 42(2):457-467.
[5] Morrison LA, Lukacher AE, Braciale VL, et al. Diffe-rences in antigen presentation to MHC class Ⅰ-and class Ⅱ-restricted influenza virus specific cytolytic T lymphocyte clones[J]. J Exp Med, 1986, 163(4):903-921.
[6] Garrido F, Ruiz-Cabello F, Cabrera T, et al. Implications for immunosurveillance of altered class I phenotypes in human tumors[J]. Immunol Today, 1997, 18(2):89-95.
[7] Timmons L, Court DL, Fire A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference inCaenorhabditiselegans[J]. Gene, 2001, 263(1-2):103-112.
[8] Paul P, Cabestré FA, Le Gal FA, et al. Heterogeneity of HLA-G gene transcription and protein expression in malignant melanoma biopsies[J]. Cancer Res, 1999, 59(8):1954-1960.
[9] Urosevic M, Kurrer MO, Kamarashev J, et al. Human leukocyte antigen G up-regulation in lung cancer associates with high-grade histology, human leukocyte antigen class I loss and interleukin-10 production[J]. Am J Pathol, 2001, 159(3):817-824.
[10] Fire A, Xu S, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans[J]. Nature, 1998, 391(6669): 806-811.
[11] 邓宇斌, 郭小荑, 梁海翔, 等. 腺病毒介导CTLA4Ig基因修饰骨髓间质干细胞体外抑制免疫应答的研究[J]. 中国病理生理杂志, 2004, 20(3):300-305.
[12] Uccelli A, Moretta L, Pistoia V. Immunoregulatory function of mesenchymal stem cells[J]. Eur J Immunol, 2006, 36(10):2566-2573.
[13] Huang XP, Sun Z, Miyagi Y, et al. Differentiation of allogeneic mesenchymal stem cells induces immunogenicity and limits their long-term benefits for myocardial repair[J]. Circulation, 2010, 122(23):2419-2429.
[14] Nauta AJ, Westerhuis G, Kruisselbrink AB, et al. Donor-derived mesenchymal stem cells are immunogenic in an allogeneic host and stimulate donor graft rejection in a non-myeloablative setting[J]. Blood, 2006, 108(6):2114-2120.
[15] Badillo AT, Beggs KJ, Javazon EH, et al. Murine bone marrow stromal progenitor cells elicit aninvivocellular and humoral immune response[J]. Biol Blood Marrow Transplant, 2007, 13(4):412-422.
[16] Poncelet AJ, Vercruysse J, Saliez A, et al. Although pig allogeneic mesenchymal stem cells are not immunogenicinvitro, intracardiac injection elicits an immune responseinvivo[J]. Transplantation, 2007, 83(6):783-790.
[17] Isakova IA, Dufour J, Lanclos C, et al. Cell-dose-dependent increases in circulating levels of immune effector cells in rhesus macaques following intracranial injection of allogeneic MSCs[J]. Exp Hematol, 2010, 38(10): 957-967.
[18] Duan WM, Westerman M, Flores T, et al. Survival of intrastriatal xenografts of ventral mesencephalic dopamine neurons from MHC-deficient mice to adult rats[J]. Exp Neurol, 2001, 167(1):108-117.
[19] Veng LM, Bjugstad KB, Freed CR, et al. Xenografts of MHC-deficient mouse embryonic mesencephalon improve behavioral recovery in hemiparkinsonian rats[J]. Cell Transplant, 2002, 11(1):5-16.
[20] Seong RH, Clayberger CA, Krensky AM, et al. Rescue of Daudi cell HLA expression by transfection of the mouse beta 2-microglobulin gene [J]. J Exp Med, 1988, 167(2):288-299.
[21] Zijlstra M, Bix M, Simister NE, et al. Beta 2-microglobulin deficient mice lack CD4-8+cytolytic T cells [J]. Nature, 1990, 344(6268):742-746.
