糖尿病足伤口皮肤细胞凋亡情况及AGEs对人皮肤成纤维细胞凋亡的影响*
2014-08-09劳国娟黄燕瑞王晓艺
劳国娟, 任 萌, 黄燕瑞, 杨 川, 王晓艺, 严 励
(中山大学孙逸仙纪念医院内分泌科,广东 广州 510120)
随着对糖尿病皮肤病变发病机制的深入研究,我们认识到糖尿病皮肤创伤难愈合的原因除与过量微生物负荷以及周围神经、血管病变、生长因子水平下降等因素有关外[1],细胞凋亡在糖尿病皮肤损伤及愈合中也发挥了重要作用[2]。然而,关于糖尿病皮肤凋亡的研究目前主要涉及动物实验,对于糖尿病患者足部伤口细胞凋亡情况,尚不清楚。此外,糖尿病病理状态下细胞凋亡的原因和影响因素未完全阐明。研究表明,糖尿病慢性并发症的发生发展与持续高糖、血糖波动、晚期糖基化终产物(advanced glycosylation end products, AGEs)等因素密切相关。研究这些因素对细胞凋亡的影响有助于阐明糖尿病病理状态下细胞凋亡和伤口难愈的机制。因此,本实验收集糖尿病和非糖尿病足部伤口皮肤标本,探讨糖尿病患者创面皮肤细胞凋亡的情况,并观察正常浓度糖、持续高糖、高糖波动和AGEs对人皮肤成纤维细胞凋亡的影响,为明确细胞凋亡在糖尿病皮肤溃疡发生发展中的作用提供实验依据。
材 料 和 方 法
1 材料
1.1主要试剂 兔抗人cleaved-caspase-3 (Asp175)单克隆抗体购自CST,链霉亲和素-生物素复合物(streptavidin-biotin complex,SABC)试剂盒购自武汉博士德生物工程有限公司,原位缺口末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)凋亡试剂盒购自Roche,AGEs购自Merck。
1.2皮肤标本 糖尿病足组:自2011年6月至2013年4月于我科因糖尿病足住院的2型糖尿病患者18例;非糖尿病组:自2011年6月至2013年4月于我院骨科因足部外伤行外科手术治疗住院的非糖尿病患者18例。所有皮肤标本均在局部感染控制后取材,距离足部伤口边缘0.5 cm。剪取皮肤标本后以4%多聚甲醛溶液固定,制作厚度5 μm石蜡切片。所有患者签署知情同意书。
1.3细胞来源 本院泌尿外科或小儿外科正常儿童包皮环切术后的手术标本,均经患者家属同意后留取标本,皮肤成纤维细胞进行分离、培养和鉴定。实验对象取第4~6代细胞。
2 方法
2.1一般情况 询问所有受试者病史并体检,记录年龄、性别、伤口持续时间,测量血压、身高、体重,计算体重指数(body mass index,BMI)等,测量数据均重复2次,取平均值。由本院生化实验室检测受试者空腹血糖(fasting blood glucose,FBG)、餐后2 h血糖(2-hour postprandial blood glucose,2 h PBG;非糖尿病组为口服葡萄糖耐量试验2 h血糖)、糖基化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、丙氨酸氨基转移酶(alanine amino-transferases,ALT)及血清肌酐(serum creatinine,SCr)。
2.2Cleaved-caspase-3免疫组织化学染色 采用SABC法染色:切片常规脱蜡、水化。滴加3% H2O2阻断内源性过氧化物酶的活性。切片置于柠檬酸缓冲液中,微波加热修复抗原。5% BSA封闭,滴加兔抗人的cleaved-caspase-3单克隆抗体,4 ℃孵育过夜。加入生物素标记的山羊抗兔第Ⅱ抗体。PBS冲洗,SABC孵育。DAB显色,苏木素轻度复染。切片经过梯度乙醇脱水干燥,二甲苯透明,中性树胶封固。染色过程中均设有阴性对照。结果判断标准:免疫组化染色结果按照盲法由一位有经验的病理医师独立进行判断,细胞浆有棕色着色的细胞为阳性细胞,无棕色着色的为阴性细胞。染色结果按照免疫反应评分(immunoreactive score,IRS)标准进行评分,IRS=P×I。P为阳性细胞百分比分级:没有阳性细胞,P=0;阳性细胞占1%~24%,P=1;阳性细胞占25%~49%,P=2;阳性细胞占50%~74%,P=3;阳性细胞占75%~100%,P=4。I为染色强度:没有染色,I=0;染色浅,I=1;染色中等强度,I=2;染色深,I=3。每个标本随机选取5个高倍视野评分,取平均值。
2.3TUNEL检测 石蜡切片脱蜡、水化后,滴加蛋白酶K(proteinase K)通透细胞,加入TUNEL反应混合液(enzyme solution∶label solution=1∶9),保湿、避光,37 ℃孵育,滴加过氧化物酶(peroxidase,POD)转化剂,加入底物DAB显色,苏木素复染。常规脱水,透明,中性树胶封固。实验过程设有阴性对照。每个标本随机选取5~10个高倍视野,计数1 000个细胞,细胞核中有棕黄色者即为凋亡细胞,计算凋亡指数(apoptotic index,AI),AI(%)=凋亡细胞数/1 000×100%。
2.4人原代皮肤成纤维细胞的分离、培养与鉴定 包皮块在75%乙醇中浸泡1 min,用含双抗(青霉素和链霉素)的D-Hanks液清洗。去除皮下组织,将组织分切为2 mm×5 mm大小皮条,加入0.2% 中性蛋白酶,4 ℃,消化过夜。分离表皮和真皮层。 真皮切成1 mm×1 mm×1 mm小块,加入0.25%含EDTA的胰酶消化15 min,终止消化后反复吹打获得单细胞悬液,筛网去除剩余残渣,收集滤液,离心,用含10%FBS的DMEM培养基重悬,置于37 ℃、5%CO2、90%湿度条件下培养、传代。免疫细胞化学染色进行鉴定。
2.5Western blotting检测 分组:正常浓度糖组(normal glucose,NG;5.6 mmol/L)、持续高糖组(sustained high glucose,HG;25 mmol/L)、高糖波动组(fluctuant high glucose,FHG;5.6 mmol/L与25 mmol/L 交替,8 h换液)和AGEs组(AGEs 150 mg/L)。人皮肤成纤维细胞按1×104cells/well的密度接种至6孔板。细胞长至对数生长期60%融合,饥饿细胞24 h,使细胞进入同步化状态。按实验分组更换目的培养基,继续培养72 h,收集细胞,提取总蛋白,MiniBCA法测定蛋白质浓度,蛋白变性、电泳、转至PVDF膜,5%脱脂牛奶封闭,依次加入兔抗人cleaved caspase-3、HRP标记的IgG,洗膜、显色、曝光。用BandScan 4.3软件对条带进行灰度扫描,以目的蛋白与GAPDH的灰度比值代表目的蛋白水平。
2.6流式细胞术检测 分组及细胞处理同前,按实验分组更换目的培养基,继续培养72 h,用不含EDTA的胰酶消化细胞并用PBS洗涤,行Annexin V-FITC联合PI双染法检测细胞凋亡。
3 统计学处理
采用SPSS 16.0统计学软件分析。计量资料均进行正态性检验和方差齐性检验,数据用均数±标准差(mean±SD)表示,两组间均数的比较采用非配对t检验,多组间比较采用单因素方差分析,组间差异有统计学意义时采用LSD法进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 糖尿病组和非糖尿病组患者临床和生化数据比较
糖尿病组患者空腹血糖、餐后2 h血糖和HbA1c明显高于非糖尿病组患者(P<0.05);糖尿病组伤口持续时间长于非糖尿病组(P<0.05);年龄、性别、BMI、血压、血脂和肝肾功能在2组间差异无统计学意义(P>0.05),见表1、2。

表1 糖尿病组和非糖尿病组临床资料比较

表2 糖尿病组和非糖尿病组生化资料比较
2 糖尿病组和非糖尿病组患者足部伤口皮肤细胞凋亡情况
结果表明,糖尿病患者足部伤口皮肤细胞凋亡明显增加,发生凋亡的细胞以真皮层中的成纤维细胞和炎症细胞为主,有少量角质形成细胞发生凋亡,见图1、2。Cleaved caspase-3在非糖尿病组和糖尿病组的表达(IRS)分别为1.04±0.23和3.04±0.31,差异有统计学意义(P<0.05)。非糖尿病组和糖尿病组细胞凋亡指数分别为(3.8±0.8)%和(8.4±1.5)%,差异有统计学意义(P<0.05)。
3 AGEs对人皮肤成纤维细胞凋亡的影响
人原代皮肤成纤维细胞在正常浓度糖、持续高糖、高糖波动、AGEs中培养72 h后, cleaved caspase-3蛋白表达水平(目的蛋白与GAPDH的比值)分别为0.80±0.13、1.22±0.18、1.46±0.32和1.83±0.25,见图3,细胞凋亡率分别为(2.43±0.19)%、(2.89±0.51)%、(3.99±0.24)%和(6.83±0.36)%,见图4。 AGEs组cleavedcaspase-3蛋白表达水平和细胞凋亡率均明显高于正常浓度糖组和持续高糖组,差异有统计学意义(P<0.05);正常浓度糖组、持续高糖组和高糖波动组间的差异无统计学意义(P>0.05)。实验结果提示相对于持续高糖和波动高糖,AGEs促进人皮肤成纤维细胞凋亡的作用更强。
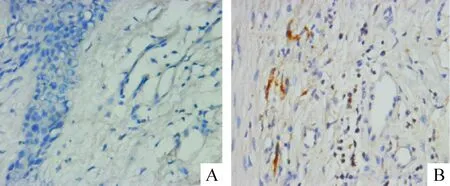
Figure 1. The immunohistochemical staining of cleaved caspase-3 in the foot skin(×400).A: non-diabetic control; B: diabetic group.
讨 论
糖尿病足发病率高,危害性极大,是糖尿病致残致死的重要原因。研究糖尿病皮肤病变发病机制对于促进足溃疡愈合、预防截肢和改善糖尿病足预后具有重要意义。
细胞凋亡又称为程序性细胞死亡,对维持组织器官的正常形态和功能起重要作用。正常的创面愈合过程主要包括炎症反应、细胞增殖、组织成熟和重塑3个阶段。在伤口组织成熟和重塑阶段,炎症细胞的清除和伤口愈合肉芽组织转变为瘢痕组织时大量细胞成分的减少主要是遵循细胞凋亡的途径,表明凋亡机制在伤口愈合过程中发挥作用。伤口难愈既可能与细胞的增殖减慢有关,也可能与细胞的凋亡增加有关。早期不恰当的凋亡增加使成纤维细胞、内皮细胞和新生血管减少可能是糖尿病伤口延缓愈合的重要原因之一[2]。在动物模型中,Darby等[3]观察到非肥胖型糖尿病大鼠的创伤愈合速度明显慢于正常大鼠对照组,糖尿病组损伤部位的细胞增殖率明显低于对照组,细胞凋亡明显增加,而对照组则极少观察到细胞凋亡的发生。在2型糖尿病鼠的齿龈伤口,成纤维细胞增殖仅为正常血糖组的一半;而成纤维细胞凋亡是正常血糖组的6倍,伤口愈合延迟[4]。我们在动物实验的基础上,进一步研究了人糖尿病足伤口形成后,创面皮肤细胞凋亡的情况。通过TUNEL检测发现糖尿病伤口皮肤细胞凋亡指数为(8.4±1.5)%,比非糖尿病伤口组(3.8±0.8)% 显著增高,同时发现凋亡关键分子活化caspase-3在糖尿病足慢性伤口皮肤中的表达(IRS)是非糖尿病足患者的3倍。Caspase家族是细胞凋亡的介导者和执行者,在引起凋亡中起关键作用。Cleaved caspase-3表达增高时提示依赖caspase途径的细胞凋亡增加。研究结果进一步表明细胞凋亡增加是糖尿病足皮肤溃疡迁延不愈的重要原因之一。
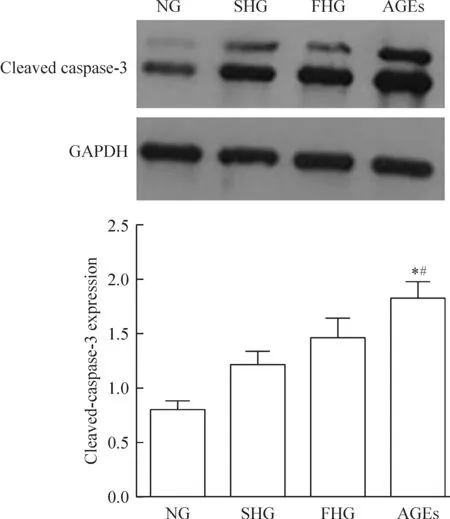
Figure 3. The results of cleaved caspase-3 analyzed by Western blotting in human fibroblasts treated with normal glucose (NG), sustained high glucose (SHG), fluctuant high glucose (FHG) or AGEs. Mean±SD. n=3.*P<0.05 vs NG group; #P<0.05 vs SHG group.
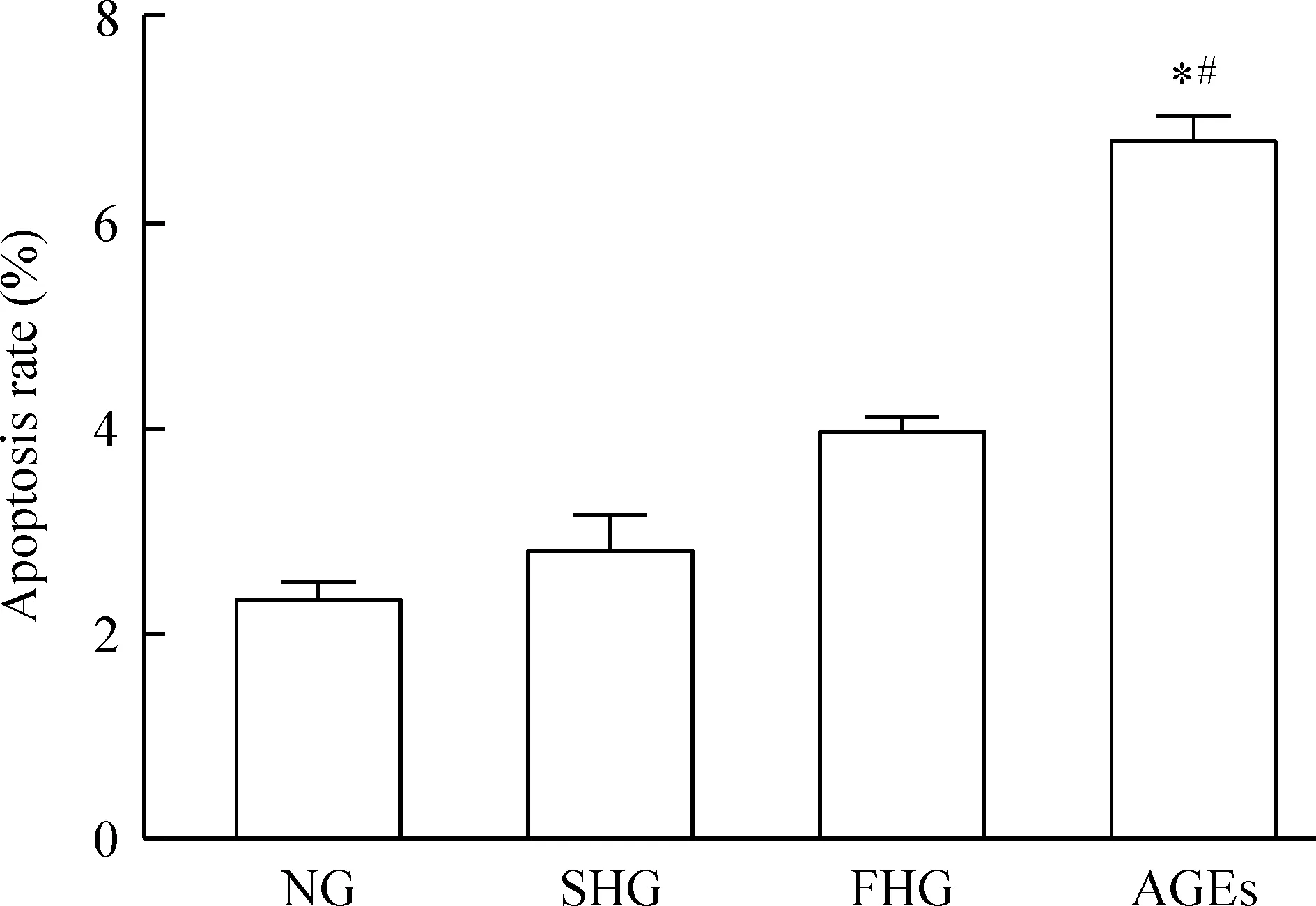
Figure 4. The results of apoptosis analyzed by flow cytometry in human fibroblasts treated with normal glucose(NG), sustained high glucose (SHG), fluctuant high glucose (FHG) or AGEs. Mean±SD. n=3. *P<0.05 vs NG group;#P<0.05 vs SHG group.
我们对发生凋亡的细胞类型进行分析,发现凋亡细胞以真皮层中的成纤维细胞为主,角质形成细胞有少量发生。这可能与糖尿病病理状态对不同类型细胞的影响不同有关。Xu等[5]报道,在糖尿病病理状态下,炎症因子和趋化因子活性增强,间质干细胞增殖和分化能力下降,内皮祖细胞动员减少,血管再生能力降低,角质形成细胞和成纤维细胞的迁移和增殖能力降低,凋亡增加。这些因素共同参与了糖尿病溃疡的发生和发展。其中,糖尿病状态对角质形成细胞的影响以降低迁移和增殖能力为主,而对成纤维细胞的影响,除了降低迁移和增殖能力,还显著地增加细胞凋亡。成纤维细胞是创面愈合的主要修复细胞之一,是构成肉芽组织的主要成分之一,是合成和分泌多种细胞因子和合成胶原、纤维连接蛋白和透明质酸等细胞外基质的主要细胞。因此,糖尿病病理状态下,成纤维细胞的凋亡增加,必然阻碍皮肤溃疡的愈合。
目前研究表明,糖尿病慢性并发症的发生发展除了与血糖整体水平升高有关外,还与血糖的波动密切相关。在对细胞凋亡的影响研究中,目前认为慢性持续高血糖和急性血糖波动均能导致氧化应激,促进细胞凋亡。而血糖波动触发的氧化应激程度更高,损伤作用更为明显[6-7]。Risso等[8]报道,间歇的高血糖比持续高血糖更能诱导人脐静脉内皮细胞的凋亡,凋亡相关基因Bcl-2表达下降和Bax表达上升更为显著。金可可等[9]研究发现在糖化血红蛋白水平相似的糖尿病大鼠中,血糖的波动幅度增大较持续高血糖状态更能促进肾小管上皮细胞的凋亡。在本研究中,持续高糖和高糖波动诱发人皮肤成纤维细胞凋亡增加,而高糖波动组细胞凋亡率高于持续高糖组,提示持续慢性高血糖和血糖波动参与了糖尿病皮肤病变的发生发展,其诱导的成纤维细胞凋亡增加可能是伤口难愈的因素之一;血糖波动对成纤维细胞的损伤作用甚至比持续高血糖更严重。
AGEs 是还原糖和游离氨基之间经非酶促反应生成的终产物。持续高血糖引起体内多种蛋白质非酶糖基化及由此形成的AGEs在糖尿病慢性并发症的发病机制中起重要作用[10],参与了视网膜病变、神经病变及动脉粥样硬化等病变的发生发展。近年研究还发现,AGEs 也参与了糖尿病动物创面难愈:在糖尿病动物模型的饮食中增加AGEs摄入,发现可延迟糖尿病小鼠伤口的愈合[11];另外,采用晚期糖基化终末产物受体(receptor for AGE,RAGE)的内源性拮抗剂sRAGE,能够促进糖尿病小鼠的伤口愈合[12]。以上研究提示AGEs与创面难愈密切相关,但是AGEs影响创面愈合的机制未完全阐明。我们课题组在前期的研究中发现AGEs通过影响基质金属蛋白酶 9/金属蛋白酶组织抑制剂 1、α2β1整合素和磷酸化黏着斑激酶的表达,抑制表皮角质形成细胞的迁移和增殖能力,阻碍伤口愈合[13]。本实验中我们发现,AGEs除了抑制细胞增殖外,还显著诱导皮肤成纤维细胞凋亡。以上研究结果提示糖尿病状态下,长期高血糖促使皮肤局部组织非酶糖基化增加,皮肤AGEs堆积,引起组织细胞结构和功能异常,促进细胞凋亡,是创面难以愈合的重要机制之一。我们的研究表明,在对人皮肤成纤维细胞凋亡的影响中,不同因素影响程度不一样。相对于持续高血糖和血糖波动,AGEs水平升高促进凋亡的作用更强。我们在糖尿病创面的治疗策略中,除了要平稳地控制高血糖外,还应重视阻断AGEs的作用,积极寻找减少或清除AGEs的方法。探讨糖尿病病理状态下成纤维细胞的促凋亡和抗凋亡因素有助于进一步揭示糖尿病伤口难愈的机理,为临床糖尿病难愈创面的治疗提供新思路。
[参 考 文 献]
[1] Frykberg RG. A summary of guidelines for managing the diabetic foot[J]. Adv Skin Wound Care, 2005,18(4):209-214.
[2] Bhan S, Mitra R, Arya AK, et al. A study on evaluation of apoptosis and expression of bcl-2-related marker in wound healing of streptozotocin-induced diabetic rats[J]. ISRN Dermatol, 2013,2013:739054.
[3] Darby IA, Bisucci T, Hewitson TD, et al. Apoptosis is increased in a model of diabetes-impaired wound healing in genetically diabetic mice[J]. Int J Biochem Cell Biol, 1997,29(1):191-200.
[4] Desta T, Li J, Chino T, et al. Altered fibroblast proliferation and apoptosis in diabetic gingival wounds[J]. J Dent Res, 2010,89(6):609-614.
[5] Xu F, Zhang C, Graves DT. Abnormal cell responses and role of TNF-α in impaired diabetic wound healing[J]. Biomed Res Int, 2013,2013:754802.
[6] Hao ML, Dai YY, Ni SR, et al. The role of JNK in apoptosis of renal tubular epithelial cells in diabetic rats with fluctuant high blood glucose[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2012,28(4):309-312.
[7] 李素娟,李剑敏,汪 洋,等. 氧化应激和P53 参与波动高糖诱导的肾小管上皮细胞凋亡[J]. 中国病理生理杂志,2011,27(12): 2302-2306.
[8] Risso A, Mercuri F, Quagliaro L, et al. Intermittent high glucose enhances apoptosis in human umbilical vein endothelial cells in culture[J]. Am J Physiol Endocrinol Metab,2001,281(5): E924-E930.
[9] 金可可,林艳红,王万铁,等. 血糖波动对糖尿病大鼠肾小球内皮细胞和肾小管上皮细胞凋亡的影响[J]. 中国病理生理杂志,2007, 23(3): 570- 573.
[10] Vlassara H, Bucala R, Striker L. Pathogenic effects of advanced glycosylation: biochemical, biologic, and clinical implications for diabetes and aging[J]. Lab Invest, 1994,70(2):138-151.
[11] Peppa M, Brem H, Ehrlich P, et al. Adverse effects of dietary glycotoxins on wound healing in genetically diabetic mice[J]. Diabetes,2003,52(11): 2805-2813.
[12] Goova MT, Li J, Kislinger T, et al. Blockade of receptor for advanced glycation end-products restores effective wound healing in diabetic mice[J]. Am J Pathol, 2001,159(2):513-525.
[13] Zhu P, Yang C, Chen LH, et al. Impairment of human keratinocyte mobility and proliferation by advanced glycation end products-modified BSA[J]. Arch Dermatol Res,2011,303(5):339-350.
