硫化氢通过抑制氧化应激改善高糖诱导的内皮细胞衰老*
2014-08-09宋志明郝宝顺牛海名刘定辉余舒杰余显冠凌叶盛朱洁明钱孝贤
宋志明, 王 敏, 刘 勇, 郝宝顺, 牛海名, 刘定辉, 余舒杰, 周 彬, 吴 琳, 余显冠, 凌叶盛, 彭 沛, 朱洁明, 陈 璘, 钱孝贤,2△
(中山大学 1附属第三医院心血管内科, 2中西医结合研究所,广东 广州 510630)
冠状动脉粥样硬化性心脏病已经成为全球致残致死最常见的心血管疾病之一,血管内皮细胞功能的障碍则是冠心病发生与发展的重要危险因素[1]。大量临床研究证实糖尿病患者发生冠心病的风险以及病变严重程度都比其他人群严重;同时,一些研究发现与年龄相随的内皮细胞衰老大大促进了血管事件,而高血糖可以加速内皮细胞的衰老[2]。因此,预防高血糖诱导的内皮细胞衰老或许是一个新的治疗糖尿病相关性动脉粥样硬化的靶点。
硫化氢(hydrogen sulfide,H2S)是第3种在人体内被发现的气体信号分子,它在维持心血管系统平衡中起到了重要作用[3]。在糖尿病患者以及糖尿病大鼠血液中,它的含量显著降低,血管内皮功能受损,而如果给予外源性硫化氢,内皮功能有所恢复[4-5]。本研究旨在观察外源性H2S是否对高糖诱导的内皮细胞衰老具有一定的治疗作用,并进一步探讨其作用机制。
材 料 和 方 法
1 材料
葡萄糖、甘露糖醇、MTT、NaHS和DMSO购自Sigma-Aldrich。预染蛋白条带标志购自Fermentas。Ⅰ型胶原酶购自Invitrogen。无血清培养基(serum-free medium, SFM)、M199培养基和胎牛血清(fetal bovine serum, FBS)购自Gibco。内皮细胞生长添加剂(endothelial cell growth supplement, ECGS)购自BD,抗NF-κB p65、磷酸化NF-κB p65和超氧化物歧化酶1(superoxide dismutase 1, SOD1)抗体购自Epitomics。抗纤溶酶原激活物抑制剂 1 (plasminogen activator inhibitor 1, PAI-1) 抗体购自Santa Cruz。抗GAPDH内参照抗体购自Proteintech。小鼠及兔Ⅱ抗购自武汉博士德。丙二醛(malondialdehyde, MDA)测试盒购自南京建成,细胞裂解液和蛋白定量试剂盒(BCA法)购自南京凯基。
2 细胞分离培养
取健康无菌新生儿脐带,PBS冲洗3遍,然后用0.1%胶原酶(Ⅰ型)消化15 min,收集胶原酶细胞混合液,1 200 r/min离心5 min,弃上清,加完全培养基(20%FBS、20%SFM和60 mg/L ECGS)混匀种于培养瓶里培养。实验中所使用细胞为1~3代。
3 流式细胞术检测
收取第1代内皮细胞,交由中山大学附属第一医院实验室用流式细胞仪检测细胞表面标志物CD31。
4 内皮细胞衰老模型的建立
内皮细胞在6孔板内生长至70%时,加入33 mmol/L葡萄糖培养48 h[6]。通过衰老相关β半乳糖苷酶(senescence-associated β-galactosidase,SA-β-Gal)染色和衰老标志物PAI-1的检测判断模型成功与否。SA-β-Gal染色参照Liu等[7]研究的方法进行。PAI-1的检测方法参见免疫蛋白印迹部分。
5 细胞存活率的测定
内皮细胞接种于96孔板中,每孔4 000个细胞,24 h后根据实验需要进行不同处理,每个处理因素设5个复孔。处理结束后,每孔加入20 μL 5 g/L MTT培养4 h;去除培养基后,每孔加入150 μL DMSO,用锡箔纸遮盖后置于摇床上15 min充分摇匀。最后在490 nm处,用酶标仪读取各孔的吸光度值(A)。
6 免疫蛋白印迹
6.1蛋白提取 细胞处理结束后,吸去培养基,用预冷的PBS冲洗2遍,每孔加70 μL细胞裂解液,放于冰上孵育15 min,用细胞刮刮下细胞,将细胞裂解物吸至预冷的1.5 mL离心管中,13 200 r/min 4 ℃离心15 min;小心吸取上清,分装保存于-80 ℃。
6.2Western blotting 经BCA定量后,总蛋白进行SDS-PAGE 电泳,然后转移到NC膜上。用5%脱脂奶粉室温封闭1 h后,加入相应抗体,4 ℃摇床过夜孵育;弃去Ⅰ抗,TBST洗3次,每次5 min,加入小鼠或兔Ⅱ抗,室温孵育1 h后,TBST洗3次后ECL显影,最后用Quantity One 软件分析蛋白条带。
7 MDA含量测定
采用硫代巴比妥酸法测定细胞培养液中的MDA含量,操作过程严格按照说明书进行。
8 统计学处理
用SPSS 13.0统计软件分析,定量资料用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 HUVECs的鉴定
流式细胞术检测表明第1代内皮细胞CD31抗原阳性率99.92%,符合内皮细胞特性,见图1。
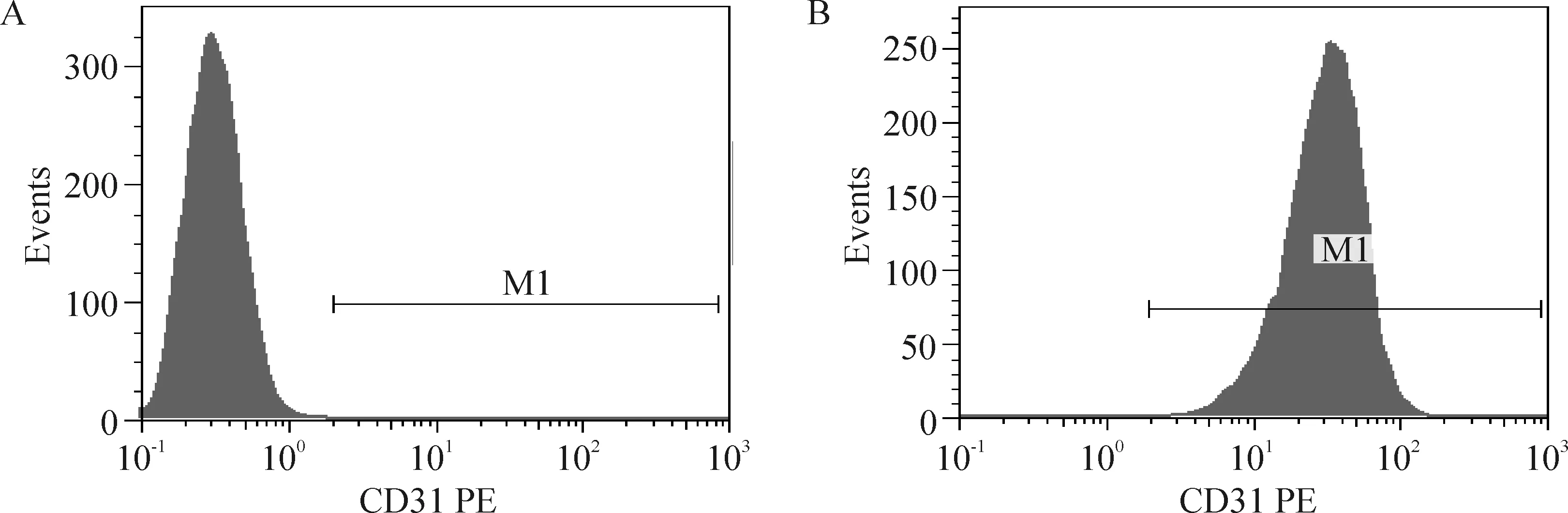
Figure 1. Positive rate of CD31 on the surfaces of cells detected by flow cytometry.A: negative control; B: passage 1 cells.
2 高糖诱导的衰老模型
内皮细胞生长至70%时,加入33 mmol/L葡萄糖或甘露醇,继续培养48 h。结果发现高糖组(HG组)细胞生长缓慢,形态扁平,PAI-1蛋白表达大幅度增加,SA-β-Gal染色阳性细胞增加,与正常对照组(5 mmol/L 葡萄糖,Con组)及高渗对照组(mannitol,M组)相比具有显著差异,而高渗组与正常组之间无显著差异,见图2A、B。同时,MTT结果显示,与2个对照组相比,高糖组细胞数目明显减少(P<0.05),见图2C。所以,高糖作用内皮细胞48 h可以成功诱导衰老模型。
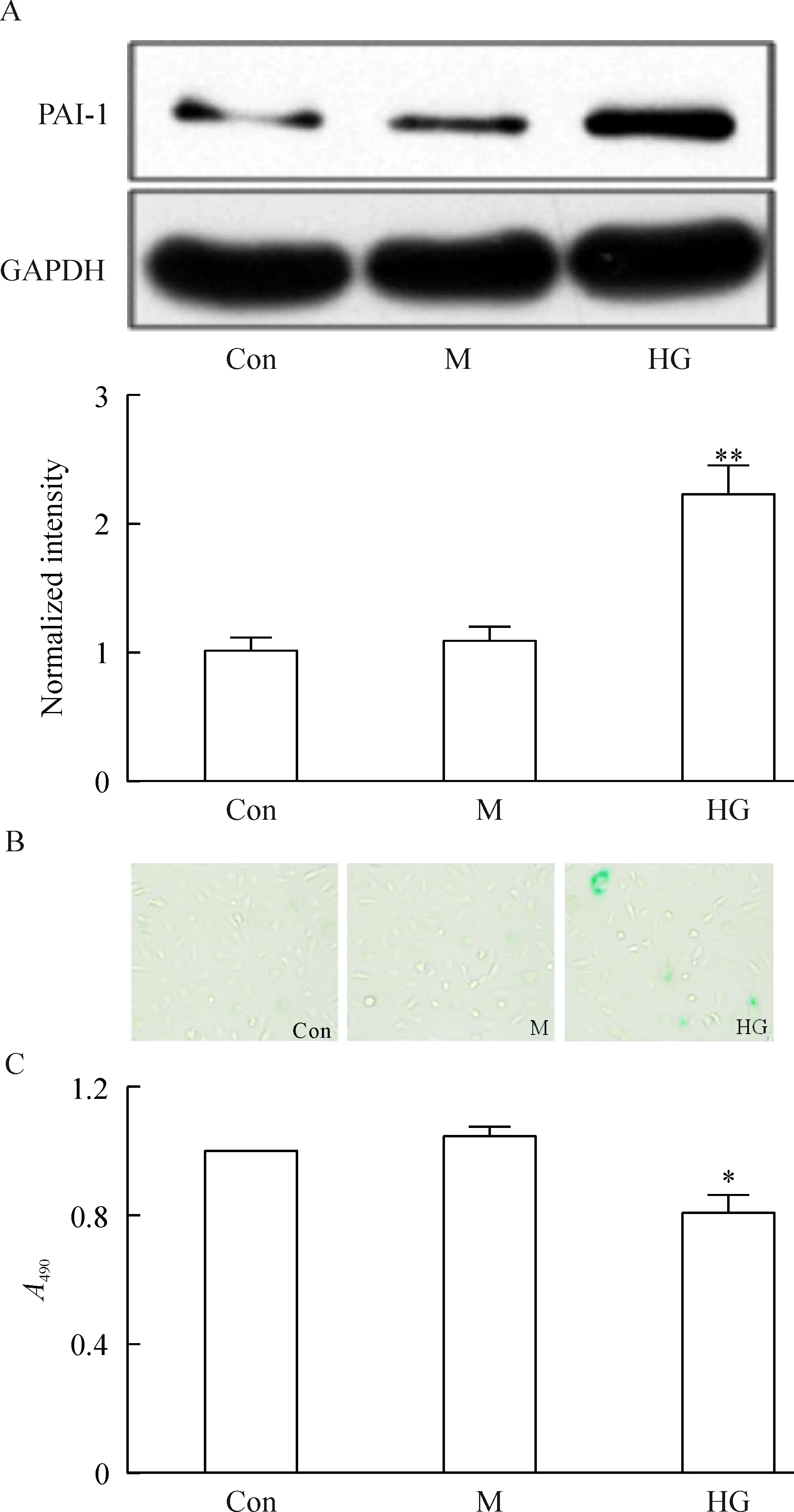
Figure 2. Effects of high glucose on cell senescence and viability. A: Western blotting of PAI-1 and normalized ana-lysis of intensity; B: images of SA-β-Gal staining (×100); C: the cell viability detected by MTT assay.Con: control group; M: mannitol group; HG: high glucose group.Mean±SD. n=3.*P<0.05,**P<0.01 vs M group.
3 不同浓度NaHS对细胞活性的影响
内皮细胞接种于96孔板,生长24 h后,分别给予50、100、200和500 μmol/L NaHS。48 h后,MTT检测发现,除了500 μmol/L NaHS外,其它浓度对内皮细胞的生长均没有影响,见图3。所以,以后的实验就选用50、100和200 μmol/L 3个浓度对细胞进行干预。
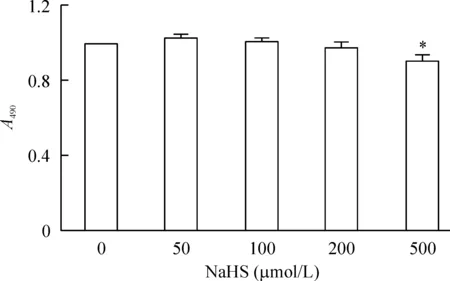
Figure 3. The effect of different concentrations of NaHS on cell viability. Mean±SD. n=3.*P<0.05 vs 0 μmol/L group.
4 NaHS对高糖刺激后细胞生长的作用
内皮细胞生长至60%时分别给予50、100和200 μmol/L NaHS,共同孵育6 h后,相应加入葡萄糖或甘露醇。培养48 h后,MTT结果发现与高糖组相比,除50 μmol/L NaHS没有显著差异外,100和200 μmol/L NaHS都能明显增加细胞数目(P<0.05),见图4。
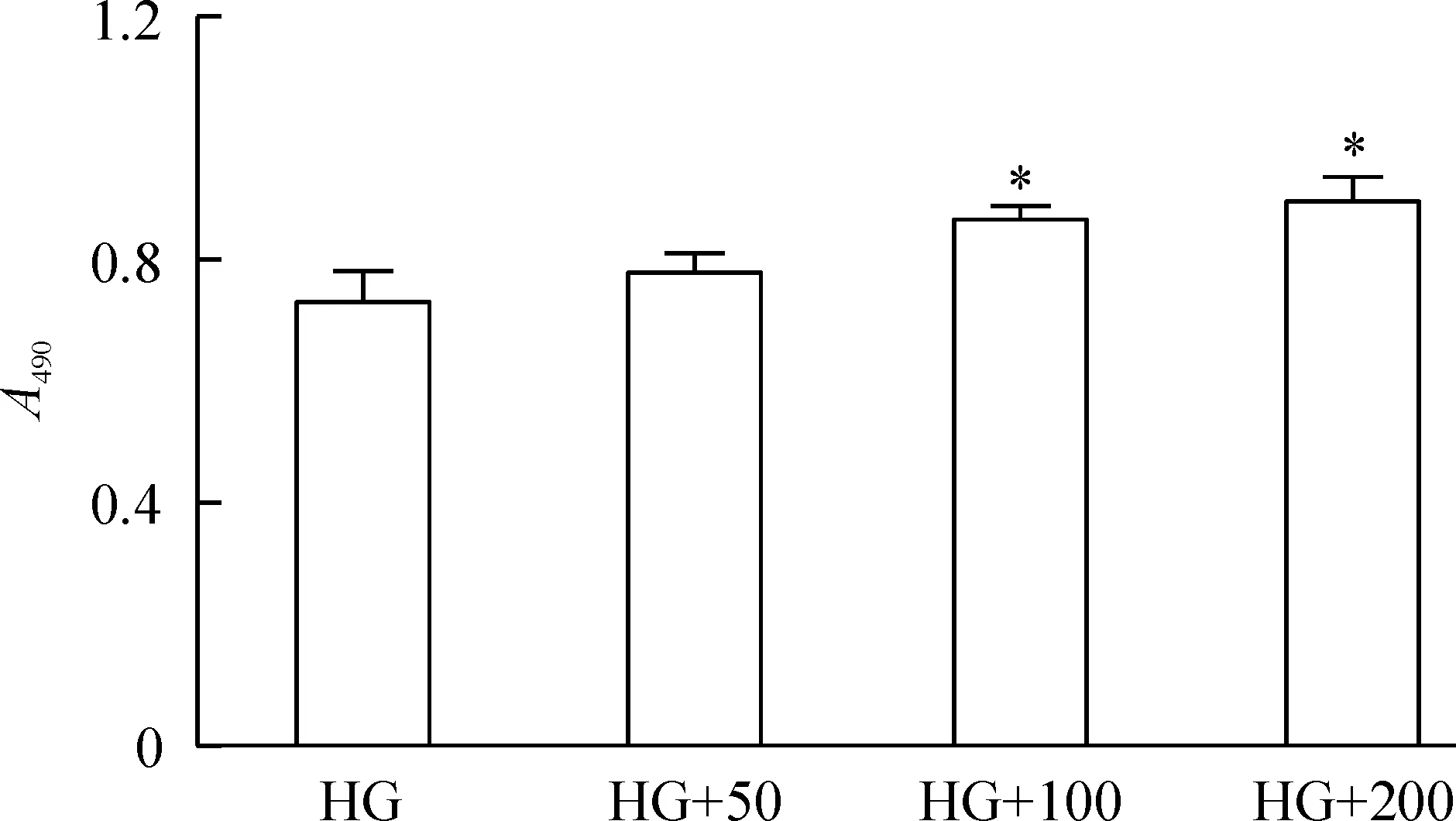
Figure 4. NaHS influenced cell viability under high glucose condition.HG: high glucose; HG+50: high glucose plus 50 μmol/L NaHS; HG+100: high glucose plus 100 μmol/L NaHS; HG+200: high glucose plus 200 μmol/L NaHS. Mean±SD. n=3.*P<0.05 vs HG group.
5 NaHS对高糖诱导内皮细胞衰老的影响
通过对PAI-1蛋白检测发现,NaHS单独干预组对PAI-1蛋白表达无显著影响,100和200 μmol/L NaHS均能显著减少高糖诱导的PAI-1蛋白表达,而50 μmol/L NaHS尚不能降低PAI-1蛋白表达,见图5。同时,SA-β-Gal染色结果也证实了100和200 μmol/L NaHS能明显减少SA-β-Gal阳性细胞数目,见图6。综合图4~6的结果,100和200 μmol/L NaHS能很好地减轻高糖诱导的内皮细胞衰老。在后续研究NaHS对衰老的作用时,只是选择了100和200 μmol/L 这2个浓度。
6 NaHS对SOD1表达的影响
高糖诱导的衰老主要是通过氧化应激作用产生的,而SOD1是生物体内重要的抗氧化物酶,是清除生物体内自由基的首要物质,具有抵抗衰老的效果。Western blotting检测发现与HG组比较,100和200 μmol/L NaHS均能显著提高SOD1的表达,见图7。
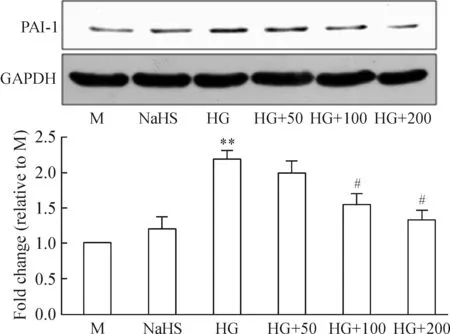
Figure 5. The effect of NaHS on PAI-1 expression.M: mannitol; NaHS: 200 μmol/L NaHS; HG: high glucose; HG+50: high glucose plus 50 μmol/L NaHS; HG+100: high glucose plus 100 μmol/L NaHS; HG+200: high glucose plus 200 μmol/L NaHS.Mean±SD. n=3.**P<0.01 vs M group; #P<0.05 vs HG group.
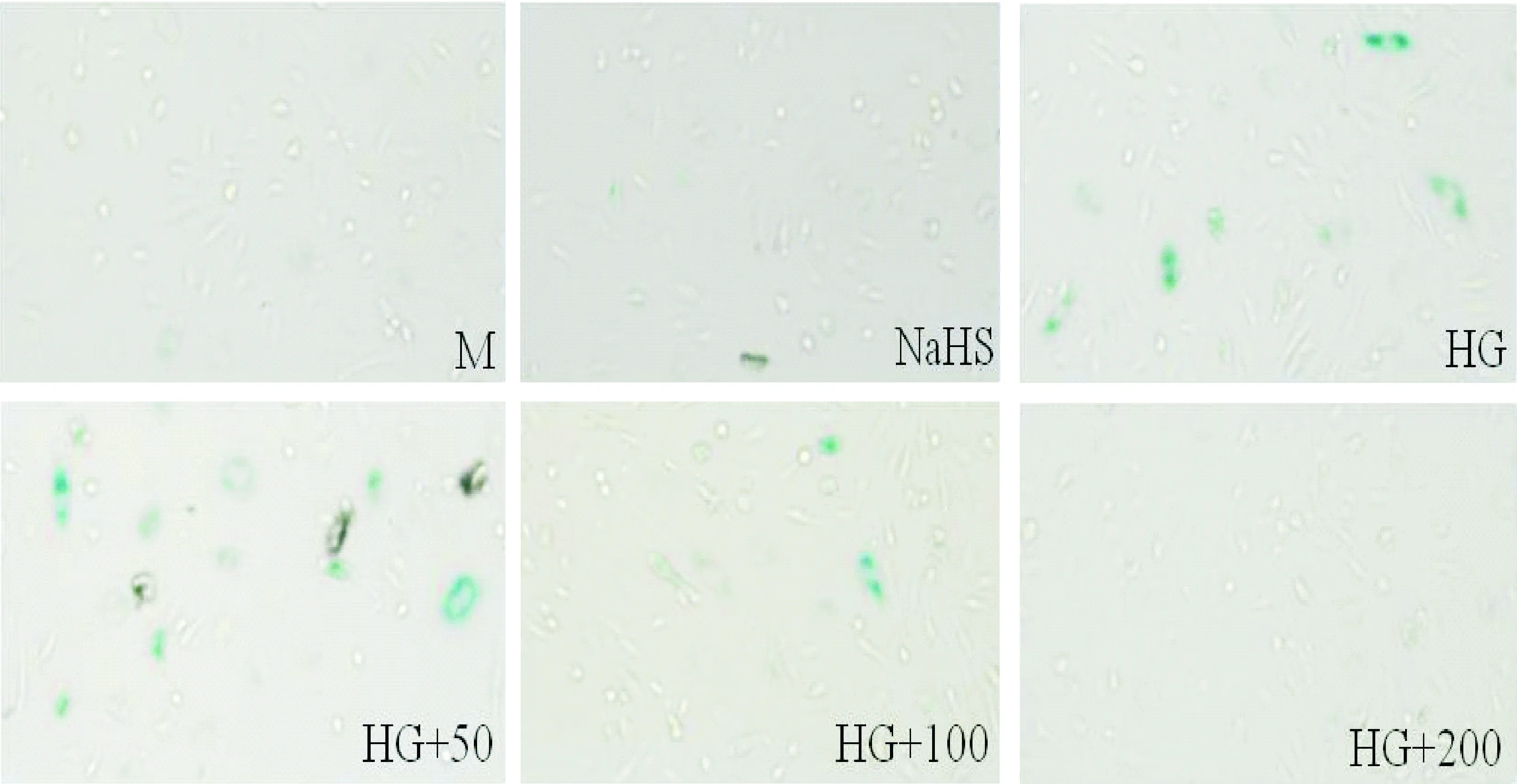
Figure 6. The effect of NaHS on SA-β-Gal activity(×100).M: mannitol; NaHS: 200 μmol/L NaHS; HG: high glucose; HG+50: high glucose plus 50 μmol/L NaHS; HG+100: high glucose plus 100 μmol/L NaHS; HG+200: high glucose plus 200 μmol/L NaHS.
7 NaHS对细胞MDA含量的影响
与正常对照相比,高糖组MDA的含量增加了1倍多(P<0.01)。而NaHS则显著降低了MDA的含量(P<0.05),见图8。
8 NaHS对NF-κB p65的影响
结果显示高糖组NF-κB p65的活性明显增加,而NaHS显著降低了其活性,见图9。
讨 论
本课题研究发现,高糖能够诱导原代脐静脉内皮细胞的衰老,而100和200 μmol/L NaHS能显著减轻高糖诱导的衰老。细胞衰老是细胞随着生物体年龄增长而发生的退行性变化的一种病理状态,分为生理性的自发性衰老和病理性的应激诱导的早熟型衰老;许多的刺激因素可以诱导或加速细胞衰老,比如低密度脂蛋白胆固醇、高糖、过氧化氢等[2, 7]。
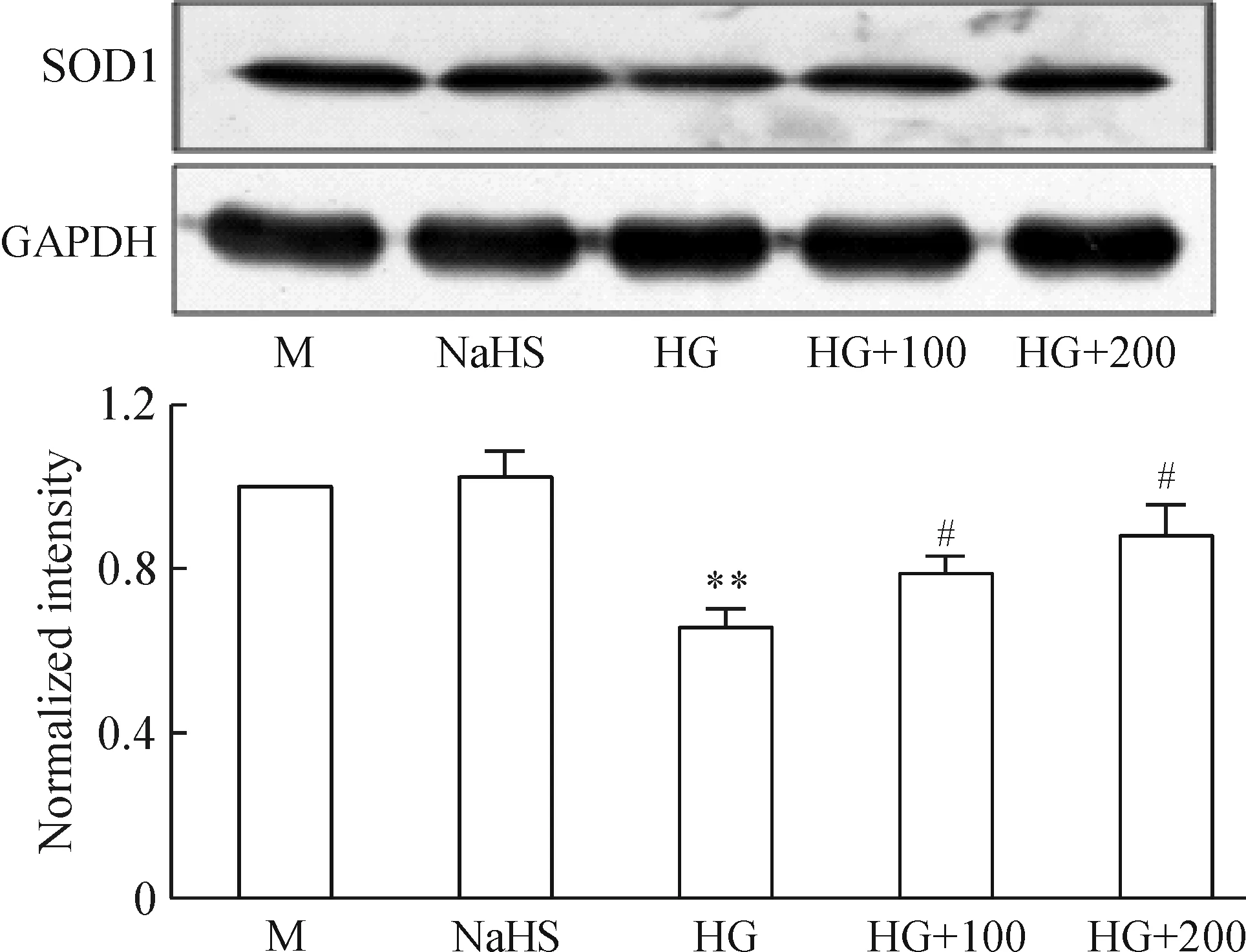
Figure 7. The effect of NaHS on SOD1 expression.M: mannitol; NaHS: 200 μmol/L NaHS; HG: high glucose; HG+100: high glucose plus 100 μmol/L NaHS; HG+200: high glucose plus 200 μmol/L NaHS.Mean±SD. n=3.**P<0.01 vs M group; #P<0.05 vs HG group.
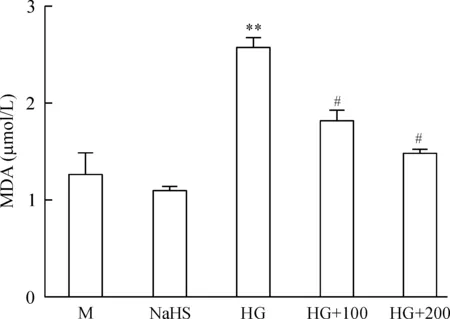
Figure 8. The effect of NaHS on MDA level.M: mannitol; NaHS: 200 μmol/L NaHS; HG: high glucose; HG+100: high glucose plus 100 μmol/L NaHS; HG+200: high glucose plus 200 μmol/L NaHS.Mean±SD. n=3.**P<0.01 vs M group; #P<0.05 vs HG group.
内皮细胞功能障碍在各种糖尿病并发症的发生发展中起到了重要作用,也是高血糖长期作用的结果[8-9]。因此,高血糖诱导的内皮细胞衰老,对于研究糖尿病疾病状态下细胞功能的改变具有重要意义。
氧自由基学说是目前较为普遍接受的细胞衰老的一个重要机制。在糖尿病或者高血糖状态下,生物体内活性氧自由基的产生增加[10]。而SOD1是体内重要的自由基清除剂,它可以消除体内氧自由基并能抗脂质过氧化,阻断自由基对组织的损伤作用。
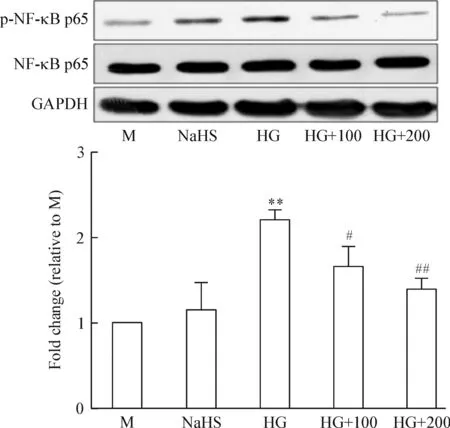
Figure 9. The effect of NaHS on the activation of NF-κB p65.M: mannitol; NaHS: 200 μmol/L NaHS; HG: high glucose; HG+100: high glucose plus 100 μmol/L NaHS; HG+200: high glucose plus 200 μmol/L NaHS.Mean±SD. n=3.**P<0.01 vs M group; #P<0.05, ##P<0.01 vs HG group.
本研究发现,高糖诱导的衰老内皮细胞中,SOD1的表达明显减少,与此同时脂质过氧化物MDA含量增加,这表明高糖可以通过提高细胞内氧化应激诱导内皮细胞衰老。
NF-κB p65是NF-κB家族重要的一个亚单位,是其发挥功能的必需亚单位,它在调控炎症反应中具有重要的作用;近年来,大量的研究发现它在衰老中同样具有重要的作用,NF-κB p65不但在衰老组织或细胞中活性增加,而且抑制它的活性可以减轻或者减缓衰老[11-12]。
H2S是继一氧化碳和一氧化氮之后在人体内发现的第3种内源性气体信号分子。近年来,越来越多的研究证实,H2S在人体心血管及神经系统中具有重要的保护作用;然而在糖尿病患者中,H2S的含量相比正常人群明显降低[3]。在对糖尿病动物的研究中发现,给予外源性H2S能够减轻糖尿病机体的损伤[13-15]。同时,有研究证实外源性H2S可以延缓过氧化氢诱导的内皮细胞衰老[16]。本研究证实了H2S可以减少MDA含量,上调SOD1的表达,抑制NF-κB p65的活化,进而减轻了高糖诱导的内皮细胞衰老。我们的研究也进一步丰富了H2S对于改善高糖所造成内皮细胞损伤的机制。
本研究结果提示,H2S能通过抑制氧化应激和NF-κB p65 的活性,抵抗高糖诱导的HUVECs衰老。当然,这需要更多的体外研究和一系列临床试验去论证,而外源性H2S减轻高血糖所诱导加速的内皮细胞衰老的机制仍需进一步探讨。
[参 考 文 献]
[1] Versari D, Daghini E, Virdis A, et al. Endothelial dysfunction as a target for prevention of cardiovascular disease [J]. Diabetes Care, 2009, 32(Suppl 2):S314-S321.
[2] Rogers SC, Zhang X, Azhar G, et al. Exposure to high or low glucose levels accelerates the appearance of markers of endothelial cell senescence and induces dysregulation of nitric oxide synthase[J]. J Gerontol A Biol Sci Med Sci, 2013, 68(12):1469-1481.
[3] Liu YH, Lu M, Hu LF, et al.Hydrogen sulfide in the mammalian cardiovascular system[J]. Antioxid Redox Signal,2012, 17(1):141-185.
[4] Jain SK, Bull R, Rains JL, et al. Low levels of hydrogen sulfide in the blood of diabetes patients and streptozotocin-treated rats causes vascular inflammation[J]. Antioxid Redox Signal, 2010, 12(11):1333-1337.
[5] Suzuki K, Olah G, Modis K, et al. Hydrogen sulfide replacement therapy protects the vascular endothelium in hyperglycemia by preserving mitochondrial function[J]. Proc Natl Acad Sci U S A, 2011, 108(33):13829-13834.
[6] Yi TN, Zhao HY, Zhang JS, et al. Effect of aspirin on high glucose-induced senescence of endothelial cells [J]. Chin Med J (Engl), 2009,122(24):3055-3061.
[7] Liu DH, Chen YM, Liu Y, et al. Ginsenoside Rb1 reverses H2O2-induced senescence in human umbilical endothelial cells: involvement of eNOS pathway[J]. J Cardiovasc Pharmacol, 2012, 59(3):222-230.
[8] Giacco F, Brownlee M. Oxidative stress and diabetic complications[J]. Circ Res, 2010, 107(9):1058-1070.
[9] Testa R, Ceriello A. Pathogenetic loop between diabetes and cell senescence[J]. Diabetes Care, 2007, 30(11):2974-2975.
[10] Yang J, Wang N, Zhu Y, et al.Roles of SIRT1 in high glucose-induced endothelial impairment: association with diabetic atherosclerosis[J]. Arch Med Res, 2011, 42(5):354-360.
[11] Tilstra JS, Robinson AR, Wang J, et al. NF-kappaB inhibition delays DNA damage-induced senescence and aging in mice[J]. J Clin Invest, 2012, 122(7):2601-2612.
[12] Hasegawa Y, Saito T, Ogihara T, et al. Blockade of the nuclear factor-kappaB pathway in the endothelium prevents insulin resistance and prolongs life spans[J]. Circulation, 2012, 125(9):1122-1133.
[13] Zhong X, Wang L, Wang Y, et al. Exogenous hydrogen sulfide attenuates diabetic myocardial injury through cardiac mitochondrial protection[J]. Mol Cell Biochem, 2012, 371(1-2):187-198.
[14] Si YF, Wang J, Guan J, et al. Treatment with hydrogen sulfide alleviates streptozotocin-induced diabetic retinopathy in rats[J]. Br J Pharmacol, 2013, 169(3):619-631.
[15] 李晓璐,黄 雯,陈 燊,等. 内源性硫化氢在糖尿病肾病病理变化中的作用[J].中国病理生理杂志, 2009, 25(11):2214-2216.
[16] Suo R, Zhao ZZ, Tang ZH, et al. Hydrogen sulfide prevents H2O2-induced senescence in human umbilical vein endothelial cells through SIRT1 activation[J]. Mol Med Rep, 2013, 7(6):1865-1870.
