动脉灌注介入联合厄洛替尼治疗晚期非小细胞肺癌合并脑转移疗效分析
2014-08-08孙立伟任秀宝
孙立伟 任秀宝
动脉灌注介入联合厄洛替尼治疗晚期非小细胞肺癌合并脑转移疗效分析
孙立伟*任秀宝△
目的回顾性分析动脉灌注介入治疗联合表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)厄洛替尼治疗非小细胞肺癌(NSCLC)合并脑转移患者的疗效,分析影响其预后的相关因素。方法45例NSCLC合并脑转移患者行选择性支气管动脉和颅内动脉化疗药物灌注治疗2~6个周期,治疗间歇期同步或后续予以厄洛替尼150 mg口服(1次/d)。每2个治疗周期或临床考虑疾病进展时评价疗效,随访获得无进展生存期(PFS)和总生存期(OS)。结果45例患者的中位治疗周期为3个周期(2~6个周期),其中完全缓解(CR)7例(15.56%)、部分缓解(PR)12例(26.67%)、稳定(SD)16例(35.56%)、疾病进展(PD)10例(22.22%),客观有效率(ORR)为42.22%(19/45),疾病控制率(DCR)为77.78%(35/45)。本组患者中位随访时间为19个月(6~45个月),中位PFS为11.90个月,中位OS为17.00个月。PS评分低者较评分高者PFS和OS更长。治疗期间共发生53例次不良反应,未见严重药物不良反应。结论动脉灌注介入治疗联合厄洛替尼治疗NSCLC脑转移的近期疗效较好,并显示出患者的生存时间获益,且不良反应轻微。
非小细胞肺癌;脑转移;动脉灌注介入治疗;厄洛替尼;近期疗效;生存分析
肺癌是全世界癌症相关死亡的主要原因[1],是严重危害人类生存健康的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的80%[2]。脑转移是NSCLC患者的常见且最为严重的并发症,发生率高达25%~40%[3]。目前,对于NSCLC脑转移缺乏有效的治疗手段,标准治疗方案为全脑放射治疗(whole brain radiotherapy,WBRT),虽可使60%~80%患者的中枢神经系统症状有所改善,但中位生存期仅3~6个月,大多数患者最终死于转移灶进展[4]。本研究对天津市环湖医院肿瘤介入科2009年1月—2012年1月收治的45例NSCLC多发脑转移,且采用选择性支气管动脉、颅内动脉介入化疗联合靶向药物治疗患者的治疗效果及预后情况进行回顾分析,为临床提供参考。
1 资料与方法
1.1 一般资料 45例NSCLC患者均经CT或MRI检查证实脑转移,无其他部位转移灶,并经组织病理或细胞学确诊原发肿瘤为NSCLC,经基因检测均为表皮生长因子受体(epidermal growth factor receptor,EGFR)阳性。曾接受过外科手术或放射治疗,其中腺癌44例、大细胞癌1例。男14例,女31例;年龄32~79岁,中位年龄56岁。吸烟21例、不吸烟24例,体力状态(performance status,PS)评分分别为1分12例、2分29例、3分4例。
1.2 治疗方法 所有患者均同时施行选择性支气管动脉及颅内动脉化疗药物灌注治疗2~6个周期,每周期间隔4周,治疗间歇期同步或后续应用EGFR酪氨酸激酶(tyrosine kinase inhibitors,TKI)抑制剂(EGFR-TKI)药物厄洛替尼治疗。
1.2.1 化疗药物动脉灌注介入治疗 采用Seldinger穿刺技术,经一侧股动脉穿刺、插管,于数字减影造影仪下插入造影导管并超选择至肿瘤供养动脉,根据术前胸部CT和头部MRI检查结果定位肿瘤灶。对于肺原发病灶,施行支气管动脉化疗药物灌注,选择羟喜树碱20~30 mg、卡铂100~200 mg、多西他赛40~60 mg或吉西他滨400~600 mg,以5%葡萄糖溶液或0.9%氯化钠溶液稀释后经输液泵缓慢注于靶动脉内;脑转移病灶则应用造影导管超选择至单侧或双侧颈内动脉和椎动脉,证实为肿瘤供养动脉后首先以20%甘露醇20 mL快速注入动脉内,而后通过输液泵以3~4 mL/min输注速度依次输入含5%葡萄糖溶液20~40 mL和替尼泊苷50~100 mg、0.9%氯化钠溶液20~40 mL和尼莫司汀25~50 mg、5%葡萄糖溶液20~40 mL和卡铂50~100 mg,进行颅内动脉(双侧颈内动脉或椎动脉)药物灌注化疗。以上治疗方案每间隔4周为1个周期,平均治疗2~6个周期。在动脉灌注介入治疗期间或介入治疗后5~7 d,予厄洛替尼150 mg口服(1次/d)。治疗期间根据患者症状,需辅助施行脱水降低颅内压、止吐、抗感染和纠正白细胞、血小板计数减少等对症支持治疗。
1.2.2 疗效与药物毒性反应评价标准 根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)对患者近期疗效(包括肺原发灶及脑转移灶)进行总体评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和疾病进展(PD),以前2项(CR+PR)叠加计算客观有效率(ORR),以前3项(CR+PR+SD)计算疾病控制率(DCR)。每隔1个月复查血常规、肝肾功能、心电图、B超及CT表现,以观察患者治疗期间药物毒性反应,每2个治疗周期或临床考虑疾病进展时评价疗效。
1.2.3 随访与生存分析 通过门诊或电话进行随访,末次随访时间为2013年6月。无进展生存期(progression free survival,PFS)系指患者首次治疗至出现疾病进展或末次随访时间;总生存期(overall survival,OS)为患者首次治疗至因任何原因死亡或末次随访日期的时间。
1.3 统计学方法 采用SPSS 17.0统计软件进行结果分析。计数资料以例(%)表示,生存时间以中位数表示,生存率的分析采用Kaplan-Meier方法,并行Log-rank检验分析生存差异。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效评价 本组45例患者均可进行疗效评价,所有患者至少完成2个周期的化疗药物支气管动脉及颅内动脉(双侧颈内动脉或椎动脉)灌注介入治疗,中位治疗周期为3个周期(2~6个周期)。其中达到CR7例(15.56%)、PR12例(26.67%)、SD16例(35.56%)、PD10例(22.22%),ORR为42.22%(19/45),DCR为77.78%(35/45)。
2.2 生存期评价 本组患者中位随访时间为19个月(6~45个月),均获得完整的PFS和OS随访;其中中位PFS为11.90个月,见图1,中位OS为17.00个月,见图2。

Figure 1 The median progression-free survival of 45 patients图1 45例患者中位无进展生存期
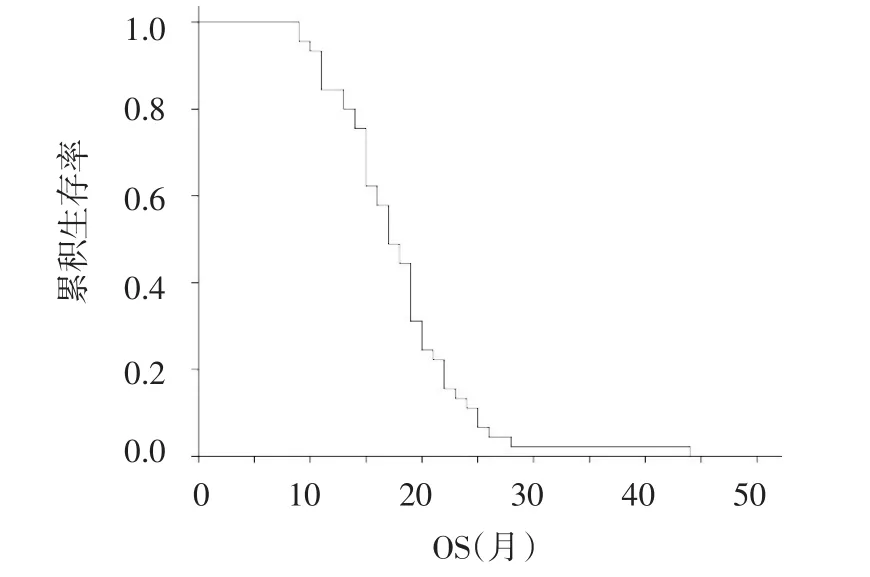
Figure 2 The median overall survival in 45 patients图2 45例患者中位总生存期
2.3 影响患者生存期因素分析 PFS生存分析示,PS评分低者较评分高者生存时间更长,见图3;男性中位PFS为10.79个月、女性11.39个月;<60岁患者中位PFS15.00个月、≥60岁患者11.75个月;吸烟者中位PFS为12.90个月、不吸烟者14.86个月。OS分析表明,PS评分低者较评分高者生存期更长,见图4;男性中位OS为19.24个月、女性21.54个月;<60岁者中位OS为18.96个月、≥60岁者16.70个月;吸烟者中位OS为18.72个月、不吸烟者19.29个月。

Figure 3 Comparison of PFS between different PS scores(1 point,2 points and 3 points)in NSCLC patients with brain metastases图3 PS评分分别为1分、2分、3分的NSCLC脑转移患者的PFS比较
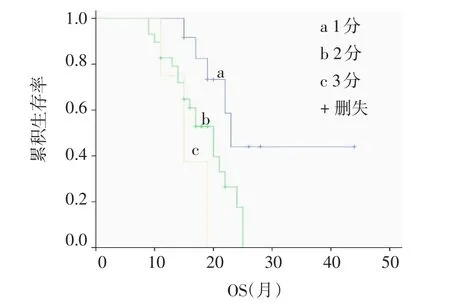
Figure 4 Comparison of OS values between different PS score(1 point,2 points and 3 points)in NSCLC patients with brain metastases图4 PS评分分别为1分、2分、3分的NSCLC脑转移患者的OS比较
2.4 药物安全性评价 治疗期间共发生53例次不良反应,其中皮疹30例(66.7%)、贫血7例(15.6%)、白细胞减少6例(13.3%)、血小板减少5例(11.1%)和胃肠道反应5例(11.1%)。反应程度均为1~2级,未观察到严重药物不良反应。
3 讨论
有研究显示约有10%的NSCLC患者就诊时即发现脑转移,6%~9%术后远隔部位转移患者脑转移为其唯一转移灶[5]。目前,WBRT是NSCLC多发脑转移的标准治疗方式,但其远期疗效并不理想。一项Ⅱ期临床试验显示,WBRT辅助6个周期的培美曲塞与顺铂化疗方案后的序贯一线治疗NSCLC多发脑转移灶的缓解率为41.9%,中位PFS和中位OS分别为4个月和7.4个月[6]。立体定向放射治疗联合WBRT的中位OS为7个月[7]。另WBRT联合EGFR-TKI治疗的中位PFS和中位OS分别为10.11个月(95%CI:5.498~14.702)和16.10个月(95%CI:14.771~17.429),1年和2年生存率分别为66.7%和14.3%[8]。
选择性动脉灌注介入化疗经动脉将化疗药物直接灌注于肿瘤组织内,未经静脉血液稀释和肝脏的首过清除效应,可提高化疗药物对肿瘤细胞的杀伤力。对于合并脑转移的患者,其血-脑脊液屏障已经破坏,加之化疗药物灌注之前需先灌注甘露醇,使得血管通透性显著增加,化疗药物可透过血-脑脊液屏障在脑脊液中达到有效抑瘤浓度。此外,动脉灌注局部给药的总剂量仅为静脉全身给药的1/4~1/3,从而降低了化疗药物对全身各脏器的不良影响,提高了患者对化疗药物的耐受性。然而,单一动脉灌注介入化疗的远期生存率并不理想。
近年来,随着 IPASS[9]、OPTIMAL[10]、ICOGEN[11]等一系列研究结果的公布,小分子TKI越来越受到关注。TKI在腺癌患者及EGFR突变患者中对于生存的获益较大[12]。厄洛替尼作为一种新型小分子EGFR-TKI,通过与ATP竞争性结合EGFR胞内部分,直接抑制EGFR-TKI并减少EGFR的自身磷酸化而诱导细胞周期抑制蛋白p27的表达,使癌细胞停滞于Gl期并诱导癌细胞凋亡发生等机制,继而导致肿瘤细胞停止生长、促进肿瘤细胞凋亡,达到延长患者生存期的目的。EGFR-TKI可透过NSCLC脑转移患者的血-脑脊液屏障,在脑脊液中达到有效抑瘤浓度[13]。然而,单纯应用EGFR-TKI对PS评分较低患者的近期疗效较差。
本组患者应用动脉灌注介入治疗联合厄洛替尼治疗,局部肿瘤杀伤力高、全身脏器低毒反应低,EGFR-TKI克服了单纯动脉灌注介入治疗远期生存率较低的不足,而动脉灌注介入治疗也弥补了单纯应用EGFR-TKI对PS评分较低患者近期疗效差的缺陷。本组45例患者PS评分为2~3分者占73.3%,近期疗效评价ORR为42.22%,DCR达77.78%。与WBRT及静脉化疗等传统治疗方式相比,获得了较好的近期疗效,患者OS延长且药物不良反应轻微,适应证广泛。但因本项研究为小样本、回顾性研究,仍有待进一步研究验证。另外,目前的研究仅提示厄洛替尼可明显缩小实体瘤体积,无法使肿瘤干细胞失活从根本上提高肿瘤的局部控制率。随着肿瘤分子病理学、肿瘤基因检测技术的发展与推广,肿瘤介入治疗的进展和分子靶向药物的研究开发,将会使更多的晚期NSCLC患者获益。
[1]Porta R,Sánchez-Torres JM,Paz-Ares L,et al.Brain metastases from lung cancer responding to erlotinib:the importance of EGFR mutation[J].Eur Respir J,2011,37(3):624-631.doi:10.1183/09031936.00195609.
[2] 曾梁,王共先.肺癌干细胞在肺癌诊断和治疗中的研究进展[J].天津医药,2011,39(12):1173-1175.doi:10.3969/j.issn.0253-9896.2011.12.032.
[3] Fan Y,Huang Z,Fang L,et al.Chemotherapy and EGFR tyrosine kinase inhibitors for treatment of brain metastases from non-smallcell lung cancer:survival analysis in 210 patients[J].Onco Targets Ther,2013,6:1789-1803.doi:10.2147/OTT.S52172.
[4] Kawabe T,Phi JH,Yamamoto M,et al.Treatment of brain metastasis from lung cancer[J].Prog Neurol Surg,2012,25:148-155.doi:10.1159/000331188.
[5] Langer CJ,Mehta MP.Current management of brain metastases,with a focus on systemic options[J].J Clin Oncol,2005,23(25):6207-6219.
[6]Barlesi F,Gervais R,Lena H,et al.Pemetrexed and cisplatin as first-line chemotherapy for advanced non-small cell lung cancer(NSCLC)With asymptomatic inoperable brain metases:a multicenter phase II trial(GFPC 07-01)[J].Ann Oncol,2011,22(11):2466-2470.doi:10.1093/annonc/mdr003.
[7]Andrews DW,Scott CB,Sperduto PW,et al.Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases:phase III results of the RTOG 9508 randomised trial[J].Lancet,2004,363(9422):1665-1672.
[8]袁岳宏,林连兴.EGFR-TKI联合同步放疗一线治疗EGFR突变型Ⅳ期非小细胞肺癌的临床观察[J].广东医学,2012,33(12):1767-1769.
[9] Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947-957.doi:10.1056/NEJMoa0810699.
[10]Zhou C,Wu YL,Chen G,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL,CTONG-0802):a multicentre,open-label,randomised,phase 3 study[J].Lancet Oncol,2011,12(8):735-742.doi:10.1016/S1470-2045(11)70184-X.
[11]Shi Y,Zhang L,Liu X,et al.Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer(ICOGEN):a randomised,double-blind phase 3 non-inferiority trial[J].Lancet Oncol,2013,14(10):953-961.doi:10.1016/S1470-2045(13)70355-3.
[12]Wu YL,Zhou C,Cheng Y,et al.Erlotinib as second-line treatment in patients with advanced non-small-cell lung cancer and asymptomatic brain metastases:a phase II study(CTONG-0803)Ann Oncol,2013,24(4):993-999.doi:10.1093/annonc/mds529.
[13]Bartolotti M,Franceschi E,Brandes AA.EGF receptor tyrosine kinase inhibitors in the treatment of brain metastases from non-smallcell lung cancer[J].Expert Rev Anticancer Ther,2012,12(11):1429-1435.doi:10.1586/era.12.121.
(2013-12-31收稿 2014-01-02修回)
(本文编辑 陈丽洁)
Efficacy Analysis on Arterial Interventional Therapy Combined with Erlotinib in Advanced Non-Small-Cell Lung Cancer with Brain Metastasis
SUN Liwei,REN Xiubao
Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center of Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China
ObjectiveTo analyse retrospectively the clinical efficacy and prognostic factors of arterial interventional therapy combined with epidermal growth factor receptor(EGFR)and tyrosine kinase inhibitors(TKI)erlotinib(erlotinib)on non-small cell lung cancer(NSCLC)patient with brain metastasis.MethodsA total of 45 NSCLC patients with brain metastasis were underwent infusion chemotherapy two-six cycles by selective bronchial artery or intracranial arterial.Erlotinib(150 mg,1/d)was used simultaneously or sequentially with the infusion chemotherapy.The clinical efficacy was assessed every two cycles or when the disease got progressed.The progression-free survival(PES)and overall survival(OS)were recorded from the follow up data.ResultsAll the patients
at least two cycles of treatment.The median number of cycles was 3(range 2-6 cycles).The results were as follows:complete remission(CR)in 7 cases(15.56%),partial remission(PR)12 cases(26.67%),stable(SD)16 cases(35.56%)and progression(PD)10 cases(22.22%).The objective response rate(ORR,CR+PR)and disease control rate(DCR,CR+PR+SD)were 42.22%and 77.78%respectively.Patients in this study were followed up for 19 months(6-45 months),with the median PFS time 11.00 months,the median OS time 17.00 months.The univariate analysis showed that patients with low PS score had longer PFS and OS than those of patients with higher PS score.There were 53 adverse events during the treatment.No serious adverse reactions of drugs were found in patients.ConclusionThe arterial interventional therapy combined with erlotinib showed a better short-term effect and prolonged survival time,and with mild side effects.
non-small cell lung cancer;brain metastasis;arterial intervention;erlotinib;term efficacy;survival analysis
R734.2,R739.41 【
】 A 【DOI】 10.3969/j.issn.0253-9896.2014.03.024
天津医科大学肿瘤医院,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室(邮编300060);*现工作单位:天津市环湖医院肿瘤介入科
△通讯作者 E-mail:rwziyi@yahoo.com
