基于火毒病机研究急性脑梗死重症大鼠皮层的核转录因子κB、c-fos蛋白表达及中药干预效应
2014-08-07王嘉麟刘雪梅邢佳王椿野贺立娟朱晓晨郭蓉娟李乐啸耿东李麒豫史华伟刘旭张允岭
王嘉麟 刘雪梅 邢佳 王椿野 贺立娟 朱晓晨 郭蓉娟 李乐啸 耿东 李麒豫 史华伟 刘旭 张允岭
基于火毒病机研究急性脑梗死重症大鼠皮层的核转录因子κB、c-fos蛋白表达及中药干预效应
王嘉麟 刘雪梅 邢佳 王椿野 贺立娟 朱晓晨 郭蓉娟 李乐啸 耿东 李麒豫 史华伟 刘旭 张允岭
目的基于“火毒”病机观察急性脑梗死重症大鼠皮层的核转录因子κB(NF-κB)、c-fos蛋白表达及中药干预效应。方法以Longa的方法略作改良制作鼠左侧大脑中动脉阻塞再灌注模型,选择Bederson评分>2分的重症急性脑梗死大鼠,对照单纯扶正方药及单纯解毒方药,观察扶正解毒方药对急性脑梗死重症大鼠的宏观表征、NF-κB、c-fos蛋白表达的影响。结果(1)假手术组脑组织细胞核明显呈淡淡的浅棕黄色,模型各组细胞核着色呈现明显的棕黄色,以缺血24小时~48小时为主要变化,给予扶正药、解毒药和扶正解毒药后,神经核着色较浅,其中以扶正解毒药改善效果较为明显,各药物组着色仍比假手术组明显。脑组织细胞浆呈现相同趋势;(2)缺血各模型组大鼠,缺血侧c-fos和NF-κB蛋白表达明显高于假手术组(P<0.01),扶正药和解毒药治疗组c-fos和NF-κB在缺血24小时~48小时时蛋白表达明显低于模型组(P<0.05~0.01),扶正解毒药治疗组在缺血各时间点c-fos和NF-κB的蛋白表达均明显降低(P<0.01)。结论重症急性脑梗死大鼠的NF-κB、c-fos蛋白明显升高;扶正解毒中药治疗重症脑梗死大鼠可能与调节NF-κB、c-fos蛋白表达水平有关。
脑梗死; 核转录因子κB蛋白; c-fos蛋白; 火毒
近年,“毒损脑络”病机假说的提出[1],极大地丰富发展了中风病的病因病机理论体系。毒邪依据其属性,可分为火毒(热毒)、寒毒、痰毒、瘀毒等。随着生活方式、环境等变化,火毒致中风论逐渐成为研究热点。火毒留滞脑络,闭阻脑窍,致使气血逆乱,神明拂逆,发为中风[2]。中风病火毒论与现代医学对脑梗死炎性细胞因子方面的研究相似。炎性因子参与免疫、应激、炎症的调节,急性脑梗死病理机制[3]之一就是以核转录因子-κB(nuclear factor-kappa B,NF-κB)为代表的炎症介质的大量释放,引起c-fos蛋白表达失调,进而导致神经细胞凋亡。前期临床工作中发现,急性脑梗死重症患者常有神志障碍、面红目赤、口唇干裂、口臭、烦躁易怒、尿赤便秘、舌红、脉数等火毒炽盛之象,也有倦怠乏力、少气懒言等壮火食气之征,提示其病机往往存在“火毒损络伤正”。基于此,本研究观察急性脑梗死重症大鼠皮层的NF-κB、c-fos蛋白表达及“扶正”、“解毒”、“扶正解毒”类中药的干预效应,以期探索“火毒损络伤正”病机的机制。
1 材料与方法
1.1实验动物及分组
健康雄性SPF级Sprague Dawley(SD)120只大鼠[批号:SCXK(京)2012-0001],体重(180±20)g。按照随机数字表法分为5组:假手术组、模型组、解毒组、扶正组、扶正解毒组,每组24只。各组再根据脑梗死时间随机分为6小时、24小时、48小时、72小时四个亚组,每个亚组6只。
1.2动物模型建立
以Zea Longa的方法[4]略作改良制作鼠左侧大脑中动脉阻塞模型,按Bederson评分方法判定模型成功,具体如下:
SD大鼠采用10%水合氯醛(35 mg/kg)腹腔注射进行麻醉,麻醉后仰卧固定于手术台上,颈部正中切开,逐层分离组织,暴露左侧颈总动脉、颈外动脉、颈内动脉,永久结扎颈总动脉近心端、颈外动脉根部,微动脉夹暂时夹闭颈总动脉的远心端,在颈总动脉结扎处远心端剪一斜口,经此斜口插入顶端光滑成球面的直径0.24 mm的尼龙线,经颈总动脉分叉处通过颈内动脉入颅至大脑前动脉的起始部,从而闭塞了大脑中动脉的起始部,造成了大脑中动脉供血相关区的梗死。尼龙线平均插入深度为(18.5±0.5)mm,结扎颈总动脉远心端以固定尼龙线和防止出血,逐层缝合皮肤,尼龙线末端暴露在体外。假手术组除插线10 mm外,其余步骤同模型组。
观察动物术后整体状况并按Bederson等的方法对动物进行神经症状体征评分。(1)提鼠尾离开地面约一尺观察前肢屈曲情况,如双前肢对称伸向地面记为0分,如手术对侧前肢出现肩屈曲肘屈曲肩内旋或既有腕肘的屈曲又有内旋者记为1分;(2)将动物置于平滑地面上分别推左右肩向对侧移动检查阻力,如对侧阻力对等且有力记为0分,如向手术对侧推动时阻力下降者记为1分;(3)将动物两前肢置一金属网上,观察两前肢的肌张力,双侧肌张力对等且抓网有力者为0分、手术对侧前肢肌张力下降记为1分;(4)提鼠尾离开地面一尺动物有不停的向手术对侧旋转者记为1分,否则记为0分;根据以上标准评分满分为4分,分数越高动物的神经症状越严重。
本研究选择Bederson评分≥2分,即神经症状较重者。
1.3给药方法
解毒方药:栀子10 g、板蓝根10 g、金银花10 g、黄芩10 g、丹参10 g。
扶正方药:党参15 g、黄芪10 g、白术10 g、丹参10 g。
扶正解毒方药:黄芩10 g、栀子10 g、板蓝根10 g、金银花10 g、党参15 g、黄芪10 g、白术10 g、丹参10 g。
分别将三方加水浸泡1小时,头煎加水为总药量的10倍,二煎加水为总药量的4倍,取汁弃渣,合并二次药汁,蒸发浓缩。均自北京中医药大学东方医院中药房购买中药饮片,自行煎制,以上煎剂质控由制剂室控制。中药各组给予相应中药汤剂灌胃,每天1次,连续给药3天。模型组给药时间和途径同中药组,以蒸馏水代替药液。
剂量根据人与大鼠体表面积公式换算:dB=dA×(RB/RA)×(WA/WB)1/3。其中dB是欲求算的大鼠的公斤体重剂量,dA是已知人的公斤体重剂量,WA、WB是已知人和大鼠的体重,RB和RA是体型系数(RB=0.09,RA=0.1)
1.4观察指标
1.4.1 宏观表征观察 以上各组大鼠均在实验3天后进行以下宏观表征观察。包括:一般行为、饮水量、饮食量、大便情况、尿量、毛发色泽、情绪反应、活动度、体重、Bederson评分等宏观表征变化。
1.4.2 梗死皮层NF-κB、c-fos蛋白测定 各组分别在实验第6小时、第24小时、第48小时、第72小时,选择6只大鼠进行测定。
各组大鼠梗死皮层NF-κB阳性细胞的测定[5]:免疫组织化学法,采用常规链霉亲和素—生物素复合物(strept avidin-biotin complex,SABC)法。一抗(兔抗鼠多克隆NF-κB P65抗体)按1:100稀释,4℃孵育过夜,随机计数5个高倍镜视野阳性细胞数。
各组大鼠梗死皮层c-fos蛋白测定[5]:免疫组织化学法,以过量的戊巴比妥(50~100 mg/kg)腹腔注射麻醉,开胸,左心室插管,灌注肝素盐水50 ml (100 μ/ml),迅速剪开右心耳并继续灌注4%多聚甲醛磷酸缓冲液300 ml,30分钟开颅取脑,去除小脑和脑干,以4%多聚甲醛固定,常规石蜡切片。采用卵白素—生物素—过氧化物酶复合物(ABC)法检测c-fos蛋白,切片常规脱腊至水,灭活内源性酶,热抗原修复滴加1∶100稀释的兔抗c-fos抗体,4℃冰箱过夜,滴加生物素化羊抗兔免疫球蛋白G(immunoglobulin G,IgG),滴加试剂SABC,二氨基联苯胺(Diaminobenzidine,DAB)显色,苏木素轻度复染。在高倍视野下(×400),观察缺血区,胞核有棕色颗粒者为阳性细胞,选取5个高倍视野计数阳性细胞的百分率。阳性细胞百分率=阳性细胞/(阳性细胞数+阴性细胞数)100%
1.5统计学方法
将获得的实验数据输入access数据库,以均数±标准差来表示,采用SPSS 17.0软件作统计分析,组间比较采用单因素方差分析(One-way ANOVA),两两组间对比采用LSD检验,以P<0.05为有显著性差异,P<0.01为有极显著性差异。
2 实验结果
2.1一般情况观察
造模前,各组大鼠体重、月龄及健康状况无统计学差异。造模后,实验动物在手术苏醒后立即观察,假手术组大鼠毛色光亮,精神状态尚可,呼吸平稳,反应敏捷,进食正常。模型组及中药各组大鼠被毛蓬乱竖起,毛色黄暗,精神萎靡,进食量减少,身体消瘦,体重减轻,出现转圈、不能直立,身体向右侧偏转或倾倒,出现偏瘫症状,表现为侧向挤压时右侧肢体肌力减弱,以前肢为重;提起大鼠尾部,右侧前肢内收或内旋,后肢伸直,四肢伸出;行走时步态不稳,向右侧偏转或倾倒;不能前行,出现原地向右侧转圈、追尾等运动,评分在3~4分。给药3天后,观察肢体偏瘫症状,中药各组均好于模型组,其中扶正解毒组好于扶正组、解毒组。
2.2免疫组化染色与图像分析
免疫组化染色显示,c-fos主要存在于细胞核内,假手术组脑组织细胞核明显呈淡淡的浅棕黄色,模型各组细胞核着色呈现明显的棕黄色,以缺血24~48小时为主要变化,给予扶正药、解毒药和扶正解毒药后,神经核着色较浅,其中以扶正解毒药改善效果较为明显,各药物组着色仍比假手术组明显。NF-κB多存在于胞浆中,假手术组脑组织细胞浆呈淡淡的浅棕黄色,模型各组着色呈现明显的棕黄色,以缺血24~48小时为主要变化,给予扶正药、解毒药和扶正解毒药后,细胞浆着色较浅,其中以扶正解毒药改善效果较为明显,各药物组着色仍比假手术组明显,见图1、图2。
图像分析结果显示,缺血各模型组大鼠,缺血侧c-fos和NF-κB蛋白表达明显高于假手术组(P<0.01);扶正药和解毒药治疗组c-fos和NF-κB在缺血24~48小时时蛋白表达明显低于模型组,有显著性差异(P<0.05~0.01),扶正解毒药治疗组在缺血各时间点c-fos和NF-κB的蛋白表达均明显降低(P<0.01),见表1。
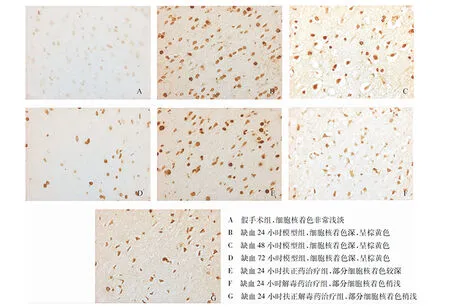
图1 各组对急性脑梗死大鼠脑组织c-fos蛋白表达的变化(×200)
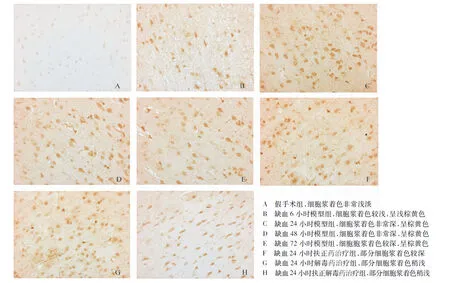
图2 各组对急性脑梗死大鼠脑组织NF-κB蛋白表达的变化(×200)
表1 各组大鼠脑组织c-fos和NF-κB蛋白表达的差异比较
3 讨论
急性脑梗死是严重威胁人类生命的三大主要死亡原因之一,有着很高的发病率、致残率和致死率,其有效的治疗还相当缺乏。急性脑梗死“毒损脑络”病机假说是本时代的产物,“火毒”是其主要切入点。火毒与急性脑梗死发病机制的众多病理产物关系密切,现代研究工作多围绕各种炎症因子展开,NF-κB具有一定代表性。许多研究表明,NF-κB参与了脑缺血再灌注损伤,调控细胞因子和炎性介质的转录,NF-κB活化增强了细胞因子等的转录,同时它们均可反过来激活NF-κB。c-fos为原癌基因,正常情况下,在神经元中呈极低水平表达,但其作为细胞核的“第三信使”,通过启动和调控某些具有特殊功能意义的靶基因的表达,对神经元的生长、分化、再生和重塑起着举足轻重的作用。研究发现,c-fos的表达与脑缺血缺氧后神经元的信息传递、凋亡密切相关。脑缺血缺氧后即快速而短暂的诱导表达。c-fos的表达参与了脑缺血耐受,是脑缺血耐受的保护机制之一。c-fos蛋白的积累说明缺血后神经元蛋白质合成能力的快速恢复[6-9]。也有学者认为c-fos参与脑缺血的损伤[10-11]。
本研究基于上述脑梗死“火毒损络伤正”的病机,选用栀子、黄芩、板蓝根、金银花等清热解毒类代表性中药联合黄芪、党参、白术扶正益气类中药,以探索扶正解毒类中药对重症脑梗死大鼠炎性因子的影响。其中,栀子、黄芩、板蓝根、金银花是清开灵注射液的主要成分,该注射液集清热解毒类药物之大成,具有显著的清热解毒之功,用于中风病急性期,效果明显。如张占军等[12]提出清开灵可减轻脑缺血再灌注大鼠的内皮细胞损伤,阻止黏附因子的表达,减轻脑缺血后炎症反应。严华等[13]指出黄芩苷、栀子苷可提高缺血损伤后神经胶质细胞分泌神经生长因子。同样,扶正类中药在脑梗死的病理机制中也起到积极作用。如黄芪注射液[14]对脑缺血性脑损伤大鼠有明显的抗炎和减轻水肿作用,显著降低脑缺血再灌注损伤后脑组织的含水量及基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)和白细胞介素-1β(interleukin-1β,IL-1β)的表达;白术多糖[15]能下调缺血区一氧化氮合酶的表达,减轻再灌注后脑水肿的程度;党参总皂苷[16]对大鼠局灶性脑缺血性损伤有保护作用,与抑制炎症相关基因的mRNA表达有关。
研究结果显示,假手术组脑组织细胞核明显呈淡淡的浅棕黄色,模型各组细胞核着色呈现明显的棕黄色,以缺血24~48小时为主要变化,给予扶正药、解毒药和扶正解毒药后,神经核着色较浅,其中以扶正解毒药改善效果较为明显,各药物组着色仍比假手术组明显。NF-κB多存在于胞浆中,假手术组脑组织细胞浆呈淡淡的浅棕黄色,模型各组着色呈现明显的棕黄色,以缺血24~48小时为主要变化,给予扶正药、解毒药和扶正解毒药后,细胞浆着色较浅,其中以扶正解毒药改善效果较为明显,各药物组着色仍比假手术组明显,提示单纯解毒、单纯扶正均在一定程度上可减轻炎性因子NF-κB的表达,两者联合后这种作用可增强。
新时期,随着人们生活水平及生活环境的变化,不良事件发生率逐渐增多,各大医院、收治的急诊内科患者数量也逐渐增多。权威数据显示,我国每年收治的急诊内科患者数量多达4000万人次[1]。急诊内科患者多呈现病情危急、发展迅速的特点,但患者及家属由于对病情不了解或者其它因素,抵抗治疗[2],导致病情恶化,威胁生命安全。因此,要对急诊内科患者加以护理,保证患者康复效果。但不同的护理方案具有不同的效果,笔者为分析人性化护理价值,报道如下:
图像分析结果显示,缺血各模型组大鼠,缺血侧c-fos和NF-κB蛋白表达明显高于假手术组(P<0.01);扶正药和解毒药治疗组c-fos和NF-κB在缺血24小时~48小时时蛋白表达明显低于模型组,有显著性差异(P<0.05~0.01),扶正解毒药治疗组在缺血各时间点c-fos和NF-κB的蛋白表达均明显降低(P<0.01),与部分文献结果相似[17-18],提示NF-κB与c-fos均参与脑缺血的损伤。
综上,重症急性脑梗死大鼠的NF-κB、c-fos蛋白明显升高,以24~48小时最为显著;扶正解毒中药可能通过调节NF-κB、c-fos蛋白对重症脑梗死大鼠起到防治作用。
[1] 常富业,王永炎.中风病毒邪论[J].北京中医药大学学报,2004,27(1):3-6.
[2] 曹晓岚,张彬.清热解毒法治疗中风病的作用机制探讨[J].环球中医药,2009,2(1):48-51.
[3] 陆征宇,董强.神经血管单元缺血后急性炎症反应的损伤机制[J].中华脑血管病杂志(电子版),2012,6(6):330-336.
[4] Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomyin rats[J].Stroke,1989,20(1):84-91.
[5] 赵宗江,周忠光,周坤福,等.组织细胞分子学实验原理与方法[M].北京:中国中医药出版社,2003:255-259.
[6] 张小乔,梅元武,刘传玉. 经颅磁刺激对脑梗死大鼠皮质c-Fos和BDNF表达的影响[J].中华物理医学与康复杂志,2006,28(2):86-89.
[8] 黄劲柏,卓廉佳,刘龙浩,等.急救穴刺血对实验性脑缺血大鼠大脑皮层、海马区c-fos mRNA表达的影响[J].中国中医急症,2012,21(4):582-584.
[9] 颜玲,黄德斌.黄芪多糖对缺血脑损伤大鼠海马神经递质及c-fos mRNA表达的影响[J].中国病理生理杂志,2012,28(2):263-268.
[10] 李斐.香丹注射液预处理对脑缺血再灌注损伤鼠c-fos表达的影响[J].国医论坛,2012,27(5):45-47.
[11] 白云,李洋,章艳,等.活血熄风方对MCAO模型大鼠脑皮质c-fos蛋白表达的影响[J].中医药信息,2012,9(1):30-31.
[12] 张占军,李澎,王忠.精制清开灵干预MCAO再灌注损伤的药效及机制研究[J].中国病理生理杂志,2006,22(11):2105-2109.
[13] 严华,张永祥,黄璐琦,等.清开灵及有效成分对培养大鼠缺血损伤神经胶质细胞分泌NGF的影响[J].中国中医基础医学杂志,2003,9(2):31-33.
[14] 王红祥,徐彬,万海同.黄芪对脑缺血-再灌注损伤大鼠MMP-9和IL-1β的影响[J]. 海峡药学,2013,25(4):17-19.
[15] 王光伟,丰昀,刘永乐,等.白术多糖对大鼠脑缺血再灌注期炎症反应的影响[J].食品科学,2009,30(19):273-275.
[16] 龚其海,谭丹枫,李菲,等.党参总皂苷对大鼠局灶性脑缺血性损伤的保护作用[J].中国新药与临床杂志,2011,30(5):339-342.
[17] 田志强,姜炎,牛延良,等.依达拉奉对大鼠脑缺血再灌注后核因子κB的影响[J].医学信息(中旬刊),2011,24(8):3540-3541.
[18] 王景霞,邓文伟,刘晓梅,等.黄芪对脑缺血再灌注损伤c-fos/c-jun表达和细胞凋亡的影响[J].黑龙江医药科学,2012,35(5):105-109.
(本文编辑:蒲晓田)
ResearchontheexpressionofNF-κB,c-fosproteininrats’cortexwithacutecerebralinfarctionandinterventioneffectoftraditionalChinesemedicinebasedonpathogenesisoffiretoxin
WANGJia-lin,LIUXue-mei,XINGJia,etal.
DongFangHospitalAffilicatedtoBeijingUniversityofTraditionalChineseMedicine,Beijing100078,China
WANGJia-lin,E-mail:WJL2008420@sina.com
ObjectiveTo observe the expression of NF-κB and c-fos in rats’ cortex with acute cerebral infarction and intervention effects of traditional Chinese prescription based on fire toxin, a pathomechanism according to Chinese medicine.MethodsThe left middle cerebral artery occlusion rats’ models were established according to our slightly modified Longa’s method and severe acute cerebral infarction in rats with Bederson score >2 were selected, compared with simple Healthy-qi supporting prescription and simple toxin relieving prescription,to study the effect on the rats’ manifestations on macroscopic level and the expression of and c-fos in rats’ cortex with acute cerebral infarction using Healthy-qi supporting and toxin relieving prescription.Results(1)The brain nuclei in the sham operation group took on pale yellowish brown color obviously, and the nuclear stained in every model group showed brown yellow, significantly in ischemic 24h~48h, then they were treated with Healthy-qi supporting prescription, toxin relieving prescription and Healthy-qi supporting and toxin relieving prescription. The nerve nuclei were stained lighter, significantly improved in Fuzhegn Healthy-qi supporting Jiedu group, and every medicine group coloring still higher than the sham operation group. The cytoplasm in brain cells showed the same trend. (2)The expression of c-fos and NF-κB of the rats in every ischemic model group in the ischemic side was significantly higher than that in sham operation group (P<0.01); c-fos and NF-κB expression in Healthy-qi supporting group, toxin-relieving group was significantly lower than that in model group after ischemia for 24h~48h (P<0.05~0.01); the expression of c-fos and NF-κB in Healthy-qi supporting and toxin relieving group at each time point after ischemia were decreased significantly (P<0.01).ConclusionThe and c-fos in the rats with severe acute cerebral infarction increased significantly; Healthy-qi supporting and toxin relieving Chinese medicine may be related to the regulation of and c-fos expression in the treatment of severe cerebral infarction rats.
Cerebral infarction; Nuclear factor-kappa B protein; c-fos protein; Fire toxin
北京市科技计划项目(Z111100056811040); 北京中医药大学创新团队发展计划(2011-CXTD-23) ; 北京中医药大学自主选题项目(JYBZZ-JS042)
100078 北京中医药大学东方医院脑病二科[王嘉麟、邢佳、郭蓉娟、张允岭、朱晓晨、贺立娟、耿东、王椿野( 博士研究生) 、李麒豫( 硕士研究生) 、史华伟( 博士研究生) 、李乐啸( 博士研究生) 、刘旭( 硕士研究生) ],实验中心( 刘雪梅)
王嘉麟(1982-),博士,主治医师。研究方向: 中西医结合防治脑病基础与临床研究。E-mail:WJL2008420@ sina.com
R277.7
A
10.3969/j.issn.1674-1749.2014.01.002
2013-10-03)
