体积法测量储氢量的状态方程研究
2014-08-07徐嘉靖王朝阳唐永建
戴 伟,徐嘉靖,王朝阳,唐永建
(1.湖北第二师范学院 物理与机电工程学院,湖北 武汉 430205;2.中国工程物理研究院 激光聚变研究中心,四川 绵阳 621900)
回顾储氢材料的发展历史,从课题诞生至今,研究的材料种类繁多[1-4],储氢性能各异,偶尔有惊人的储氢量报道[5-7],但实验的重复性不好,置信度不高[8-9]。储氢量测量的规范化作为一个衍生课题已得到研究者的密切关注。相同的样品通过不同设备仪器表征,结果差别很大,测量手段滞后于新型储氢材料的发展,这一研究现状让许多实验物理学家在研发新材料的同时,不得不开展对测量设备的改进。
目前储氢测量主要有体积法、重量法、热脱附谱法、程序升温脱附法、排水法,其中体积法是最主要的技术手段,具有装置简单,可连续测试,精度较高等优点。体积法测量储氢量的物理依据是气体的状态方程。状态方程能否真实反映氢气的压力、体积和温度间的关系(p-V-T特性),是否能准确计算出已知体积、温度、压力下气体的质量,这些都是影响测量结果的关键因素。本文从氢气分子与物质间相互作用的特点出发,建立精度更高、适用范围更广的气体状态新方程。着重研究如何真实反映氢气分子的p-V-T特性,分析真实气体在不同压力下的物理图像,提出全程压力下气体状态方程新模型。
1 气体状态方程新模型
2004年,物理学家芶清泉[10]针对高密度气体修正了范德华耳斯方程,其思路如下:高压下气体分子很密集,相互作用力较大,分子的体积会压缩,因而在范德华耳斯方程中的参数b要缩小。这说明分子活动的空间体积V相应要加大一些,将其设为c,则将范德华耳斯方程中的V修正为V+c,使方程变为:
(1)
该方程仍然很简单,仅增加一个参数c,c可由实验确定,或由理论估算。可见,在范德华耳斯方程的基础上修正b,即可得到新的适合高压气体的状态方程。基于芶清泉的思想,本文研究参数c包含的物理意义,将气体分子看成柔性的,体积随压力变化,在物理图像上c应是压力的函数,压力越大,分子的体积收缩越多,范德华耳斯方程中的参数b越小,而当压力为零时,气体可认为是理想气体,c不需要修正,即为0。基于这种物理模型,可认为,理想的参数c除了具备数值上的精度外,还应满足以下物理性质:1) 压力为零时,新模型可还原成范德华耳斯方程,体积修正量c为0;2) 压力增大时,气体分子的体积效应更明显,体积修正量c应更大;3) 中低压力下,气体状态方程新模型与范德华耳斯方程一致,高压下体现自己的优势。为满足以上物理性质,将参数c描述成压力的函数c(p)=cp,并将其代入方程(1),得到气体状态方程新模型:
(2)
本文引入一个与压力p呈一次方的简单关系,目的是将分子相互作用与分子自身体积关联起来,扩大范德华耳斯方程的压力适用范围,是定性描述分子自身体积随压力变化的简单模型。式(2)在低压下(p=0 MPa)可还原成范德华耳斯方程,高压下可经受更高压力的考验,只要实验所测压力足够准确,该方程即可很好地描述全程压力下气体的真实行为。新方程结合了范德华耳斯方程及芶清泉修正方程的优点,扩大了压力的适用范围。
为验证状态方程新模型,分别采用理想气体方程、范德华耳斯方程和状态方程新模型研究氢气的性质,计算中所需要的氢气在不同温度下的密度随压力的变化参考文献[11]。参数a、b和c的计算值列于表1。
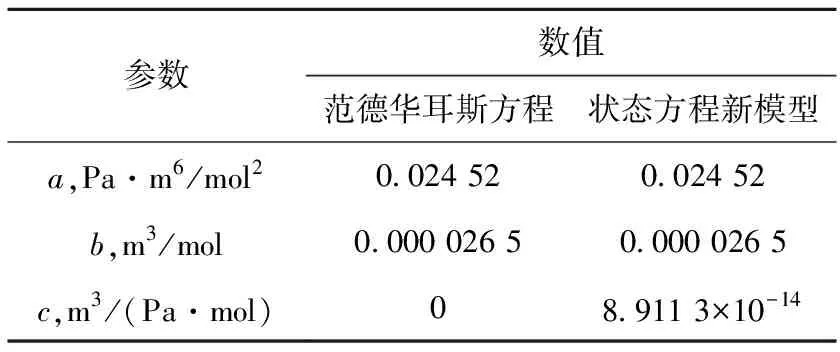
表1 不同状态方程中的参数
分别应用理想气体状态方程、范德华耳斯方程和状态方程新模型计算氢气在不同温度和压力下的摩尔体积,为便于比较,将不同温度和压力下氢气的摩尔体积转换成氢气的密度,结果示于图1。
由图1可看出,3个状态方程在压力小于5 MPa的区域内吻合得很好,随着压力的增大,本文计算结果首先偏离理想气体状态方程,当压力超过40 MPa时,计算结果与范德华耳斯方程也出现了一定的偏差,随着压力的进一步加大,这种差别越来越明显,只有新模型计算值始终与文献[11]的数据符合得很好。可见,引进的一个随压力变化的参量cp可弥补范德华耳斯方程中a、b两个参数的不足,扩大了方程的压力适用范围。状态方程新模型更好地体现了真实气体的物理图像,初步验证了状态方程新模型的合理性。
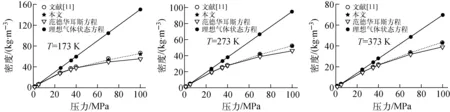
图1 氢气密度随压力的变化
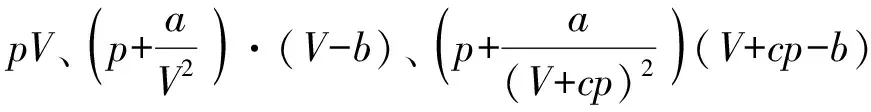
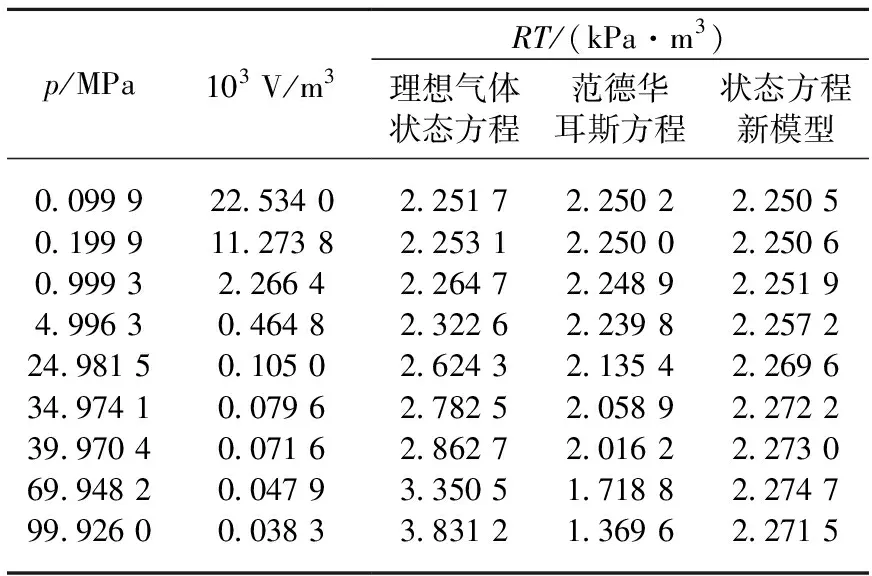
表2 273 K时1 mol氢气在不同压力下的RT
2 新模型在储氢测量中的应用
结合储氢量测量过程中的实验数据[12],分别运用理想气体状态方程、范德华耳斯方程以及状态方程新模型计算间苯二酚-甲醛碳气凝胶在不同温度、压力下的储氢吸附量。范德华耳斯方程和状态方程新模型不同于理想气体状态方程,在计算气体物质的量时,理想气体状态方程是一次方程,很容易得到解析解,而范德华耳斯方程和状态方程新模型得到解析解存在一定困难,本文将范德华耳斯方程和状态方程新模型转化为三次方程,采用牛顿迭代法,编写程序进行数值求解。储氢测量装置及原理参考文献[12]。
计算间苯二酚-甲醛碳气凝胶在81.65 K和326.15 K下的质量储氢密度和体积储氢密度,结果如图2、3所示,
由图2、3可知,随温度的升高,间苯二酚-甲醛碳气凝胶的储氢性能明显下降;随压力的增大,间苯二酚-甲醛碳气凝胶的储氢性能逐步增大。
此外由图2、3还可知,理想气体状态方程不能合理描述中高压力条件下碳气凝胶的储氢量。有关传统的体积法测量,很多工程物理科研工作者都使用理想气体来进行计算,虽然模型简单,但结果并不理想。在6.075 MPa、81.65 K条件下,理想气体状态方程的计算结果达到20.857 56%的质量储氢密度,体积储氢密度也达到了127.180 3 g/L;而用范德华耳斯方程计算的质量储氢密度为12.023 58%,体积储氢密度为73.314 52 g/L;用本文提出的状态方程新模型计算的质量储氢密度和体积储氢密度分别为11.6215%和70.863 2 g/L。在6.075 MPa下,无论是质量储氢密度还是体积储氢密度,用理想气体状态方程的计算结果均超过了美国能源部为2015年提出的任务指标参数,这种现象的出现,主要原因是理想气体状态方程模型没有考虑分子间的相互作用,同时忽略了分子自身的体积,随着压力的增大,分子越来越密集,分子自身的体积不可忽略,分子之间的相互作用效应更加明显。因此,理想气体状态方程用作体积法储氢测量的物理依据是不合适的,本文提出的状态方程新模型在中低压力下与范德华耳斯方程符合得很好,随着压力的增加,两者出现了一定的差别。

图2 碳气凝胶质量储氢密度
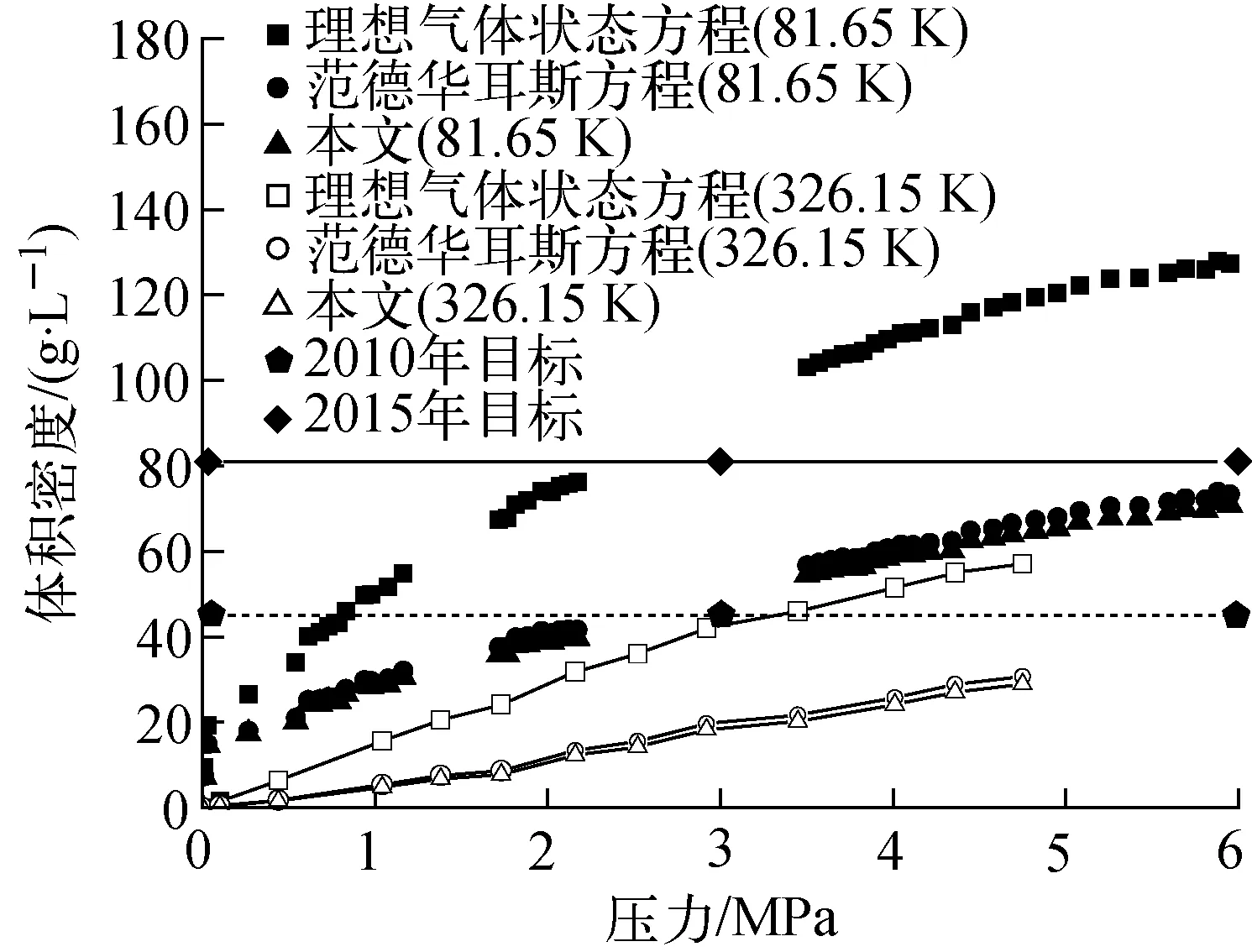
图3 碳气凝胶体积储氢密度
限于目前储氢量测量手段的现状,很难从实验研究中给出有价值的参考,相同的样品通过不同仪器表征,结果差别很大[13-14]。2009年,澳大利亚的Tian等[15]通过用KOH调节凝胶过程中的pH值,结果显示,碳气凝胶在3.5 MPa、77 K下,储氢量为5.2 %。此后,他们在碳气凝胶中参杂了nm尺度的Co粒子,在4.6 MPa、77 K条件下,储氢量达4.38%[16]。2013年,Calum等采用化学活化法进行研究,在77 K、2.0 MPa下碳气凝胶的储氢能力为3.5%~4.3%[17]。相比之下,气体状态方程新模型计算结果在趋势上与文献报道值更接近。总体来说,对于储氢量表征,有必要展开更深入的研究,尽快实现储氢测量规范化。
3 结论
基于芶清泉的物理思想,本文提出了状态方程新模型,应用状态方程新模型计算了氢气在不同温度和压力下的密度。结合储氢量测量过程中得到的实验数据,分别运用理想气体状态方程、范德华耳斯方程以及状态方程新模型计算了间苯二酚-甲醛碳气凝胶在不同温度、压力下的储氢吸附量。计算结果表明,新模型扩展了范德华耳斯方程的压力适用范围,能很好地描述全程压力下氢气的状态行为。
尽管状态方程新模型在很大程度上改善了理想气体状态方程的不足,得到了相对可信的储氢测量结果,但体积法储氢测量本身还有很多其他方面的因素需要改善,如装置的密闭性、储气室及样品室体积的标定、储气室及样品室体积的比例关系等均需开展进一步研究,以尽快实现储氢测量规范化。
参考文献:
[1] 戴伟,罗江山,唐永建,等. 氢气分子在沸石中的吸附模拟研究[J]. 物理学报,2009,58(3):1 890-1 895.
DAI Wei, LUO Jiangshan, TANG Yongjian, et al. Simulation of hydrogen adsorption in molecular sieves[J]. Acta Physica Sinica, 2009, 58(3):1 890-1 895(in Chinese).
[2] 沈军,刘念平,欧阳玲,等. 纳米多孔碳气凝胶的储氢性能[J]. 强激光与粒子束,2011,23(6):1 517-1 522.
SHEN Jun, LIU Nianping, OUYANG Ling, et al. Hydrogen storage property of nanoporous carbon aerogels[J]. High Power Laser and Particle Beams, 2011, 23(6):1 517-1 522(in Chinese).
[3] 周理. 碳基材料吸附储氢原理及规模化应用前景[J]. 材料导报,2000,14(3):3-5.
ZHOU Li. Adsorptive storage of hydrogen on carbon materials-principles and prospects of large-scale application[J]. Materials Review, 2000, 14(3): 3-5(in Chinese).
[4] KABBORU H, BAUMANN T F, SATCHER J H, et al. Toward new candidates for hydrogen storage: High-surface-area carbon aerogels[J]. Chemistry of Materials, 2006, 18(26): 6 085-6 087.
[5] CHAMBERS A, PARK C, TERRY R, et al. Hydrogen storage in graphite nanofibers[J]. The Journal of Physical Chemistry B, 1998, 102(22): 4 253-4 256.
[6] CHEN P, WU X, LIN J, et al. High H2uptake by alkali-doped carbon nanotubes under ambient pressure and moderate temperatures[J]. Science, 1999, 285: 91-93.
[7] DILLON A C, JONES K M, BEKKEDAHL T A, et al. Storage of hydrogen in single-walled carbon nanotubes[J]. Nature, 1997, 386: 377-379.
[8] RITSCHEL M, UHLEMANN M, GUTFLEISCH O, et al. Hydrogen storage in different carbon nanostructures[J]. Applied Physics Letters, 2002, 80(16): 2 985-2 987.
[9] TIBBETTS G G, MEISNER G P, OLK C H. Hydrogen storage capacity of carbon nanotubes, filaments, and vapor-grown fibers[J]. Carbon, 2001, 39(15): 2 291- 2 301.
[10] 芶清泉,董赛鹰,李萍,等. 高密度氩气的原子间相互作用与状态方程[J]. 原子与分子物理学报,2004,21(3):466-470.
GOU Qingquan, DONG Saiying, LI Ping, et al. The interaction in high density gas of argon and its equation of state[J]. Journal of Atomic and Molecular Physics, 2004, 21(3): 466-470(in Chinese).
[11] LEMMON E W, MCLINDEN M O, FRIEND D G. Thermophysical properties of fluid systems[DB/OL]. [2011]. http:∥webbook.nist.gov/cgi/fluid.
[12] 戴伟,唐永建,王朝阳,等. 自制吸附仪储氢性能测试研究[J]. 物理学报,2009,58(10):7 313-7 316.
DAI Wei, TANG Yongjian, WANG Chaoyang, et al. Characteristics of hydrogen storage studied using homemade apparatus[J]. Acta Physica Sinica, 2009, 58(10): 7 313-7 316(in Chinese).
[13] CHO S J, SONG K S, KIM J W, et al. Hydrogen sorption in HCl-treated polyaniline and polypyrrole: New potential hydrogen storage media[J]. Fuel Chem Div Prepr, 2002, 47(2): 790-791.
[14] PANELLA B, KOSSYKH L, DETTLAFF-WEGLIKOWSKA U, et al. Volumetric measurement of hydrogen storage in HCl-treated polyaniline and polypyrrole[J]. Synthetic Metals, 2005, 151(3): 208-210.
[15] TIAN H Y, BUCKLEY C E, WANG S B, et al. Enhanced hydrogen storage capacity in carbon aerogels treated with KOH[J]. Carbon, 2009, 47(8): 2 128-2 130.
[16] TIAN H Y, BUCKLEY C E, SHEPPARD D A, et al. A synthesis method for cobalt doped carbon aerogels with high surface area and their hydrogen storage properties[J]. International Journal of Hydrogen Energy, 2010, 35(24): 13 242-13 246.
[17] ROBERTSON C, MOKAYA R. Microporous activated carbon aerogels via a simple subcritical drying route for CO2capture and hydrogen storage[J]. Microporous and Mesoporous Materials, 2013, 179: 151-156.
