理想气体恒温可逆和绝热可逆过程功的比较与应用
2017-12-14贺晓凌天津工业大学环境与化学工程学院
贺晓凌 / 天津工业大学环境与化学工程学院
理想气体恒温可逆和绝热可逆过程功的比较与应用
贺晓凌 / 天津工业大学环境与化学工程学院
物理化学课程中,理想气体恒温可逆和绝热可逆过程功的知识点学生较难掌握,结合例题对二者进行阐述。物理化学课程中,理想气体恒温可逆和绝热可逆过程是两个非常重要的过程,关于二者过程功的比较和应用,学生较难掌握,本文通过结合例题分析的方式,对此知识点进行阐述。
理想气体;恒温可逆和绝热可逆过程功;比较;应用
1.理想气体恒温可逆和绝热可逆过程功的比较[1]
由物理化学知识可知,pV=K是理想气体恒温可逆过程方程,pVγ=K′是理想气体绝热可逆过程方程,分别对两个方程进行全微分,推导过程如下:

处理理想气体恒温可逆和绝热可逆过程的相关问题,关键就是依据此结论,此结论更直观通俗的理解就是:绝热可逆线比恒温可逆线陡,反映到功的投影图上则如图1所示[2]。根据此结论,从图中p~V线下面积表示功的大小角度可得(D情况除外): 理想气体恒温可逆过程所作膨胀功大于绝热可逆过程所作膨胀功;理想气体恒温可逆过程所作压缩功小于绝热可逆过程所作压缩功。这种说法只比较做功的大小,未考虑功的符号,如果按物理化学中的规定:环境对系统做功,W>0;系统对环境做功,W<0,膨胀功为系统对环境做功,则W(膨胀) <0,若考虑功的符号,对于膨胀过程则为理想气体恒温可逆过程所作膨胀功小于绝热可逆过程所作膨胀功。因此上述结论可简化为:理想气体恒温可逆过程所作体积功小于绝热可逆过程所作体积功。
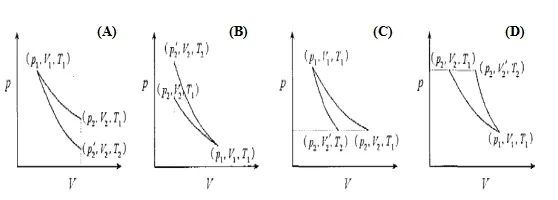
图1 理想气体恒温可逆和绝热可逆过程示意图
(A) 从同一始态膨胀到相同终态体积
(B) 从同一始态压缩到相同终态体积
(C) 从同一始态膨胀到相同终态压力
(D) 从同一始态压缩到相同终态压力
2.理想气体恒温可逆和绝热可逆过程功的应用
对理想气体恒温可逆和绝热可逆过程功进行比较,得到︱绝热可逆线斜率︱﹥︱恒温可逆线斜率︱,即“绝热可逆线比恒温可逆线陡”的结论,目的在于其正确应用。下面以例题的形式,阐述此知识点的应用。
例: 理想气体从相同始态分别经恒温可逆膨胀和绝热可逆膨胀到达相同的压力,则两种过程终态的T,V以及∆H,∆S,W之间的关系分别为 ( )


解析:理想气体从相同始态分别经恒温可逆膨胀和绝热可逆膨胀到达相同的压力,两种过程的示意图如图1(C)情况,因为绝热可逆线比恒温可逆线陡,所以可知W(恒温)< W(绝热),V(恒温)>V(绝热),由此可推出下列各种结果。

3.结束语
上述问题可以进一步引申,如果题干改为压缩过程、或末态达到相同压力,解题思路和上述解析相同,关键是抓住绝热可逆线比恒温可逆线陡的结论,再结合p~V图,即可获得正确答案。由此可知,对于一个较难理解的知识点,要掌握问题的根本,抓住解决问题的关键,这是学好物理化学行之有效的方法。在教学过程中,要多对学生进行此方面技能的示范与引导,从而取得良好的教学效果。
[1]天津大学物理化学教研室编.物理化学(第五版).高等教育出版社.2010.
[2]陈良坦, 张来英, 吴金添.物理化学教学中的几个问题.大学化学.2006,21(1):13-16.
