Shewanella oneidensis MR-1异化还原Fe(III)介导的As(III)氧化转化
2014-08-07汪明霞司友斌安徽农业大学资源与环境学院安徽合肥230036
汪明霞,王 娟,司友斌(安徽农业大学资源与环境学院,安徽 合肥 230036)
Shewanella oneidensis MR-1异化还原Fe(III)介导的As(III)氧化转化
汪明霞,王 娟,司友斌*(安徽农业大学资源与环境学院,安徽 合肥 230036)
在实验室模拟条件下,研究了Shewanella oneidensis MR-1作用下Fe(III)还原和As(III)氧化动力学及其影响因素.结果表明,Fe(III)被还原为 Fe(II)的同时伴随着 As(III)氧化为 As(V);S. oneidensis MR-1 在含低浓度 As(III)培养基上生长良好,在高浓度培养基上生长被抑制;As(III)通过制约菌体的生长与活性来抑制Fe(III)异化还原.同样,适量浓度的Fe(III)含量对As(III)氧化转化有很强的促进作用,但是过高浓度的Fe(III)浓度使得溶液中产生过多的Fe(II),从而对As(III)氧化转化有一定程度的抑制作用.此外,弱碱环境更有利于As(III)氧化转化.
铁异化还原;氢氧化铁;As(III,V);氧化还原
砷(As)作为一种典型的有毒元素,可致畸、致癌、致突变,并通过“三废”进入水体和土壤而成为重要的污染源[1].在自然条件下的水体和土壤环境中,砷主要以无机形态存在,其常见价态有+3和+5价.氧化还原电位和pH值是影响水体中砷形态的主要因素[2],在还原条件下 As(III)是主要存在形态;而在氧化条件下 As(V)是主要存在形态.在大多数环境条件下,As(V)能够强烈吸附于铁铝氧化物表面,从而限制了其移动性[3],而As(III)由于较少被吸附而具有较大迁移性,其毒性约是As(V)的60倍,故常用的污染修复处理是先将As(III)氧化为As(V).
砷对氧化还原条件变化较为敏感,其迁移转化主要取决于环境中氧化还原条件的变化.铁在湿地环境中的生物地球化学过程,对于氧化还原反应的调控有着十分重要的作用,其不同形态及价态的转化对于营养元素、痕量金属元素迁移转化有直接的影响.铁的(氢)氧化物是土壤中固定砷的主要基质,铁的形态对砷的迁移转化有着重要影响,微生物对铁的氧化还原过程显著影响砷的形态和环境行为[4].水稻中的砷,尤其是水稻根际环境中铁的微生物还原对砷迁移转化机制研究,越来越受到重视[5-6].奥奈达希瓦氏菌(Shewanella oneidensis MR-1)属于革兰氏染色阴性兼性厌氧细菌,是最先被阐明通过 Fe(III)还原使有机物氧化、获得生长所需能量的细菌,根据细菌进化16S RNA基因的系统分析法,S. oneidensis MR-1已被认定为 γ-变形菌门的亚群[7],属于铁还原细菌.铁在水稻土中的氧化还原过程已经成为一个环境热点问题,但是对于含铁氧化物在砷污染防治中的作用,众多的研究主要集中于砷污染环境中的微生物分离[8-9],铁氧化物对砷的吸附共沉淀[10]等方面,对于环境中微生物参与的铁还原和砷氧化还原之间的相互关系研究相对较少.本实验通过对S. oneidensis MR-1进行驯化与纯培养,在实验室模拟条件下,通过在同一反应体系中同时添加 As(III)和 Fe(III)及微生物混合培养,探讨 S. oneidensis MR-1对Fe(III)的还原及耦合As(III)氧化转化之间的关系,以期为水体砷污染的防治提供科学依据.
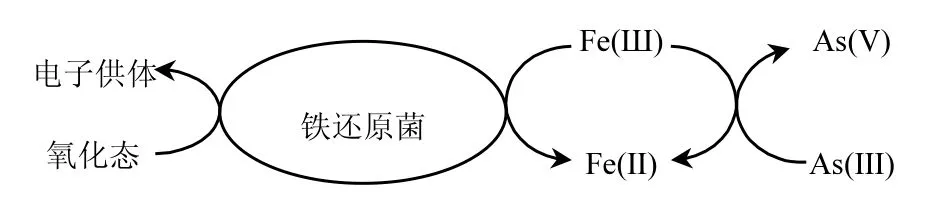
图1 S . oneidensis MR-1异化还原Fe(III)介导As(III)氧化转化Fig.1 Diagram of As(III) oxidization coupled to Fe(III) reduction by S. oneidensis MR-1
1 材料与方法
1.1 实验材料
亚砷酸钠(NaAsO2,纯度>95%);砷储备液(0.1mg/mL),于 4℃冰箱保存,实验所需稀溶液用去离子水依次逐级稀释.盐酸、氢氧化钾、硼氢化钾、硫脲均为优级纯,其他试剂均为分析纯.
菌种来源:S. oneidensis MR-1由西北农林科技大学土壤微生物实验室提供.
S. oneidensis MR-1 培 养 基 (g/L): KH2PO4·7H2O 3.0、Na2HPO4·7H2O 12.8、NH4Cl 1.0、NaAc 2.0、酵母抽提物2.0.
LB富集培养基(g/L):牛肉膏5.0,蛋白胨10.0, NaCl 5.0,pH值调至 7.0左右;固体培养基再按1.5%~2.0%的比例加入琼脂粉,121℃灭菌30min.
1.2 实验方法
人工合成 Fe(OH)3的制备方法:称取 38.07g FeCl3·6H2O 于 1L大烧杯中,加入去离子水1000mL,搅拌使其溶解,滴加1mol/L NaOH溶液,控制 pH值在 7.0~7.6之间,可得红褐色悬浮状Fe(OH)3即为人工合成的Fe(OH)3原液.人工合成的Fe(OH)3具有比表面积大和活性高的特点.
将S. oneidensis MR-1菌悬液1mL无菌操作接种至含有液体培养基的棕色瓶中,添加As(III)、As(V)溶液和人工合成的Fe(OH)3原液,充氮除氧,加盖密封.置于 30℃摇床中振荡培养,定期采集样品,测定 As形态和 Fe(II)浓度变化.同时设置不添加S. oneidensis MR-1菌悬液作为对照.每处理3次重复.
菌株的厌氧培养:在超净厌氧工作台上,将高纯氮气通过一个装有细菌过滤器的塑胶管充入装有培养液的棕色瓶中,充气15min后,快速拧紧瓶盖密封后置于30℃恒温培养箱中振荡培养.
1.3 样品处理与测定
样品摇匀后取 3组 5mL悬浊液:一组过0.45µm 滤膜,滤液用于分析溶解态的 As(III)和As(T)(总砷)浓度;一组加入浸提液为 1.0mol/L的盐酸溶液,30℃恒温振荡溶解 1h,用一次性注射器将浸提液吸出,用孔径为0.45µm滤膜过滤,收集滤液,用于测定总 As(III)和总 As(T)[11];另一组加入浸提液为0.5mol/L的盐酸溶液,恒温30℃浸提24h后,用一次性注射器将浸提液吸出,用孔径为0.22µm滤膜过滤,收集滤液,用于测定Fe(II)浓度.
砷形态测定采用 AFS-230E双道氢化物发生原子荧光仪(北京科创海光仪器有限公司),其操作条件[12]:负高压280V、主灯电流30mA、辅灯电流30mA、载流为2%盐酸、还原剂为0.5%氢氧化钾+1.0%硼氢化钾.在上述条件下,只有As(III)能够转化为AsH3并被原子吸收仪器检测出来,As(T)的测定需先将 As(V)还原为 As(III), As(T)与As(III)的差值即为体系中As(V)的浓度.
Fe(II)测定采用邻菲罗啉比色法.Fe(II)与邻菲罗啉反应生成橙红色的配合物,在510nm波长处测定溶液的吸光度.
氧化量及氧化率是按照溶液中被氧化的As()Ⅲ浓度即生成的 As(V)浓度计算,相关数据分析用Excel和Origin 8.0软件处理.
2 结果与分析
2.1 S. oneidensis MR-1作用下 Fe(III)还原和As(III)氧化动力学
在30℃、pH值7.0、Fe(OH)3初始浓度为100mg/L时,在S. oneidensis MR-1作用下,溶液中Fe(II)、As(III)的变化趋势如图2所示.
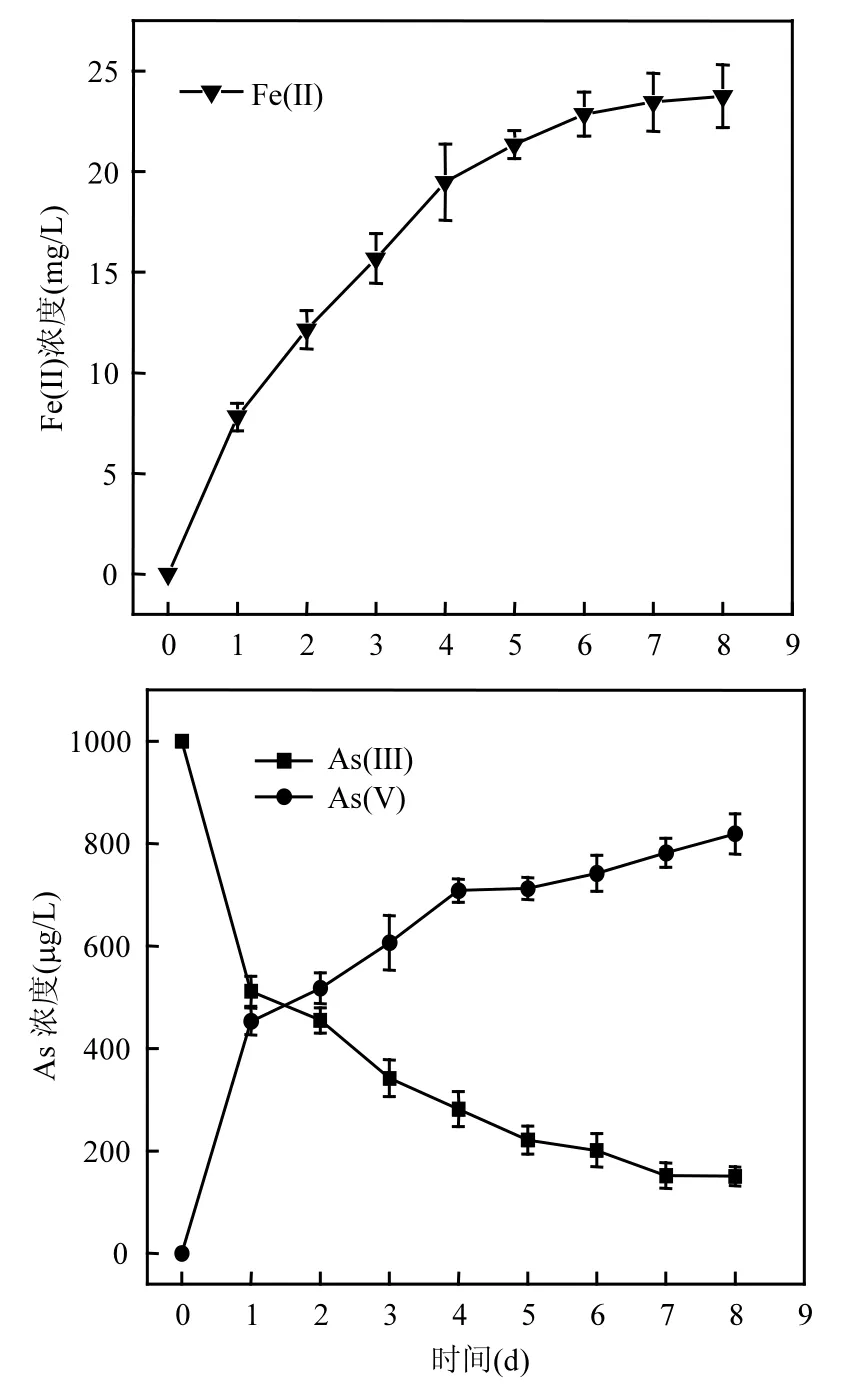
图2 S. oneidensis MR-1作用下Fe(III)还原和As(III)氧化动力学曲线Fig.2 Kinetics of Fe (III) reduction and As(III) oxidation by S. oneidensis MR-1
由图 2可见,随着 S. oneidensis MR-1对Fe(III)的还原溶解,体系中 As(III)浓度在不断下降,至第 8d达到平衡,Fe(III)还原率为 23.75%, As(III)氧化率为 81.89%.由此可知,在 S. oneidensis MR-1作用下,Fe(III)被还原为 Fe(II)过程中,As(III)同时被氧化为 As(V),其还原速率和氧化速率均在第1d达到最大值,随后逐渐下降随着 Fe(III)的还原溶解,部分砷被释放到溶液中,但整个体系中的溶解态砷呈不断下降趋势.添加S. oneidensis MR-1后As(III)的氧化率都远远大于未添加菌时的氧化率.
此外,作为对比,设置了添加 As(V)后砷的转化实验,在添加 As(V)后,体系中几乎检测不到As(III),砷均以As(V)形态存在,由于As(V)很容易吸附于铁氧化物并与之共沉淀,溶液中的溶解态砷也呈不断下降趋势.此外,添加 As(V)条件下的Fe(III)还原率高于添加 As(III)的处理,主要原因是由于As(V)对铁还原菌的毒性低于As(III).
2.2 初始As(III)浓度对S. oneidensis MR-1菌体生长及其异化还原Fe(III)的影响
在其他条件都相同,As(III)的初始浓度为0,1,2,3,4mg/L时,厌氧培养 48h后,As(III)浓度对S. oneidensis MR-1生长及其异化还原铁的影响如图3所示.
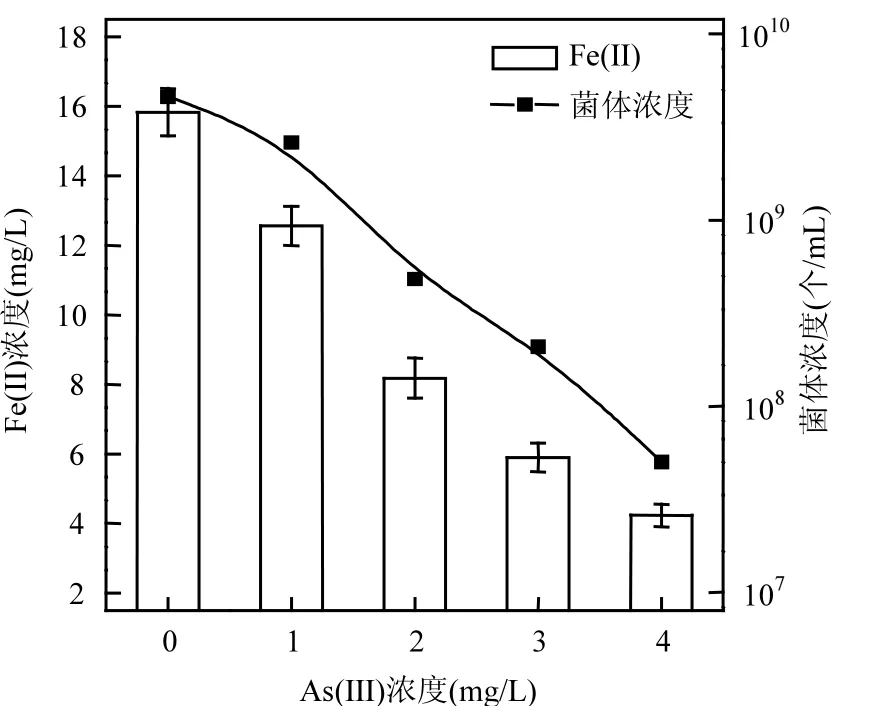
图3 As(III)浓度对S. oneidensis MR-1菌体生长及其异化还原Fe(III)的影响Fig.3 Effect of As(III) concentration on the growth of S. oneidensis MR-1and dissimilatory iron reduction
由图3可见,在30℃、pH 7.0的条件下,未添加As(III)时,S. oneidensis MR-1生长较快且具有较高的活性,连续培养2d后,菌体浓度每mL高达4.61×109个.添加1mg/L As(III)后对S. oneidensis MR-1的生长有一定程度的抑制作用,其菌体浓度每mL降至约2.12×109个.随着As(III)浓度的增大,砷对菌株的毒性越强,当 As(III)浓度为4mg/L时,菌体浓度每mL仅为5.01×107个,说明As(III)浓度越高,对S. oneidensis MR-1生长的抑制越强.
从图 3可以看到,在未加入 As(III)时,S. oneidensis MR-1异化还原生成的 Fe(II)浓度为15.83mg/L,即 S.oneidensis MR-1的铁还原率为15.83%.随着砷浓度的升高,Fe(II)生成量在不断地下降,当As(III)浓度为4mg/L时Fe(II)的浓度仅为4.23mg/L.由此可知,As(III)浓度对铁还原菌的生长有一定程度的抑制作用,砷可以通过抑制菌的生长与活性来制约Fe(III)的还原[13].
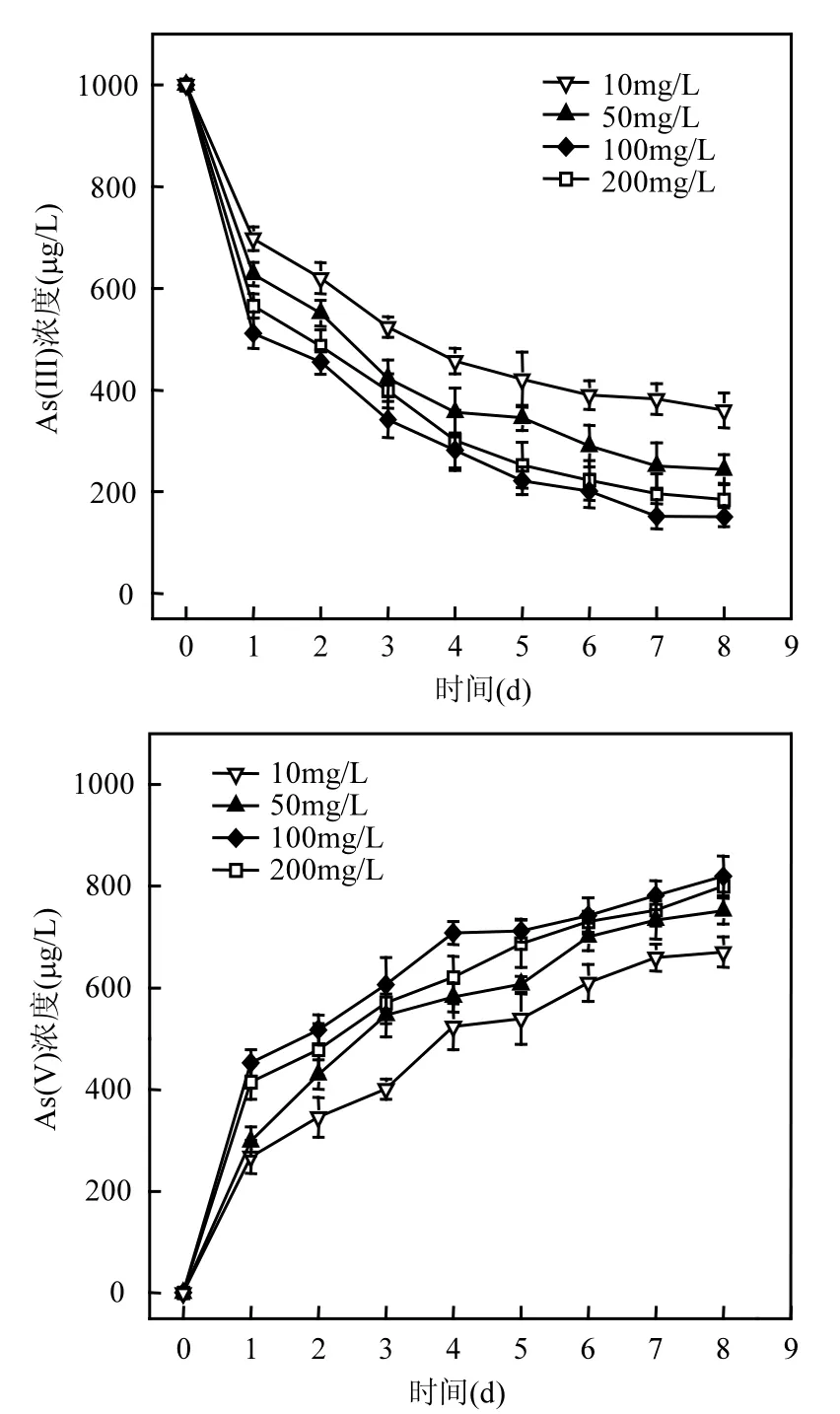
图4 S. oneidensis MR-1作用下Fe(OH)3浓度对As(III)氧化转化的影响Fig.4 Effect of Fe(OH)3concentration on As (III) oxidation in the presence of S.oneidensis MR-1
2.3 异化 Fe(III)还原介导 As(III)氧化转化的影响因素
2.3.1 Fe(OH)3浓度对 As(III)氧化转化的影响 当其他条件都相同时,Fe(OH)3初始浓度分
3 讨论
别为10,50,100,200mg/L时,在S.oneidensis MR-1作用下,对As(III)氧化转化的影响如图4所示.在30℃、pH 7.0的条件下,四种体系中,均有大量的As(V)生成,其浓度分别为 670.4,751.0,818.9, 799.7µg/L.在第 1d,As(III)氧化速率最高,其氧化率均达到50%左右,随后氧化速率开始下降,到第8d达到平衡.说明S.oneidensis MR-1作用下,不同Fe(OH)3浓度对As(III)的氧化转化有一定的影响.随着 Fe(OH)3浓度的增大,As(III)的氧化速率越大,其氧化率越高,但是,当浓度大于 100mg/L时,As(III)氧化率反而减小.由此可知,Fe(OH)3浓度的增大能够促进 As(III)的氧化,但当其浓度超出一定值时,反而会抑制As(III)的氧化转化.这可能与铁还原过程导致氧化还原电位的变化相关[14-15],过高的 Fe(III)浓度使得溶液中产生过多的 Fe(II),影响了反应体系中的氧化还原电位,从而对As(III)氧化转化产生了抑制作用.
2.3.2 pH 对As(III)氧化转化的影响 初始pH值分别为 5.0,6.0,8.0,9.0时,Fe(OH)3浓度为100mg/L时,在 S.oneidensis MR-1作用下,对As(III)氧化的影响如图5所示.实验结果表明,当pH 值为 8.0时,溶液中 As(V)浓度最大,为848.0μg/L, pH值为5.0时最小,仅为592.7μg/L,其次为pH值为9.0和pH值为6.0.说明pH值对As(III)氧化转化具有明显影响,当pH值在弱酸性至弱碱性范围内,As(III)氧化量呈逐渐上升趋势,并在pH值为8.0时达到最大氧化量,当pH值为9.0时,As(III)氧化量略有下降.随着pH值的变化, As(III)在铁氧化物表面的吸附量发生变化,因此导致氧化量也随之变化.
综上所述,在本实验条件下,当Fe(OH)3添加浓度100mg/L、pH为8.0时,As(III)氧化转化效率最高,即最有利于As(III)的氧化转化.
促使 Fe(III)还原的主要动力是微生物的作用,同时,重金属离子也可能成为制约 Fe(III)还原的重要因素,重金属对异化 Fe(III)还原的抑制取决于微生物的活性和重金属离子的种类及浓度[16].As(III)抑制异化 Fe(III)还原还可能是由于其对S. oneidensis MR-1的毒害作用抑制了糖代谢,使S. oneidensis MR-1得不到足够的电子供体,从而影响降低了铁还原率.另外,由于As(III)的氧化转化使得溶液中有 As(V)存在,实验证明[17],添加不同浓度 As(V)后 Fe(III)还原过程有明显的“滞后”,且随着As(V)浓度的增加,这种“滞后”作用就越明显.
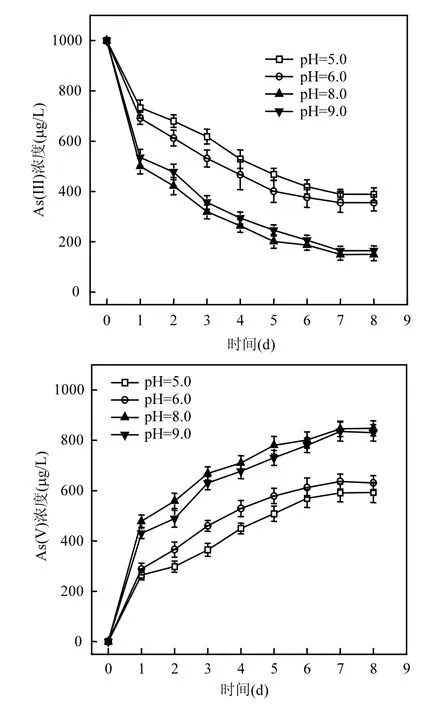
图5 S. oneidensis MR-1作用下pH值对As(III)氧化转化的影响Fig.5 Effect of pH on As (III) oxidation in the presence of S. oneidensis MR-1
在本次试验中,未添加S. oneidensis MR-1对照组的As(III)氧化率均远远小于添加菌后的氧化率,说明添加S. oneidensis MR-1后能够明显促进As(III)氧化转化,且铁还原速率与As(III)氧化在时间分布上呈现出相同趋势.As(III) 被O2氧化是一个非常缓慢的过程[18],即便有大量的O2存在也无法解释实验中 As(III)被迅速氧化的原因.并且,本实验是在厌氧条件下进行的,排除了 Fenton反应和由于 Fe(II)和 O2氧化 As(III)的可能性[19-20]. Amstaetter等[21]研究表明,在Fe(OH)3和Fe(II)同时存在的条件下,As(III)可以被氧化为As(V),相对于其他Fe(III)氧化物,Fe(OH)3和Fe(II)同时存在、相互作用下能够表现出最高氧化还原活性.在本实验过程中可能是由于S. oneidensis MR-1异化还原Fe(III)形成的Fe(OH)3-Fe(II)复合物引起电子由 Fe(II)到 Fe(OH)3的传递,从而形成了一种Fe(OH)3-Fe(III) 活性中间复合物,形成的 Fe(III)具有潜在的强氧化能力,可以作为一种强氧化剂使As(III) 发生氧化[22].然而,As(III)不可能被彻底氧化为 As(V),随着培养时间的变化,As(III)和As(V)总是共同存在的,其含量存在着动态平衡关系[15].As(III)在铁氧化物表面的氧化作用是伴随着吸附作用而进行的.As(III)通常以 H3AsO3的分子形态存在于水溶液中,而在弱碱性环境中,H3AsO3分子更容易解离形成亚砷酸根离子[23],在铁氧化物表面的吸附效果要优于酸性和强碱性条件下的吸附效果,进而有利于 As(III)的氧化转化.As(III)和 As(V)的存在形式主要取决于氧化还原电位的高低和pH值的大小.一些研究发现在厌氧的自然环境中存在着As(V).由于环境中铁还原微生物广泛存在,尤其是在厌氧的自然条件下分布广泛,只要铁(氢)氧化物和 Fe(II)同时存在的条件下,As(III)就可以发生氧化,这可能就是缺氧的地下水中 As(V)存在的原因.有研究表明,As(V)在某些湖泊的缺氧均温层中占主导[24].此外,铁还原产生的 Fe(II)能与铁氧化物作用生成铁的多价态次生矿物,这些多价态次生矿物对砷有强烈的吸附作用,且氧化生成的As(V)更容易被Fe(OH)3及其他矿物吸附共沉淀,从而可以有效地抑制砷的迁移,降低砷污染.
越来越多的研究表明,在自然水体和土壤中,微生物参与As(V)和As(III)之间氧化还原转化过程中起着关键作用,而且微生物催化作用远大于非微生物[25],因此,进一步深入研究有望在土壤中微生物铁还原和砷的氧化还原方面展开.
4 结论
4.1 厌氧培养过程中,Fe(III)被还原为 Fe(II)的同时伴随着 As(III)氧化为 As(V),并且这两个过程在时间上有高度的一致性.
4.2 As(III)浓度对S. oneidensis MR-1菌株生长有一定的抑制作用,随着 As(III)浓度的增大,菌株生长量明显减少.添加 As(III)后降低了 S. oneidensis MR-1铁还原率,As(III)可以通过制约菌的生长与活性来抑制Fe(III)异化还原.
4.3 适量的Fe(III)含量对As(III)氧化转化有很强的促进作用,但是过高的 Fe(III)浓度使得溶液中产生过多的 Fe(II),从而对 As(III)氧化转化有一定程度的抑制作用.当 Fe(III)浓度为 100mg/L时,As(III)氧化转化率最高,达81.89%.
4.4 相对于酸性或者强碱性,弱碱性环境更有利于As(III)氧化转化,其中pH值为8.0时,As(III)氧化转化率最高,达84.80%.
[1]卢 聪,李青青,罗启仕,等.场地土壤中有效态砷的稳定化处理及机理研究 [J]. 中国环境科学, 2013,33(2):298-304.
[2]肖唐付,洪 冰,杨中华,等.砷的水地球化学及其环境效应 [J].地质科技情报, 2001,20(1):71-76.
[3]吴萍萍,曾希柏.人工合成铁、铝矿对As(V)吸附的研究 [J]. 中国环境科学, 2011,31(4):603-610.
[4]王永杰.长江河口潮滩沉积物中砷的迁移转化机制研究 [D].上海:华东师范大学, 2013.
[5]Dittmar J, Voegelin A, Maurer F, et al. Arsenic in soil and irrigation water affects arsenic uptake by rice:complementary insights from field and pot studies. [J]. Environ. Sci. Technol., 2010,44(23):8842-8848.
[6]Meharg A A, Williams P N, Adomako E, et al. Geographical variation in total and inorganic arsenic content of polished (white) rice. [J]. Environ. Sci. Technol., 2009,43(5):1612-1617.
[7]Kato C, Nogi Y. Correlation between phylogenetic structure and function:examples from deep-sea Shewanella [J]. FEMS Microbiology Ecology, 2001,35(3):223-230.
[8]Wang X J, Yang J, Chen X P, et al. Phylogenetic diversity of dissimilatory ferric iron reducers in paddy soil of Hunan, South China [J]. Journal of Soils and Sediments, 2009,9(6):568-577.
[9]王伟民,曲 东,徐 佳.水稻土中铁还原菌的分离纯化及铁还原能力分析 [J]. 西北农林科技大学学报, 2008,36(10):103-109.
[10]Silva J, Mello J W V, Gasparon M, et al. Arsenate adsorption onto aluminium and iron (hydr) oxides as an alternative forwater treatment [C]. Imwa, Symposium, 2007.
[11]张雪霞,贾永锋,潘蓉蓉,等.微生物作用引起的铁铝氢氧化物吸附砷的还原与释放机制研究 [J]. 环境科学, 2009,30(3):755-760.
[12]袁爱萍,唐艳霞,黄玉龙,等.氢化物-原子荧光法测定锑精矿中痕量砷、汞的研究 [J]. 光谱学与光谱分析,2006,26(8):1553-1556.
[13]陈 洁,储 茵,司友斌.奥奈达希瓦氏菌MR-1的Fe(III)还原特性及其影响因素 [J]. 安徽农业大学学报, 2011,38(4):554-558.
[14]Jones C A, Langner H W, Anderson K, et al. Rates of Microbially Mediated Arsenate Reduction and Solubilization [J]. Soil Science Society of America Journal, 2004,64(2):600-608.
[15]Takahashi Y, Minamikawa R, Hattori K H, et al. Arsenic behavior in paddy fields during the cycle of flooded and non-flooded periods. [J]. Environ. Sci. Technol., 2004,38(4):1038-1044.
[16]Balashova V V, Zavarzin G A. Anaerobic reduction of ferric iron by hydrogen bacteria [J]. Microbiology, 1980,48(5):635-639.
[17]李荣华.厌氧条件下水稻土中铁还原对砷形态的影响 [D]. 杨凌:西北农林科技大学, 2005.
[18]Oscarson D W, Huang P M, Liaw, W K. The oxidation of arsenite by aquatic sediments [J]. Environ. Qual., 1980,9(4):700-703.
[19]Katsoyiannis I A, Ruettimann T, Hug S J. pH dependence of Fenton reagent generation and As (III) oxidation and removal by corrosion of zero valent iron in aerated water [J]. Environ. Sci. Technol., 2008,42(19):7424-7430.
[20]Hug S J, Leupin O. Iron-catalyzed oxidation of arsenic (III) by oxygen and by hydrogen peroxide: pH-dependent formation of oxidants in the Fenton reaction [J]. Environ. Sci. Technol., 2003,37(12):2734-2742.
[21]Amstaetter K, Borch T, Larese-casanova P, et al. Redox transformation of arsenic by Fe (II)-activated goethite (a-FeOOH) [J]. Environ. Sci. Technol., 2010,44(1):102-108.
[22]Hiemstra T, van Riemsdijk W H. Adsorption and surface oxidation of Fe (II) on metal (hydr) oxides [J]. Geochimica et Cosmochimica Acta, 2007,71(24):5913-5933.
[23]Smedley P L, Kinniburgh D G. A review of the source, behaviour and distribution of arsenic in natural waters [J]. Applied Geochemistry, 2002,17(5):517-568.
[24]Abdullah M I, Shiyu Z, Mosgren K. Arsenic and selenium species in the oxic and anoxic waters of the Oslofjord, Norway [J]. Marine Pollution Bulliten, 1995,31(1):16-126.
[25]Oremland Ronald S, Stolz John F. The ecology of arsenic [J]. Science, 2003,300(5621):939-944.
As(III) oxidization coupled to Fe(III) reduction by Shewanella oneidensis MR-1.
WANG Ming-xia, WANG Juan, SI
The kinetics of Fe (III) reduction and As (III) oxidation by Shewanella oneidensis MR-1 and influenced factors were studied under laboratory conditions. Results showed that the oxidization of As (III) to As (V) occurred in accompanying with Fe (III) reduction, S. oneidensis MR-1 could grow well at low concentration of As (III), but its growth was suppressed at high concentration of As (III). As (III) inhibited dissimilatory iron reduction by affecting the growth and activity of S. oneidensis MR-1. Moreover, moderate Fe (III) could strongly promote As (III) oxidization, while high Fe (III) concentration might inhibit As (III) oxidization because of excess Fe (II). In addition, weak alkaline environment was more conducive to As (III) oxidization.
dissimilatory iron reduction;Fe(OH)3;As(III,V);redox
X172
A
1000-6923(2014)09-2368-06You-bin*(School of Resources and Environment, Anhui Agricultural University, Hefei 230036, China). China Environmental Science, 2014,34(9):2368~2373
汪明霞(1989-),女,安徽安庆人,安徽农业大学资源与环境学院硕士研究生,主要研究方向为环境污染防治.
2014-01-13
国家自然科学基金项目(41171254);公益性行业(农业)科研专项经费课题(201303101-06)
* 责任作者, 教授, youbinsi@ahau.edu.cn
