基于真实细胞模型的低能α粒子辐照模拟研究
2014-08-06袁永刚
高 晖,袁永刚,穆 龙
(中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900)
如何实现个性化剂量评估,特别是实现低剂量辐射准确定量及定量预测辐射可能导致的健康效应,是一非常重要的研究课题[1-2]。吸收相同剂量引起的生物学效应因电离辐射能量沉积的微观分布不同而有别,即辐射生物学效应很大程度上是由某个物理点所沉积能量的实际大小所决定,而非平均值,如何准确计算出辐射粒子在微观尺度内的能量沉积及能量沉积分布是研究的重点和难点。目前很难从实验上得到微观尺度内的能量沉积分布情况,因此,模拟计算显得尤为重要。
细胞核内的DNA损伤是辐射引起的各种生物学效应最基本和最重要的原初损伤,基于DNA模型的微剂量学模拟研究已广泛开展,但由于DNA实验截面数据极度缺乏,在DNA纳米尺度的剂量模拟研究方面存在很多不确定性参数,至今组分采用液态水[3-5],而这与DNA真实组分[6]存在显著差距。细胞作为功能单元,对辐射敏感程度各不相同,且细胞,尤其细胞核环境对于DNA分子的损伤有直接的影响[7],因此,有必要从多层次、多角度上研究辐射作用的机制和效应。目前微剂量学领域研究中,采用的单细胞模型多是将细胞视为球体、圆柱体或椭球体,这与真实细胞具体形态结构、分化程度等有较大差别。Miller等[8]用正离子径迹结构(PITS)研究了25~90 keV电子微束照射Hela细胞,所得结果表明,细胞形态和体积对于剂量响应曲线有重要影响,且不同种类细胞的辐射敏感性也不相同,因此,基于真实细胞模型,针对结构、形态特异性开展微剂量学理论研究十分必要。
低能(0.1 MeV)α粒子在水中的射程仅为1.26 μm,属于细胞尺度量级。由于源分布的不同、靶细胞作用区域的变化等会造成低能α粒子在细胞中产生完全不同的局部能量沉积分布,从而对特定分布的DNA带来不同影响。因此,在描述具有特异性结构的细胞、亚细胞等微观尺度生物靶剂量时,本文以α粒子能量、生物学分布、源抽样位置、源-靶组合空间结构作为变量,多方位、多角度研究低能α粒子处于特定源靶组合情况下的微剂量学特征变化,以期为准确建立辐射剂量与生物学效应间的量效关系提供更接近放射生物学的数据参量,对微剂量学的实践应用具有重要意义。
1 计算方法与模型
1.1 Monte Carlo模拟
Geant4是一开源的蒙特卡罗软件,其模拟的电子能量范围已扩展至0.025 eV~1 MeV,由于能量截断阈值极大降低,使μm尺度结构的计算成为可能[9-10]。本文采用此软件对低能α粒子辐照特定细胞结构的相关微剂量特征进行计算,并基于ROOT编写子程序对Geant4输出数据进行处理。
1.2 细胞模型
本文所选用的细胞体元模型构建自人体上皮细胞的共焦显微镜照片(图1),其结构、组分、密度(表1)等数据已由法国格拉迪尼昂核子研究中心通过卢瑟福背散射谱 (RBS)、粒子诱导X射线发射分析 (PIXE)、扫描透射离子显微术 (STIM)等测试手段获得[11-12]。基于目前低能粒子在生物体中的实验截面数据缺乏,采用液态水作为细胞介质,其密度以表1所列为准。在结构构建上以359 nm×359 nm×163 nm的栅格作为细胞体元模型基本构成单位,具有对应的密度、坐标、所属介质等属性,共建53 480个栅格, 图2为构建的细胞体元模型。
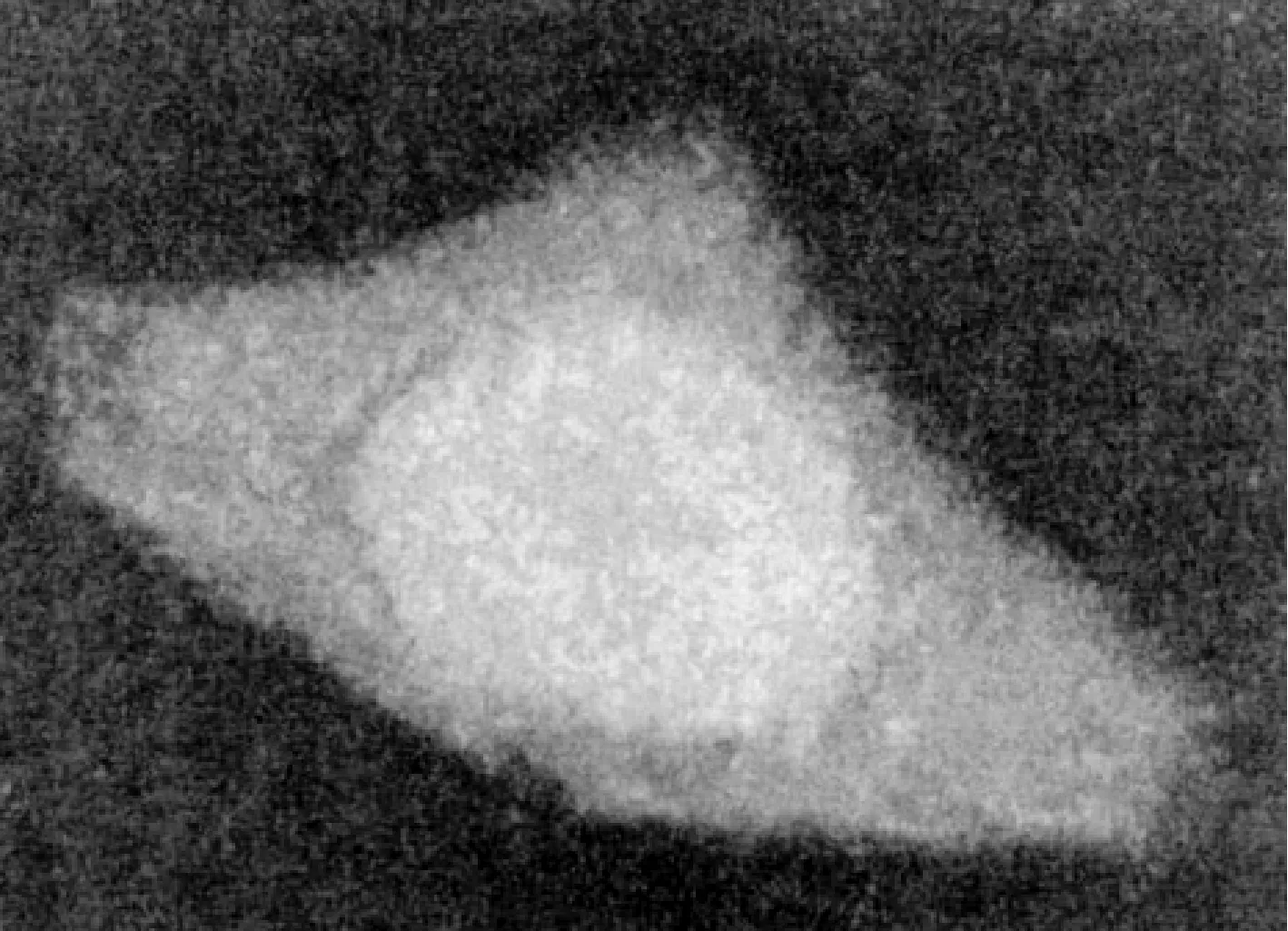
图1 人体上皮细胞共焦显微镜照片
表1人体上皮细胞的结构构成
Table1StructureofHaCaTcell
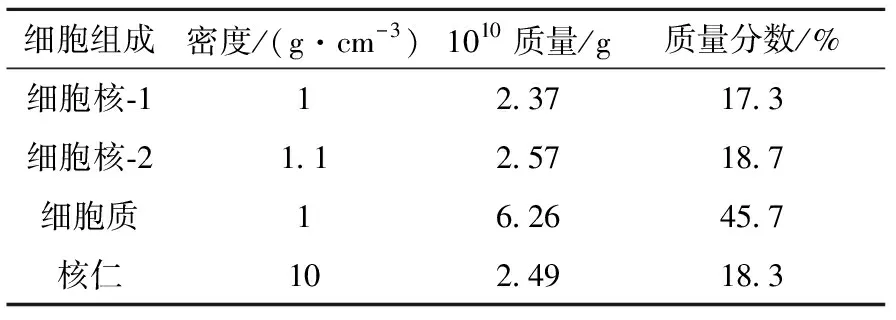
细胞组成密度/(g·cm-3)1010质量/g质量分数/%细胞核-112.3717.3细胞核-21.12.5718.7细胞质16.2645.7核仁102.4918.3

图2 人体上皮细胞体元模型
1.3 计算方案
本工作采用Geant4 9.5版本,物理过程定义为Geant4-DNA,能量截断阈值为1 eV;α粒子源分别定义为细胞核(N)、细胞质(C)、细胞表面(S)、细胞外(O)4种源分布方式,7种能量(3、1、0.5、0.1、0.05、0.01、0.001 MeV)各向同性α点源;靶区分为细胞核、细胞质。因此,有8种源靶组合方式,分别为CN→CN、CC→CN、CS→CN、CO→CN、CN→CC、CC→CC、CS→CC、CO→CC。根据靶击中理论,细胞核内的DNA作为辐射敏感结构,细胞核为总灵敏体积,以保证入射α粒子可到达细胞核为原则设定源抽样位置,即对于不同能量α粒子,抽样位置距细胞核中心(坐标定为(0 μm,0 μm,0 μm))的长度要小于α粒子在水中的射程,射程通过SRIM-2008程序获得(表2)。根据α粒子能量、射程、源分布的不同,完成源抽样位置的设定(表3)。
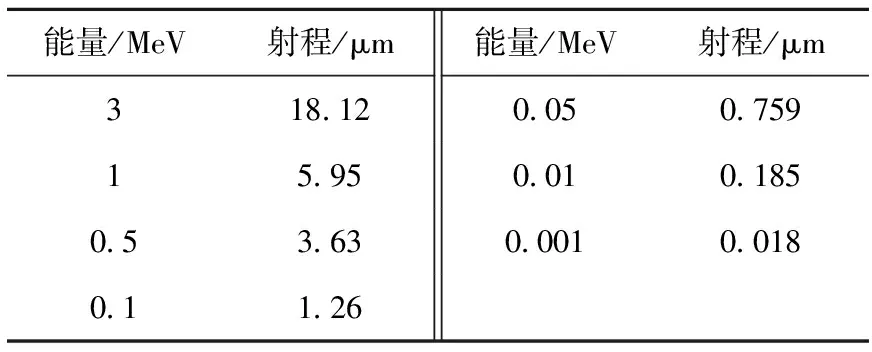
表2 α粒子在水中的射程

表3 α源抽样位置
2 亚细胞水平α粒子辐射表征
2.1 α粒子作用于人体上皮细胞的径迹结构
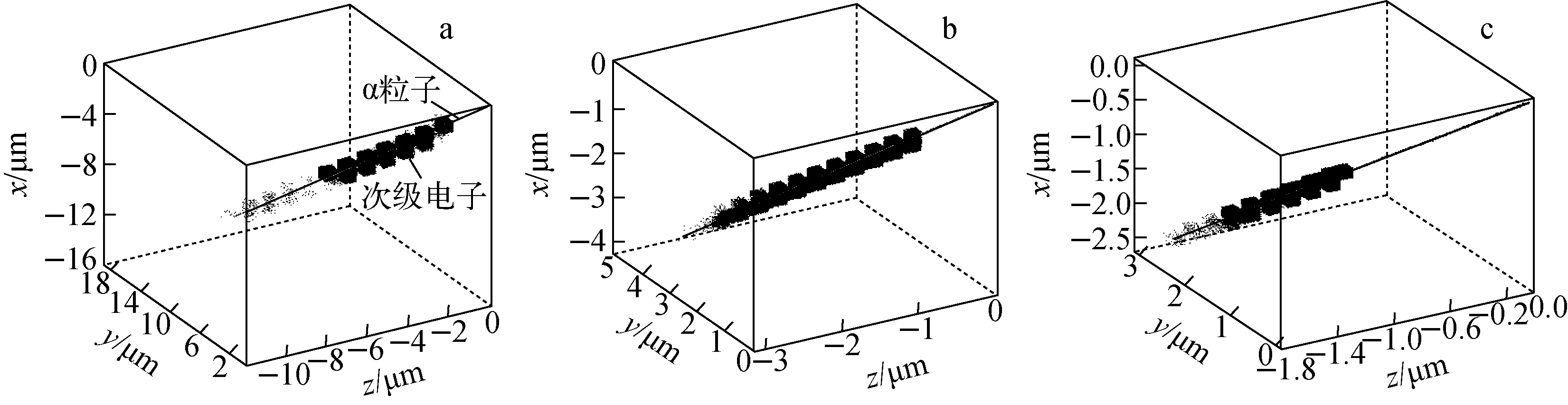
1) α粒子作用于人体上皮细胞的单次事件径迹
图3为单次事件中能量以3、1、0.5 MeV为代表的α粒子及其产生的次级电子的三维径迹。由图3可看出,不同能量α粒子的径迹基本是一直线,而不同子代的次级电子以α粒子径迹为轴,围绕其径迹形成不同大小的类似圆柱状几何分布。由于诱发次级电子的α粒子能量不同,在细胞介质中产生的次级电子能量分布也不同,这些次级电子在细胞介质中的射程有很大区别,因此,次级电子沿α粒子径迹方向的空间分布有所不同。
2) 次级电子作用点沿α粒子径迹的径向空间分布
图4为两种能量区段的α粒子作用于细胞介质时产生的次级电子沿α粒子的径向分布情况。从得到的结果(表4)可看出,次级电子在距α粒子径迹小于20 nm的径向范围内的分布份额,随α粒子能量的降低而很快增大。对于能量大于0.5 MeV的α粒子,由于能量较高,距α粒子径迹越近,发生作用事件概率越大,次级电子作用点分布在距α粒子径迹20 nm以内的概率虽不大,但由于产生的次级电子数额大,仍具有一定的统计性;而对于能量小于0.1 MeV的α粒子,产生的次级电子径迹作用点的高度密集化造成电子径迹的交叠,使次级电子在距离α粒子径迹一定范围内具有较好的统计性,在考察细胞介质内α粒子径迹周围吸收剂量时,可认为剂量的分散性较小。
α初始能量,MeV:a——3;b——1;c——0.5
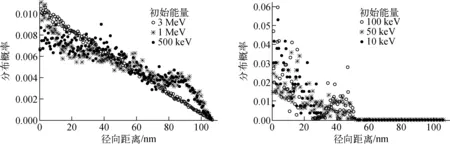
图4 次级电子作用点沿α粒子径向分布
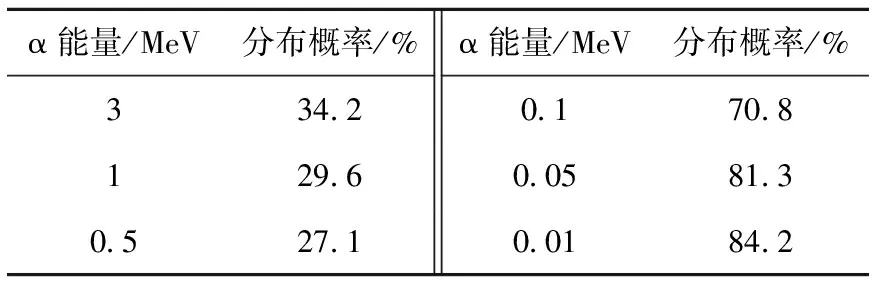
表4 次级电子作用点分布在距α粒子径迹20 nm内的概率
3) α粒子及次级电子末端径迹点的空间分布
由于人体上皮细胞尺寸结构的不规则性,α点源处于不同抽样位置时,α粒子及产生的次级电子在靶细胞内的末端径迹点的空间分布不同;因α粒子及次级粒子的能量就沉积在其径迹上,导致能量沉积微观分布及沉积范围的不同。图5为1 MeV α粒子位于细胞核、细胞外时,α粒子及次级电子末端径迹点三维分布。由图5可看出,α粒子随源抽样位置变化时,靶作用区域随着改变,α粒子及次级电子末端径迹点空间分布也相应改变,最终导致不同的能量沉积分布。因此,由于粒子能量、生物学分布、源-靶组合空间结构的变化,造成低能α粒子在靶细胞中产生不同的局部能量沉积,所以在描述细胞、亚细胞等微观尺度生物靶的剂量和辐射效应时,需以α粒子初始能量、辐射粒子生物学分布、源-靶组合空间结构作为变量,研究特定源-靶组合情况下的微剂量学特征。
2.2 次级电子能谱分布
图6示出能量分别为1、0.5、0.1、0.05 MeV的各向同性α点源从细胞核发出的沉积于靶区——细胞核、细胞质的次级电子数份额按其能量分布的计算结果。可看出,初始能量大于0.5 MeV的α粒子在细胞介质中发生能量转移时,次级电子在细胞核和细胞质中的能量沉积谱的形状基本相同,表现为次级电子在细胞核中沉积能量高于在细胞质中的沉积能量,且高能量的次级电子占主导地位,而在细胞质中低能量的次级电子占主导地位,这是因为,根据靶击中理论,源出射位置在细胞核时,α粒子到达细胞质前已在细胞核中损失大部分能量,传递给细胞质的能量有限;同时受到人体上皮细胞非均匀介质分布及形状的不规则影响,细胞核径向长度与α粒子在水介质中射程之比存在一分布,α粒子穿越细胞核的概率亦存在一分布,相应地,在细胞介质中次级电子沉积的能量存在一定分布。当α点源初始能量小于0.1 MeV时,随着α点源能量的减小,其射程大于细胞核某一径向长度的概率减小,即穿越细胞核的概率减小,在细胞核内,次级电子末端径迹点落在其内的比例大增,直至完全落入细胞核内,此时单次事件中能量完全沉积概率占主导,而在细胞质中,次级电子沉积能量的概率大幅下降直至为0。
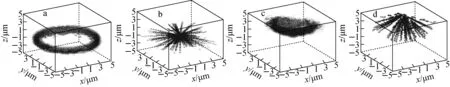
a——细胞核,α粒子末端径迹点;b——细胞核,次级电子末端径迹点;c——细胞外,α粒子末端径迹点;d——细胞外,次级电子末端径迹点
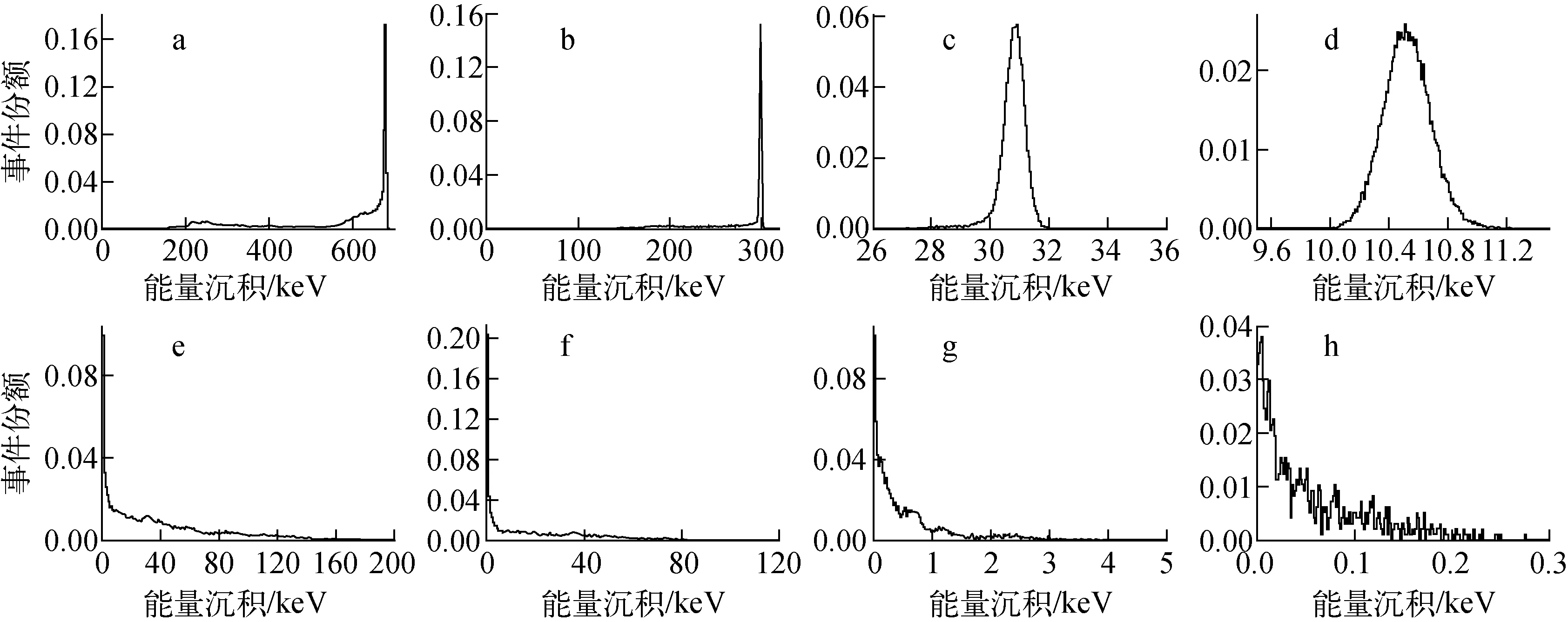
初始能量,MeV:a,e——1;b,f——0.5;c,g——0.1;d,h——0.05靶区:a,b,c,d——细胞核;e,f,g,h——细胞质
以α粒子生物学分布为变量,分别考察初始能量1 MeV α点源在8种源靶组合方式下的次级电子能谱,结果示于图7。从图7a可看出,在细胞核中,CN→CN、CC→CN、CS→CN、CO→CN4种情形均表现为,当沉积能量处于最大峰值Fmax时,其对应的次级电子数所占份额也最大,且Fmax(CN→CN)>Fmax(CC→CN)>Fmax(CS→CN)>Fmax(CO→CN);同时,随着源区距靶区距离的增加,细胞核内次级电子的最大沉积能量不断减小,能量分布范围也减小,这主要是与靶区的击中概率有关,源区与靶区距离越近,则源区发射的α粒子更易击中靶区,从而在其中产生能量沉积。从图7b可看出,当位于细胞表面的α点源作用于细胞质CS→CC时,由细胞质Z轴方向尺寸RZ-max=4.35 μm可知,进入细胞质内的α粒子的径迹初始段难以有次级电子沉积能量,表现为低能端的次级电子占明显高的份额,而距细胞质较远的位于细胞外的α点源在其作用到细胞质CO→CC时,α粒子的径迹初始段(次级电子产额少,见图3)已基本落在细胞外,在细胞质有限径迹长度内次级电子产额增加,因此在细胞质中低能端的次级电子所占份额明显小于CS→CC的;尽管在CS→CC情形下,随着α粒子进一步作用于细胞质,次级电子产额有所增加,但相对于CO→CC来说较少,更多的是在细胞核内沉积,相反,CO→CC由于次级电子多沉积在细胞质中,在细胞核沉积能量减少,表现为CO→CC在细胞质内“突起能量段”份额大于CS→CC的。另外,当位于细胞质的α点源作用于同一区域细胞质CC→CC时,次级电子能谱呈现“缓坡”分布,这反映了相对于较为规则的细胞核,细胞质不规则形状对次级电子能谱分布的影响。
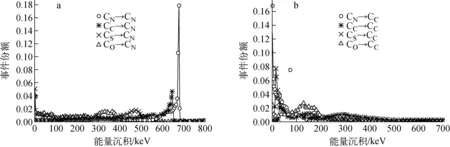
靶区:a——细胞核;b——细胞质
2.3 α粒子作用于人体上皮细胞能量沉积的空间分布
决定生物学效应的重要因素是微观空间中沉积能量的大小及分布,而不同生物学分布、不同能量α点源产生的次级电子能谱的确定则为其提供了信息,图8为人体上皮细胞在4种生物学分布下的3 MeV α粒子作用后的能量沉积的空间分布,表5列出了沉积在细胞核内的能量。
2.4 α粒子作用于亚细胞水平单次事件比能分布
比能z为:
z=ε/m
(1)
式中:ε为电离辐射授予某一体积内的授予能;m为该体积元内物质的质量。
授予能作为一随机量,随机波动性较大,故比能也是一随机量。当细胞、亚细胞受到辐射时,将产生若干能量沉积事件,其特性可用发生的单个事件按z的随机分布来描述,即单次能量沉积事件的比能分布函数f(z)来描述。图9为能量分别为1、0.5、0.1、0.001 MeV的各向同性α点源从细胞核发出到细胞核CN→CN的单次事件比能分布,可看出,0.1 MeV以下的α粒子沿其径迹产生较高能量的次级电子的概率大幅下降,α粒子在细胞核内的能量沉积不均匀,绝大部分体元内无能量沉积,而一旦沉积,能量几乎全部沉积在个别体元中,单次事件比能仅分布于几点。由不同生物学分布下1 MeV α点源在细胞核、细胞质单次事件比能份额的分布统计情况(图10)可看出,在细胞质,低比能区间所占份额最大,且4种情形下的单次事件比能份额变化基本一致;而在细胞核,4种生物学分布下单次事件比能份额达最大时所在的能量区间不同,CN→CN、CC→CN、CS→CN、CO→CN对应的能量区间分别为0.3~0.35、0.25~0.3、0.2~0.25、0.15~0.2 Gy,CS→CN、CO→CN两种曲线变化明显,呈现波动分布。由式(1)可知,比能取决于授予能和关注区域质量,随着源-靶距离的增加,源区α粒子对细胞核所张的立体角减小的同时,靶作用区域发生变化,由靶区域的变化带来源粒子能量沉积的影响小于其对靶区域质量的影响,从而出现CS→CN、CO→CN曲线呈现波动的情形。
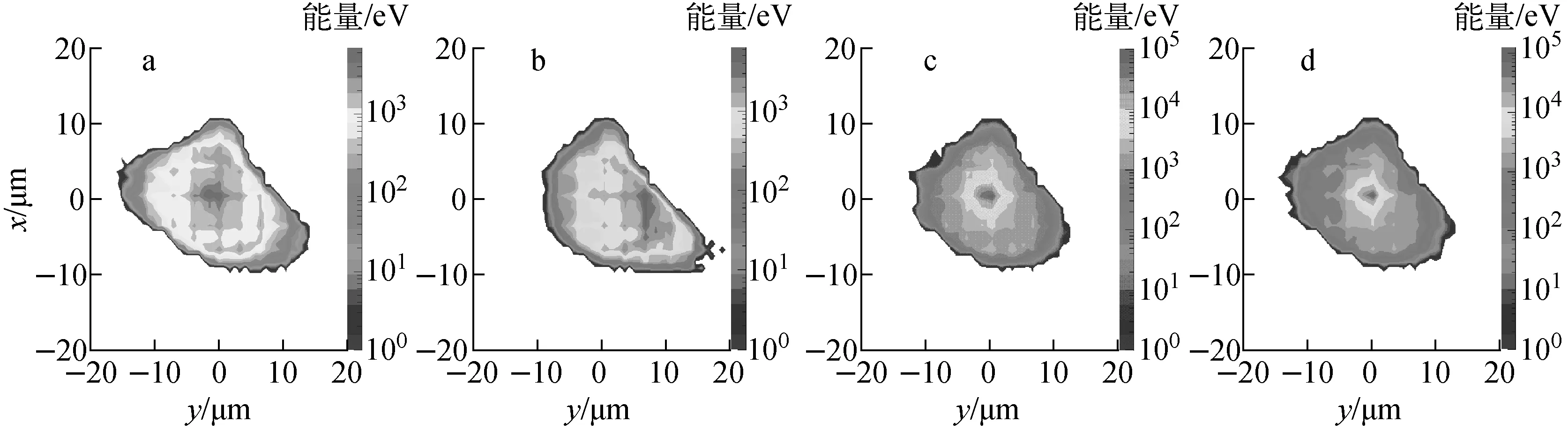
a——细胞核;b——细胞质;c——细胞表面;d——细胞外
表5不同能量、不同生物学分布α源在靶区细胞核的能量沉积
Table5Energydepositioninnucleusfromαpointsourceindifferentenergyandbiologicdistributions
α能量/MeV源抽样位置/μm源分布沉积能量/eVCN→CNCC→CNCS→CNCO→CN3(0,0,0)细胞核239 717(7.181 2,0,0)细胞质205 725(0,0,4.72)细胞表面196 450(0,0,7)细胞外158 6301(0,0,0)细胞核93 761.3(0,5.744 96,0)细胞质89 941.9(0,0,4.72)细胞表面54 592.3(0,0,5.5)细胞外48 852.10.5(0,0,0)细胞核20 257.5(-1.436,0.718,1.954)细胞质23 3770.1(0,0,0)细胞核1 7980.05(0,0,0)细胞核262.50.01(0,0,0)细胞核12.60.001(0,0,0)细胞核0.04
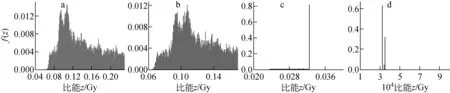
初始能量,MeV:a——1;b——0.5;c——0.1;d——0.001
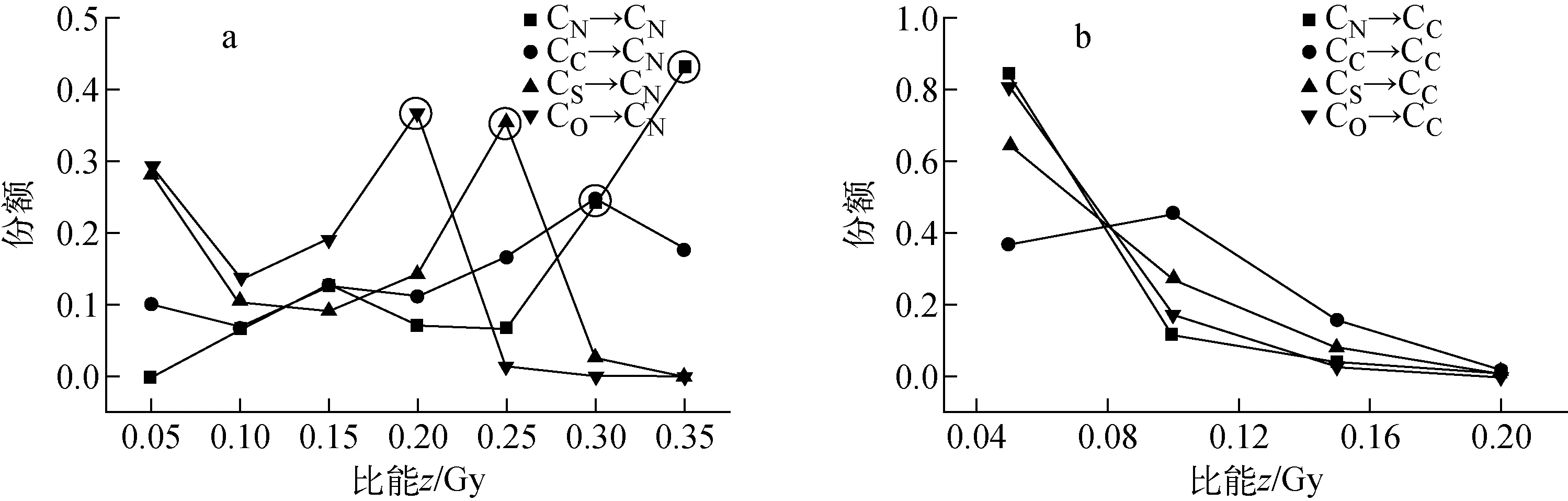
2.5 α粒子作用于亚细胞的S值
S值定义为每次衰变粒子对靶区域的剂量贡献,则:
(2)
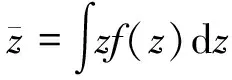
(3)
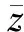
靶区:a——细胞核;b——细胞质
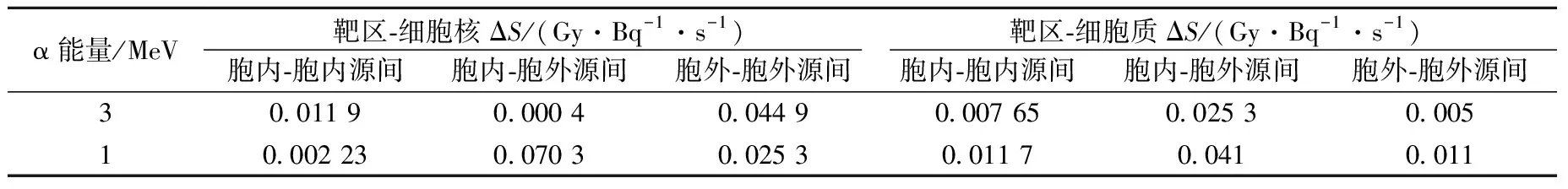
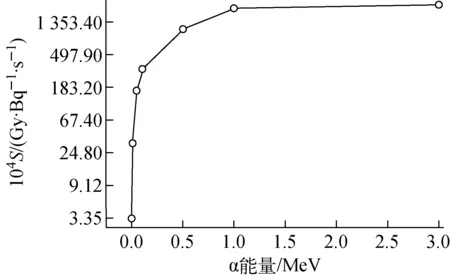
由式(2)、(3)通过单次事件比能分布可获得不同能量、不同生物学分布下α粒子作用于人体上皮细胞的亚细胞S值,结果列于表6。由表6可看出,细胞核S值的大小依次为S(CN→CN)>S(CC→CN)>S(CS→CN)>S(CO→CN);细胞质S值则在CC→CC源靶组合时最大;比较细胞核、细胞质的S值的大小,则表现为S(CS→CN)>S(CO→CN),S(CS→CC) 表6 α点源人体上皮细胞亚细胞S值 表7 内、外α点源人体上皮细胞ΔS值 图11 不同能量α点源细胞核S值 本文模拟结果表明,对于射程在一个细胞范围内的低能α粒子,当α粒子注入细胞时,围绕α粒子径迹产生的次级电子随着α粒子能量的降低,集中分布概率的份额增大,剂量分散性减小,低能α粒子单事件微观效应明显;而由于人体上皮细胞尺寸结构的不规则性,α粒子能量沉积的微观空间分布随着α粒子能量、生物学分布、源-靶组合空间结构的变化有明显差异。根据微剂量学理论,获取了不同能量、不同生物学分布、特定源-靶组合下α粒子在靶区——细胞核、细胞质的微剂量特征值,并通过对α粒子在亚细胞水平上的微剂量学特征变化的比较分析,实现了对特定结构亚细胞水平微观剂量特征的定量描述。 参考文献: [1]HUANG L, KIM P M, NICKOLOFF J A, et al. Targeted and nontargeted effects of low-dose ionizing radiation on delayed genomic instability in human cells[J]. Cancer Research, 2007, 67(3): 1 099-1 104. [2]WRIGHT E G. Manifestations and mechanisms of non-targeted effects of ionizing radiation[J]. Mutation Research, 2010, 687(1-2): 28-33. [3]BERNAL M A, deALMEIDA C E, SAMPAIO C, et al. The invariance of the total direct DNA strand break yield[J]. Medical Physics, 2011, 38(7): 4 147-4 153. [4]FRIEDLAND W, JACOB P, BERNHARDT P, et al. Simulation of DNA damage after proton irradiation[J]. Radiation Research, 2003, 159(3): 401-410. [5]FRIEDLAND W, PARETZKE H G, BALLARINI F, et al. First steps towards systems radiation biology studies concerned with DNA and chromosome structure within living cells[J]. Radiation Environment Biophysics, 2008, 47(1): 49-61. [6]BERNHARDT P, FRIEDLAND W, JACOB P, et al. Modeling of ultrasoft X-ray induced DNA damage using structured higher order DNA targets[J]. International Journal of Mass Spectrometry, 2003, 12(223-224): 579-597. [7]LIU Z F, MOTHERSILL C E, MCNEILL F E, et al. A dose threshold for a medium transfer by stander effect for a human skin cell line[J]. Radiation Research, 2006, 166(1): 19-23. [8]MILLER J H, RESAT M S, METTING N F, et al. Monte Carlo simulation of single-cell irradiation by an electron microbeam[J]. Radiation Environment Biophysics, 2000, 39(2): 173-177. [9]BEATON L A, BURN T A, STOCKI T J, et al. Development and characterization of an in vitro alpha radiation exposure system[J]. Physics in Medicine and Biology, 2011, 56(12): 3 645-3 658. [10] INCERTI S, TRAN H N, MANTERO A, et al. Comparison of Geant4 very low energy cross-section models with experimental data in water[J]. Medical Physics, 2010, 37(9): 4 692-4 708. [11] INCERTI S, SEZNEC H, SIMON M, et al. Monte Carlo dosimetry for targeted irradiation of individual cells using a microbeam facility[J]. Radiation Protection Dosimetry, 2009, 133(1): 2-11. [12] DEVES G, ORTEGA R. Subcellular mass determination by He+energy-loss microspectrometry[J]. Analytical and Bioanalytical Chemistry, 2002, 374(7): 390-394.
3 结论
