稀苯扎溴铵溶液微生物限度检查方法的建立及方法学验证
2014-08-06张国庆杜建红成都军区联勤部药品仪器检验所四川成都610017
张国庆,杜建红,祝 辉,刘 徽,方 晨 (成都军区联勤部药品仪器检验所,四川 成都 610017)
稀苯扎溴铵溶液为2002年版《中国人民解放军医疗机构制剂规范》所收载的外用非灭菌溶液剂,具有消毒、防腐作用,用于皮肤消毒。由于2002年版《中国人民解放军医疗机构制剂规范》[2]未给出确切的微生物限度检查方法,而2005年版之前的《中国药典》对微生物限度检查法也未规定对检验方法的适用性进行验证,不能确保在该检验条件下的样品浓度是否足以抑制污染微生物的生长,使供试品中污染的微生物得以真实的反映,从而保证结果的科学性与准确性。因此,依据《中国药典》2010年版[1]二部的附录XI J《微生物限度检查法》中方法验证试验的要求,同时参照文献[3~6]对本品建立微生物限度检查方法并进行方法学验证,确保方法的有效性。
1 仪器与材料
1.1仪器 BSC-1000IIA2生物安全柜(苏州安泰空气技术有限公司); SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司); LDZH高压灭菌器(上海申安医疗器械厂); DNP-9272电热恒温培养箱(上海精宏实验设备有限公司); SHH 250 L生化培养箱(重庆四达试验仪器有限公司); DKB8A电热恒温水浴箱(上海精宏实验设备有限公司); HTY601集菌仪(杭州泰林生物技术设备有限公司); GDHD-4电热恒温鼓风干燥箱(厦门医疗电子仪器厂)。
1.2材料 稀苯扎溴铵溶液(批号:20130901, 20130902, 20130903,解放军452医院配制)。0.9%无菌氯化钠溶液原料药(成都市科龙化工试剂厂,批号:20120411),后自行配制。0.9%无菌氯化钠溶液(四川科伦药业,批号:M13082302)。pH7.0无菌氯化钠-蛋白胨缓冲液(北京三药科技开发公司,批号:1303112),后按标签说明进行配制。
1.3菌种 大肠杆菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]、铜绿假单胞菌[CMCC(B)10104]均来源于成都市食品药品生物制品检定所,均为第3代培养物。
1.4培养基 营养琼脂培养基( 111222);玫瑰红钠琼脂培养基(1303262);营养肉汤培养基(111207);改良马丁培养基( 111214);改良马丁琼脂培养基(121122);胆盐乳糖培养基(1203192);甘露醇氯化钠琼脂培养基(120419);溴化十六烷基三甲胺琼脂培养基(1109282);以上培养基均由北京三药科技开发公司生产,按标签说明进行配制。
2 方法
2.1菌液制备 按《中国药典》2010年版二部的附录微生物限度检查法进行制备。取经35 ℃培养24 h的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的营养肉汤培养基培养物,用0.9%无菌氯化钠溶液10倍稀释至约含50~100 CFU/ml的菌悬液,做活菌计数备用;取经25 ℃培养24 h的白色念珠菌改良马丁培养基培养物,用0.9%无菌氯化钠溶液10倍稀释至约含50~100 CFU/ml的菌悬液,做活菌计数备用;取经25 ℃培养7 d的黑曲霉改良马丁琼脂培养基斜面培养物,加5 ml生理盐水洗下孢子,吸出孢子悬液(用管口带有薄纱布的无菌毛细吸管吸出胞子悬液)至无菌试管中,用0.9%无菌氯化钠溶液10倍稀释至约含50~100 CFU/ml的孢子悬液,做活菌计数备用。
2.2供试液制备 取本品10 ml,加pH 7.0的无菌氯化钠-蛋白胨缓冲液至100 ml,混匀,即得1:10供试液。
2.3回收率测定
2.3.1供试品对照组 采用薄膜过滤法测定供试品本底细菌数。加入50 ml pH 7.0无菌氯化钠-蛋白胨缓冲液过滤润湿滤膜,取供试液10 ml加至50 ml pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤。用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜4次,每次100 ml。冲洗后取出滤膜,菌面朝上贴于营养琼脂培养基上,置规定温度下培养。
采用薄膜过滤法测定供试品本底霉菌和酵母菌数。方法同上,冲洗后取出滤膜,菌面朝上贴于玫瑰红钠琼脂培养基上,置规定温度下培养。
2.3.2菌液组 分别取上述大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉5种菌悬液1 ml,注入平皿,每株试验菌平行制备2个平皿,倾注琼脂培养基,待凝固后,置规定温度培养,测定所加的试验菌数。
2.3.3试验组 采用薄膜过滤法测定细菌数。采用“2.3.1”方法,在最后一次的冲洗液中分别加入大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌1 ml,混匀,过滤。最后用少量的冲洗液冲洗滤器内壁。冲洗后取出滤膜,菌面朝上贴于营养琼脂培养基上,35 ℃培养72 h。每种菌制备2张滤膜。采用薄膜过滤法测定霉菌和酵母菌数。方法同上,在最后一次的冲洗液中分别加入白色念珠菌、黑曲霉菌1 ml,混匀,过滤。最后用少量的冲洗液冲洗滤器内壁。冲洗后取出滤膜,菌面朝上贴于玫瑰红钠琼脂培养基上,25 ℃培养5 d(延至7 d),每种菌制备2张滤膜。
2.3.4稀释剂对照组 用pH 7.0无菌氯化钠-蛋白胨缓冲液替代供试品。按试验组的方法和条件冲洗,在最后一次的冲洗液中分别加入各阳性试验菌1 ml,混匀,过滤,测定其菌数。
2.3.5结果 各验证菌回收率测定结果见表1。
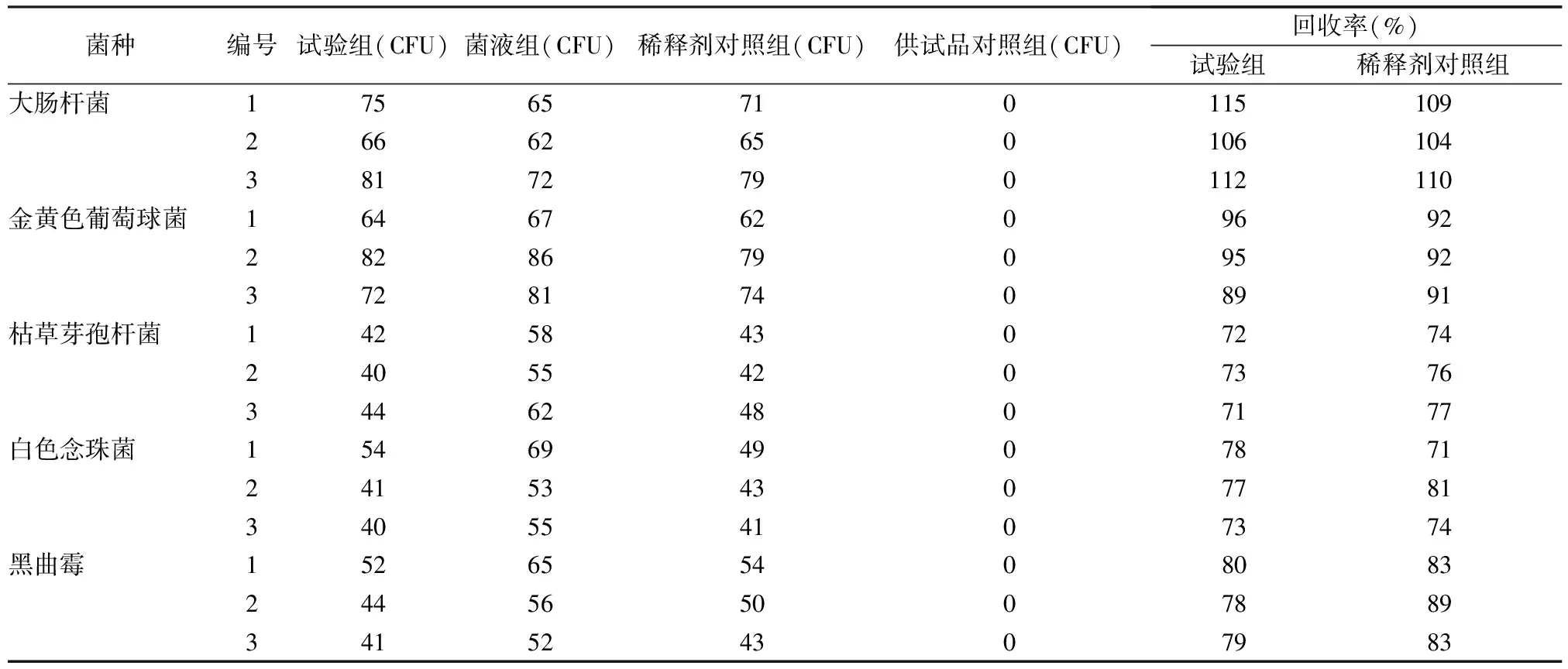
表2 微生物限度检查(薄膜过滤法)各验证菌的回收率(n=3)
2.4控制菌检查方法的验证
2.4.1供试液制备 同“2.2”。
2.4.2铜绿假单胞菌检查方法的验证(结果见表2)。
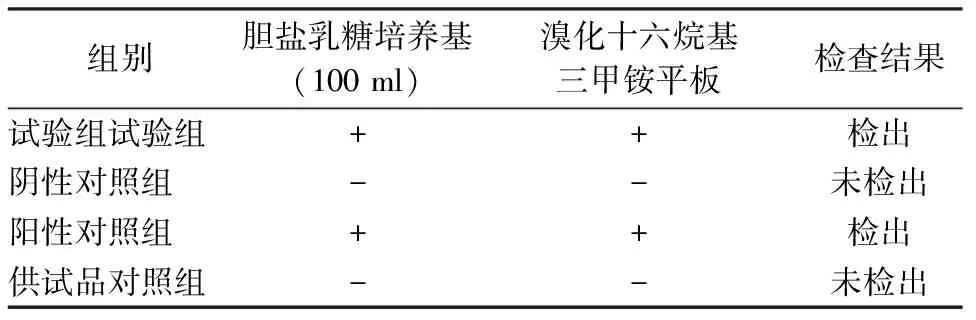
表2 铜绿假单胞菌检查方法验证结果
2.4.2.1供试品对照组 加入50 ml pH 7.0无菌氯化钠-蛋白胨缓冲液过滤润湿滤膜,取供试液10 ml加至50 ml pH 7.0无菌氯化钠-蛋白胨缓冲液中,混匀,过滤。用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜4次,每次100 ml。最后用少量的冲洗液冲洗滤器内壁。冲洗后取出滤膜,放入100 ml胆盐乳糖培养基中35 ℃培养22 h。取上述培养物,划线接种于溴化十六烷基三甲铵琼脂培养基的平板上,培养22 h后,和阳性对照组比较,观察是否有典型菌落生长。
2.4.2.2试验组 方法同供试品对照组,在最后一次的冲洗液中加入铜绿假单胞菌悬液1 ml,混匀,过滤。最后用少量的冲洗液冲洗滤器内壁。冲洗后取出滤膜,放入100 ml胆盐乳糖培养基中35 ℃培养22 h。取上述培养物,划线接种于溴化十六烷基三甲铵琼脂培养基的平板上,培养22 h后,和阳性对照组比较,观察是否有典型菌落生长。
2.4.2.3阳性对照组 取制备好的铜绿假单胞菌菌悬液1 ml加入100 ml的胆盐乳糖培养基中,35 ℃培养22 h。取上述培养物,划线接种于溴化十六烷基三甲铵琼脂培养基的平板上,培养22 h后,观察细菌生长情况。
2.4.2.4阴性对照组 取制备好的大肠杆菌菌悬液1 ml加入100 ml的胆盐乳糖培养基中,35 ℃培养22 h。取上述培养物,划线接种于溴化十六烷基三甲铵琼脂培养基平板上,培养22 h后,观察细菌生长情况 。
2.4.3金黄色葡萄球菌检查方法的验证(结果见表3)。
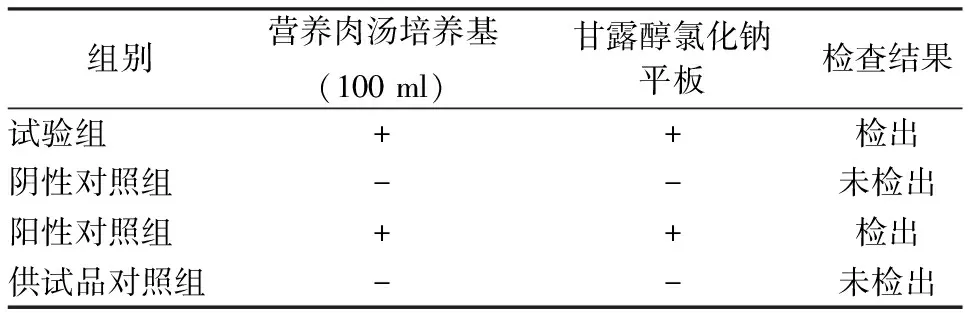
表3 金黄色葡萄球菌检查方法验证结果
2.4.3.1供试品对照组 加入50 ml pH 7.0无菌氯化钠-蛋白胨缓冲液过滤润湿滤膜,取供试液10 ml加至50 ml pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤。用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜4次,每次100 ml。最后用少量的冲洗液冲洗滤器内壁。冲洗后取出滤膜,放入100 ml营养肉汤培养基中35 ℃培养22 h。取上述培养物,划线接种于甘露醇氯化钠琼脂培养基的平板上,培养22 h后,和阳性对照组比较,观察是否有典型菌落生长。
2.4.3.2试验组 方法同供试品对照组,在最后一次的冲洗液中加入金黄色葡萄球菌悬液1 ml,混匀,过滤。最后用少量的冲洗液冲洗滤器内壁。冲洗后取出滤膜,放入100 ml营养肉汤培养基中35 ℃培养22 h。取上述培养物,划线接种于甘露醇氯化钠琼脂培养基的平板上,培养22 h后,和阳性对照组比较,观察是否有典型菌落生长。
2.4.3.3阳性对照组 取制备好的金黄色葡萄球菌菌悬液1 ml加入100 ml的营养肉汤培养基中,35 ℃培养22 h。取上述培养物,划线接种于甘露醇氯化钠琼脂培养基的平板上,培养22 h后,观察细菌生长情况。
2.4.3.4阴性对照组 取制备好的大肠杆菌菌悬液1 ml加入100 ml的营养肉汤培养基中,35 ℃培养22 h。取上述培养物,划线接种于甘露醇氯化钠琼脂培养基的平板上,培养22 h后,观察细菌生长情况。
3 结果
3.1菌落计数验证结果 由表1可知,本品采用薄膜过滤法对细菌的人工染菌回收率进行测定,大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的回收率均高于70%;采用薄膜过滤法对霉菌和酵母菌数的人工染菌回收率进行测定, 白色念珠菌、黑曲霉的人工染菌回收率均高于70%,同时,稀释剂对照组的人工染菌回收率均高于70%。因此,本品的细菌、霉菌和酵母菌数的计数均可采用薄膜过滤法进行测定(冲洗量:100 ml/次,冲洗4次)。
3.2控制菌检查的验证结果 由表2可知,供试品对照组未检出铜绿假单胞菌,试验组、阳性对照组均检出铜绿假单胞菌,本品对铜绿假单胞菌的检查采用薄膜过滤法(冲洗量:100 ml/次,冲洗4次)。
由表3可知,供试品对照组未检出金黄色葡萄球菌,试验组、阳性对照组均检出金黄色葡萄球菌,本品对金黄色葡萄球菌的检查采用薄膜过滤法(冲洗量:100 ml/次,冲洗4次)。
4 方法验证结论及标准修订
本品可采用薄膜过滤法进行细菌、霉菌和酵母菌计数,另可采用薄膜过滤法进行控制菌的检查。根据验证结果将微生物限度检查方法记录如下:
微生物限度 取本品10 ml,加pH 7.0的无菌氯化钠-蛋白胨缓冲液至100 ml,混匀,得1:10供试液。细菌计数采用薄膜过滤法(冲洗量:100 ml/次,冲洗4次) ,霉菌和酵母菌计数采用薄膜过滤法(冲洗量:100 ml/次,冲洗4次),控制菌采用薄膜过滤法进行检查(培养基:100 ml;冲洗量:100 ml/次,冲洗4次)(中国药典2010年版二部附录Ⅺ J),应符合规定。
5 讨论与建议
5.1在选用微生物限度验证方法时,有通用原则,即:“就简不就繁”。而笔者不能直接判定稀苯扎溴铵溶液对细菌、霉菌和酵母菌以及控制菌的抑菌程度,所以在采用薄膜过滤法之前,还考察了常规法和培养基稀释法(0.1 ml/皿 ),由于采用此二法则供试品对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌、白色念珠菌、黑曲霉的人工染菌回收率低于70%。因此,本品细菌、霉菌及酵母菌的计数均应重新选择适当的方法,消除其抑菌活性后再进行验证,并且控制菌也不能检出。所以笔者选用薄膜过滤法。
5.2本品为2002年版《中国人民解放军医疗机构制剂规范》外用非灭菌溶液剂,可参照2010年版《中国药典》中对洗剂或搽剂的检查标准。由于在临床上用于皮肤的消毒,因此建议微生物限度规定值比普通外用制剂的标准更加严格,可以规定为细菌数应不得过10 CFU/ml,霉菌和酵母菌数应不得过10 CFU/ ml,每1毫升不得检出金黄色葡萄球菌和铜绿假单胞菌。
【参考文献】
[1] 国家药典委员会.中华人民共和国药典2010年版二部[S].北京:中国医药科技出版社,2010:附录107-116.
[2] 解放军总后勤部卫生部.中国人民解放军医疗机构制剂规范(2002年版)[S].人民军医出版社,2003:103-104,附录67-80.
[3] 苏德模,马绪荣,许华玉,等. 药品微生物学检验技术[M].华龄出版社,2007:221-227.
[4] 曲 萍,仇丽霞,赵思俊,等.卡波姆抑菌凝胶剂微生物限度检查方法的建立[J].药物分析杂志, 2013,33(8):1317-1321.
[5] 应国红,邓 颖,冯丰凑.外用制剂微生物限度检查方法研究[J].中国药业,2008,17(21):32-33.
[6] 孟丽丽,陆 娟,李晓波,等.烧伤搽剂微生物限度检查法的验证[J].中国药师,2011,14(5):746-747.
