抗菌药物应用专项整治前后鲍曼不动杆菌耐药情况研究
2014-08-06许弄章金忠华王志敬上海市浦东新区周浦医院药剂科上海201318
许弄章,金忠华,王志敬 (上海市浦东新区周浦医院药剂科,上海 201318)
鲍曼不动杆菌是一种重要的革兰阴性条件致病菌,广泛存在于自然界及人体皮肤、胃肠道、上呼吸道等部位,是院内感染的常见病原菌。由于其耐药范围广泛、耐药率高,多重耐药鲍曼不动杆菌已经成为目前大多数医院抗感染治疗的难题。不合理使用抗菌药物可导致病原菌耐药性增强、药源性疾病增加和医疗资源浪费等不良后果。结合卫生部卫办医政发〔2009〕38号等相关文件在全院开展了抗菌药物专项整治活动,对整治前后抗菌药物使用强度、耐药率进行分析,了解抗菌药物应用专项整治活动的效果,掌握抗菌药物使用情况和变化趋势,为以后的管理工作提供理论依据。
1 材料和方法
1.1 菌株来源 2011—2012年周浦医院临床分离的鲍曼不动杆菌菌株。
1.2 细菌分离、鉴别及药物敏感性试验 细菌分离、鉴定按《全国临床检验操作规程》进行,采用法国生物梅里埃细菌鉴定系统的ATBG(-)5复合检测板进行细菌的药敏试验。
1.3 抗菌药物使用情况 利用医院药品使用的计算机管理系统,按季度统计2011—2012年抗菌药物的病区使用率、总的使用强度及β-内酰胺类抗菌药、喹诺酮类、氨基糖苷类药物的使用强度。限定日剂量(DDD)参考《卫生部抗菌药物临床应用监测网药品字典及DDD值》和相关药品说明书制定。抗菌药物使用强度(AUD)以平均每日每百张床位所消耗的DDD数表示,即:
1.4 数据处理 利用Spss19.0将鲍曼不动杆菌的总耐药率抗菌药物的AUD进行相关性研究。
2 结果
2.1 鲍曼不动杆菌的分离率 2011—2012年,按半年统计的分离率分别为7.93%、9.59%、9.29%、9.72%,半年检出菌株数未见较大差异。鲍曼不动杆菌两年间总计470例,占细菌检出总数的9.23%。本院的鲍曼不动杆菌检出率与全国医院监控网所提供的比例[1]相似。具体见表1。
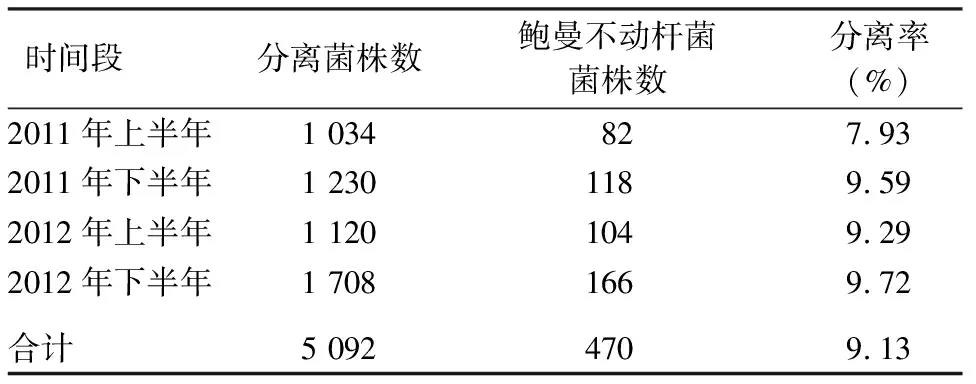
表1 2011—2012年鲍曼不动杆菌的分离率
2.2 鲍曼不动杆菌耐药率的变化 2011—2012年,鲍曼不动杆菌对头孢呋辛、头孢西丁、头孢唑肟的耐药情况变化较小,但一直保持高耐药率,多维持在75%以上,已不推荐用于对抗鲍曼不动杆菌的感染。主要治疗鲍曼不动杆菌感染的头孢他啶、头孢吡肟、亚胺培南及哌拉西林舒巴坦的耐药情况缓解明显,尤其是在2012年底改善尤为突出,依次达到31.83%、27.60%、23.10%和31.82%。氟喹诺酮类和氨基糖苷类的耐药率也有所下降,从50%临界点下降至2012年下半年的20%~30%。详见表2。
2.3 抗菌药物的使用强度 自2011年起,通过两年抗菌药物临床应用专项整治,我院抗菌药物的使用呈下降趋势,抗菌药物总的AUD下降41.65,β-内酰胺类抗菌药的AUD下降22.22,氟喹诺酮类药物AUD下降4.19,氨基糖苷类的AUD下降3.6。而主要用于鲍曼不动杆菌感染治疗的抗菌药的AUD则从27.73降至12.68,下降15.05。具体见表3。

表2 2011—2012年鲍曼不动杆菌对不同抗菌药物的耐药率(株数,%)

表3 2011—2012年不同类别抗菌药物使用强度(AUD)
2.4 鲍曼不动杆菌的耐药情况与AUD的相关性 鲍曼不动杆菌对头孢他啶和亚胺培南的耐药情况与β-内酰胺类抗菌药物的AUD高度相关,对左氧氟沙星的耐药率与氟喹诺酮类药物的AUD成正相关,氨基糖苷的耐药情况与使用不呈相关关系。r>0.8呈高度相关、r<0.3基本不相关[2],见表3。
3 讨论
抗菌药物的AUD是目前监测抗菌药物的重要指标[3],可以评价抗菌药物的使用广度和强度,从而采取相关的干预措施。 本次研究显示,在抗菌药物专项整治过程中,严格控制抗菌药物的用法用量,降低抗菌药物的使用强度,对控制目标细菌的耐药率有很大的作用。如表1所示,在近两年的抗菌药物专项整治中,各类抗菌药物的AUD均呈下降趋势;伴随着抗菌药物使用的减少,耐药率的缓解虽呈滞后的情况,但是如表2所示,至2012年底,通常对鲍曼不动杆菌有较强作用的头孢他啶、头孢吡肟、美罗培南和哌拉西林舒巴坦等药物的耐药率也下降20%~30%,氟喹诺酮和氨基糖苷类药物对鲍曼不动杆菌的耐药情况稳中有降,而一二代头孢菌素及头霉素类对鲍曼不动杆菌始终保持高耐药,无明显缓解。
在抗菌药专项整治过程中,我院将四代头孢、碳青霉烯类和哌拉西林/舒巴坦按特殊类抗菌药物进行管理。严格规范医生的使用级别,并需抗菌药物会诊专家组成员会诊;按照药敏试验规范临床应用;头孢他啶则剔除出35个品种不再使用,使得这4类药物的AUD从10.41下降至5.17。同时所有β-内酰胺类药物的AUD下降了22.22。表明鲍曼不动杆菌产生耐药不仅与目标抗菌药物的AUD密切相关,还与作用机制类似的其他酰胺类药物呈相关关系。在β-内酰胺类药物使用过程中,均可诱导该细菌产生β-内酰胺酶,是其耐药的最主要原因,包括超光谱β-内酰胺酶类(ESBLs)、金属酶类、AmpC酶和OXA型酶。该菌主要通过质粒介导或染色体突变诱导产生β-内酰胺酶,破坏该类药物内酰胺结构,使抗菌药物丧失活性。ESBLs是细菌质粒介导产生能水解甲氧亚氨基β-内酰胺类抗生素,如头孢他啶、氨曲南等。TEM型ESBLs有70余种,其中TEM-1是革兰阴性菌中最常见的β-内酰胺酶,TEM-2的基因介导对β-内酰胺类耐药[4]。TEM-1,TEM-2在鲍曼不动杆菌的广泛存在,是其对β-内酰胺类耐药的主要机制。有研究显示30%鲍曼不动杆菌携带由质粒突变酶[5]。AmpC酶主要由头霉素、碳青霉烯和β-内酰胺酶抑制剂诱导产生[6],如2011—2012年头霉素类的AUD依次为15.34、9.37、5.43、1.20,显示规范头霉素的使用也可以降低鲍曼不动杆菌耐药的产生。按照Albmer分子分类将碳青霉烯酶分为A、B、D三类,其中D类仅见于不动杆菌,B类为金属酶,见于铜绿假单胞菌、不动杆菌和肠杆菌属,所以临床上广泛使用抗铜绿假单胞菌的哌拉西林可诱导鲍曼不动杆菌耐药,这也造成鲍曼不动杆菌对哌拉西林的耐药率居高不下。
严格控制氟喹诺酮类药物的临床使用是本次抗菌药物专项整治的另一个重要任务。该类药物经验性治疗仅用于肠道感染、社区获得性呼吸道和泌尿道感染,通过严格控制其作为外科手术预防用药和筛选临床路径中药品的备选品种,氟喹诺酮类药物的AUD由9.05降至4.86,见表3。氟喹诺酮类药物通过DNA拓扑异构酶突变和外膜通透性改变、主动流出泵外排系统,改变药物作用靶位和降低菌体内药物浓度以逃避该类药物的杀灭作用[7]。有报道,鲍曼不动杆菌决定细胞内药物吸收量和药物主动排出系统的基因突变,导致外膜蛋白表达量降低,可刺激细菌主动排除药物,降低药效[8]。因此,降低氟喹诺酮的AUD的主要途径不是降低药物使用的单次剂量,而是应该规范临床使用方法,通过降低使用率和使用天数,才能达到最优的效果。
氨基糖苷类药物使用量很低,且耐药情况也不严重。在临床中,氨基糖苷类的副作用限制其广泛使用,也正因为如此,才保证其在单用或同内酰胺类药物协同作用中抗鲍曼不动杆菌的高敏感性,是临床上比较有优势的替代品种。
综上所述,通过抗菌药物应用专项整治,促进抗菌药物临床合理使用,对降低细菌的耐药情况有改善作用,有利于一些处在耐药临界点的抗菌药物的合理应用。规范抗菌药物临床应用的主题要一直坚持,其中的技术指标要细化,加强学习培训,通过医疗团队的合作,以保证抗菌药物的应用安全、有效、合理、经济。
【参考文献】
[1] 张世阳,连羡玉 ,金旭红,等.Cox-Staurt趋势检验分析医院感染鲍曼不动杆菌耐药趋势[J].中国全科医学,2012,15(4):450-453.
[2] 李可强,张振秋 ,董 平.SPSS统计软件在药学研究中的应用——相关分析与回归分析[J].中医药学刊,2006,24(7):1300-1301.
[3] 中华人民共和国卫生部.抗菌药物临床应用管理办法[Z].2012-08-01.
[4] Segal H, Nelson EC,Elisha BG. Genetic environment and transcription of AmpC in an Acinetobacter baumannii clinical isolate. Antimicrob Agents Chemother, 2004, 48(2): 612-614.
[5] 显 劲,袁汉尧,戴湘春,等.98例鲍曼不动杆菌的β-内酰胺酶的检测及耐药分析[J].中国热带医学, 2007, 7(3): 405-406.
[6] Devaud M, Kayser FH, Bachi B. Transposon-mediated multiple antibiotic-resistance in acinetobacter strains[J].Antimicrob Agents Chemother,1982, 22 (2): 323-329.
[7] Shen LL, Mitscher LA, Sharma PN,etal. Mechanism of inhibiiton of DNA gyrase by quinolone antibacterials: a cooperative drug DNA binding model[J].Biochemistry,1989, 28 (9): 3886-3894.
[8] 糜祖煌,秦 玲.多药耐药鲍氏不动杆菌5类抗菌药物机制研究[J].中华医院感染学杂志, 2008, 18(7): 761-764.
